
- •Тема 1. Периодическая система и строение атомов
- •Темы 2-3. Химическая связь. Строение вещества в конденсированном состоянии
- •Метод валентных связей
- •Теория гибридизации
- •Метод молекулярных орбиталей
- •Тема 4. Скорость химических реакций, основные понятия термодинамики
- •Обратимость химических реакций.
- •Смещение химического равновесия
- •Химическая термодинамика
- •Тема 5. Растворы
- •Способы выражения концентрации растворов
- •Коллигативные свойства растворов
- •Тема 6. Растворы электролитов
- •Сильные электролиты (уравнения диссоциации)
- •Слабые электролиты (уравнения диссоциации)
- •Теория сильных электролитов
- •Теория слабых электролитов
- •Ионные уравнения реакций
- •Тема 7. Равновесия в растворах, протолитическое равновесие, гидролиз солей Диссоциация воды. Водородный и гидроксильный показатели
- •Произведение растворимости
- •0,01 Моль 0,01 моль 0,01 моль
- •Гидролиз солей
- •Описание гидролиза как обратимого процесса
- •Тема 8. Окислительно-восстановительные реакции и электрохимия
- •Метод электронного баланса
- •Метод полуреакций (электронно-ионного баланса)
- •Электрохимические процессы
- •Электродные потенциалы
- •Гальванические элементы
- •Аккумуляторы
- •Электролиз
- •Тема 9. Химическая связь в комплексных соединениях
- •Координационная теория Вернера
- •Номенклатура комплексных соединений
- •Диссоциация комплексных соединений
- •Природа химической связи в комплексах
- •Тема 10. I-II группы псэ Главная подгруппа I группы
- •Соединения щелочных металлов
- •Побочная подгруппа I группы
- •Серебро
- •Главная подгруппа II группы
- •Жесткость воды и методы ее устранения
- •Побочная подгруппа II группы
- •Цинк и кадмий
- •Химические свойства
- •Тема 11. III-IV группы псэ Главная подгруппа III группы
- •Химические свойства
- •Алюминий
- •Химические свойства
- •Галлий, индий, таллий
- •Химические свойства
- •Побочная подгруппа III группы
- •Химические свойства
- •Лантаноиды
- •Химические свойства
- •Актиноиды
- •Химические свойства
- •Главная подгруппа IV группы
- •Углерод
- •Химические свойства
- •Кремний
- •Химические свойства
- •Германий, олово, свинец
- •Химические свойства
- •Побочная подгруппа IV группы
- •Химические свойства
- •Тема 12. V группа псэ Главная подгруппа V группы
- •Химические свойства
- •Азотная кислота и ее соли
- •Химические свойства
- •Мышьяк, сурьма, висмут
- •Химические свойства
- •Побочная подгруппа V группы
- •Химические свойства
- •Тема 13. VI группа псэ
- •Химические свойства
- •Селен, теллур, полоний
- •Химические свойства
- •Побочная подгруппа VI группы
- •Химические свойства
- •Молибден, вольфрам
- •Химические свойства
- •Тема 14. VII-VIII группы псэ Водород и главная подгруппа VII группы Водород
- •Физические свойства:
- •Химические свойства
- •Главная подгруппа VII группы
- •Химические свойства
- •Химические свойства
- •Кислородсодержащие соединения хлора
- •Химические свойства
- •Побочная подгруппа VII группы
- •Химические свойства марганца
- •Главная подгруппа VIII группы
- •Физические свойства инертных (благородных) газов
- •Химические свойства
- •Побочная подгруппа VIII группы
- •Общие свойства триад.
- •Химические свойства
- •Кобальт, никель
- •Химические свойства
- •18.2.3. Платиновые металлы
Тема 6. Растворы электролитов
Было установлено, что многие вещества, при растворении в полярных растворителях (например, в воде) распадаются на ионы. Такие вещества называются электролитами, а процесс распада на ионы называется электролитической диссоциацией (ЭД).
Электролитическая диссоциация является следствием взаимодействия вещества с молекулами растворителя. В ходе этого процесса образуются ионы, окруженные молекулами растворителя - так называемой сольватной оболочкой (если растворителем является вода, оболочка называется гидратной). Ион вместе с сольватной оболочкой называется сольватированным (в случае воды - гидратированным или акватированным).
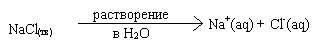
Индекс (aq) означает, что данный ион акватирован. Очень часто этот индекс опускается.
Основной количественной характеристикой процесса ЭД является степень электролитической диссоциации (точнее: истинная степень ЭД). Степень электролитической диссоциации () - это отношение числа молекул данного вещества, распавшихся на ионы (np) к общему числу молекул в данном растворе (n0):
=
![]() .
.
В соответствии со значениями все вещества по отношению к данному растворителю можно разделить на 3 типа:
= 0 неэлектролиты,
0 1 cлабые электролиты,
= 1 cильные электролиты.
Сильные электролиты (уравнения диссоциации)
По современным представлениям, диссоциация сильного электролита является необратимым процессом ( = 1). В растворе сильного электролита нет его молекул, а есть только ионы, на которые он продиссоциировал. К сильным электролитам относятся:
1. Все соли. Соль диссоциирует как сильный электролит на кислотные остатки и основные остатки:
Fe2(SO4)3
= 2 Fe+3
+ 3 SO![]() ,
,
NaHCO3
= Na+
+ HCO![]() ,
,
AlOHCl2 = AlOH+2 + 2 Cl- .
2. Некоторые основания (они называются сильными основаниями или щелочами):
NaOH = Na+ + OH- ,
Ba(OH)2 = Ba+2 + 2OH- .
3. Некоторые кислоты (они называются сильными кислотами):
HCl = H+ + Cl- ,
HMnO4
= H+
+ MnO![]() ,
,
H2SO4
= H+
+ HSO![]() .
.
Слабые электролиты (уравнения диссоциации)
В отличие от сильных электролитов, слабые электролиты подвергаются ЭД обратимо. В растворе слабого электролита кроме ионов всегда присутствуют недиссоциированные молекулы. Причем, если раствор не слишком сильно разбавлен, целых молекул слабого электролита в нем, как правило, значительно больше, чем ионов.
К слабым электролитам относятся:
1. Многие кислоты (они называются слабыми) и все гидроанионы:
H2CO3
![]() H+
+ HCO
H+
+ HCO![]() ,
,
HCO![]()
![]() H+
+ CO
H+
+ CO![]() ,
,
CH3COOH
![]() CH3COO-
+ H+
,
CH3COO-
+ H+
,
HSO![]()
![]() H+
+ SO
H+
+ SO![]() .
.
2. Многие основания (они называются слабыми) и все гидроксокатионы:
Fe(OH)2
![]() FeOH+
+ OH-
,
FeOH+
+ OH-
,
FeOH+
![]() Fe+
+ OH-
,
Fe+
+ OH-
,
NH4OH
![]() NH
NH![]() + OH-
.
+ OH-
.
3. Все амфотерные гидроксиды, их гидроанионы и гидроксокатионы:
Zn(OH)2
![]() ZnOH+
+ OH-
,
ZnOH+
+ OH-
,
ZnOH+
![]() Zn+2
+ OH-
,
Zn+2
+ OH-
,
H2ZnO2
![]() H+
+ HZnO
H+
+ HZnO![]() ,
,
HZnO![]()
![]() H+
+ ZnO
H+
+ ZnO![]() .
.
Теория сильных электролитов
По определению, для сильных электролитов истинная степень диссоциации = 1. И, действительно, в их растворах не обнаружено целых (недиссоциированных) молекул.
Несмотря на это многие экспериментальные методы исследования степени диссоциации (самый простой основан на измерении электропроводности растворов) дают значения этой величины меньше 1.
Экспериментальное значение степени диссоциации сильного электролита называется кажущейся степенью ЭД (к), причем всегда к = 1 ( - истинная степень ЭД).
Кажущаяся степень ЭД зависит от концентрации сильного электролита в растворе (чем больше концентрация, тем меньше к).
Несоответствие между и к объясняется взаимодействием сольватированных ионов электролита с образованием ионных пар.
Рассмотрим, например, явления происходящие в водном растворе хлорида натрия. Как и любой другой сильный электролит, твердый NaCl переходит в раствор только в виде ионов (Na+ и Cl-). Ионы эти гидратированы (окружены диполями молекул воды):

Внешняя поверхность гидратной оболочки имеет тот же по знаку заряд, что и центральный ион. Сольватированные катион и анион в результате столкновения друг с другом могут образовывать неустойчивую квазичастицу: Na+(aq) Cl- (aq). Эта квазичастица называется ионной парой. Ионные пары довольно легко разрушаются при соударении с другими частицами. Описанные выше явления можно изобразить в виде схемы:

Если через раствор NaCl пропускать электрический ток, то ионные пары, как частицы в целом электронейтральные, не будут участвовать в электропроводности. Дальнейший расчет дает значение степени ЭД меньше 1. Понятно, что при увеличении концентрации увеличивается количество ионов в растворе, а значит усиливается ион-ионное взаимодействие с образованием ионных пар. Это приводит к уменьшению к .
Во многих физических и химических процессах ионные пары ведут себя подобно “молекулам”, хотя, конечно, таковыми не являются. В ионной паре нет химической связи между центральными ионами, взаимодействуют только их гидратные оболочки.
Для учета отмеченных выше явлений вводится понятие об активности иона. Активность равна концентрации свободных ионов данного вида в растворе. Например, для ионов натрия:
a (Na+) = fa [Na+],
где а (Na+) - активность ионов натрия; fa - коэффициент активности ионов; [Na+] - общая молярная концентрация ионов Na+ в растворе (как свободных, так и входящих в ионные пары).
Коэффициент активности (fa) показывает, какая часть ионов данного вида не входит в состав ионных пар, т.е. участвует в различных электрических и ионных процессах.
Для сильно разбавленных растворов коэффициент активности можно рассчитать. Сначала находится значение ионной силы раствора (J):
J =
![]() (
(![]()
![]() +
+
![]() + . . . .
+ . . . .
![]() )
,
)
,
где
![]() ,
,![]() . . . .
. . . .![]() - молярные концентрации каждого из ионов
в растворе;
- молярные концентрации каждого из ионов
в растворе;
![]() ,
,![]() . . . .
. . . .![]() - их заряды.
- их заряды.
Коэффициент активности данного иона рассчитывается по уравнению:
lg fa
= - 0,5
![]()
![]() ,
где
,
где![]() -
заряд этого иона.
-
заряд этого иона.
