
- •Количественное определение спирта этилового в фармацевтических препаратах
- •Глицерол (глицерин)
- •Получение глицерола
- •Чистота
- •Отсутствие мышьяка.
- •Сульфатная зола.
- •Количественное определение
- •Методы, применяемые для количественного определения глицерина и его однокомпонентных растворов (препаратов).
- •Условия метода:
- •Методы, применяемые для количественного определения глицерина в составе многокомпонентных препаратов.
- •Действие. Применение.
- •Формы выпуска
Чистота
-
Кислотность или щелочность (см. раздел «Анализ на доброкачественность и чистоту» спирта этилового).
-
Предельное содержание общих примесей (хлоридов, сульфатов, тяжелых металлов, железа, солей аммония).
-
Отсутствие мышьяка.
-
Сульфатная зола.
-
Акролеин и другие восстанавливающие вещества. Реакция с серебра нитратом в аммиачной среде. Не должно наблюдаться образования темного осадка, мути или помутнения жидкости. При наличии примеси протекает реакция окисления-восстановления (серебряного зеркала). Примеси восстанавливают Ag+ до металлического серебра. Примеси должны отсутствовать.
-
Содержание воды. Метод Фишера (от 11,5 до 15,5%).
-
Эфирное число (не более 0,65). Показывает количество примесей сложных эфиров в глицерине.
-
Легко обугливающиеся органические примеси. Смешивают равные объемы ЛП и конц. H2SO4. Через 1 мин. замечают результат. Допускается желтое, но не бурое или черное окрашивание.
-
Микробиологическая чистота (ОФС 42-0067-07). Должен выдерживать требования категории 2. В 1 г субстанции общее число аэробных бактерий и грибов (суммарно) допускается на более 102. Требуется отсутствие бактерий семейства Enterobacteriaceae, Pseudomonas aeruginosa и Staphylococcus aureus.
Количественное определение
-
Методы, применяемые для количественного определения глицерина и его однокомпонентных растворов (препаратов).
1.1. Перйодатный метод (метод Малапрада). Фармакопейный метод определения субстанции глицерина. Основан на восстановительных свойствах глицерина. Глицерин как многоатомный спирт окисляется сильными окислителями с разрывом углеводородной цепи. Окислитель – йодная кислота в кислой среде.
HIO4 – йодная кислота
KIO4 – перйодат калия
HIO3 – йодноватая кислота
KIO3 – йодат калия
При окислении 1 моль глицерина образуется 2 моль формальдегида и 1 моль муравьиной кислоты.
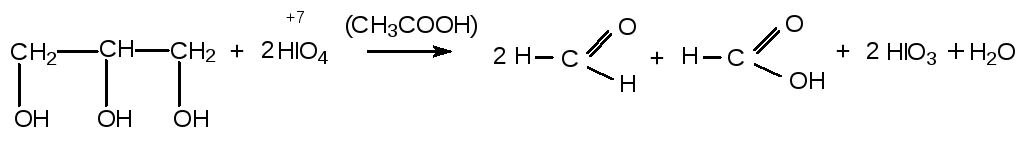
Йодная кислота восстанавливается до йодноватой кислоты.
К навеске глицерина прибавляют избыток реагента – йодной кислоты и оставляют на 10 мин. Протекает реакция окисления-восстановления. Затем к реакционной массе прибавляют избыток KI и H2SO4. Протекают реакции:
HIO4 + 7KI + 7H2SO4 4I2 + 7KHSO4 + 4H2O
HIO3 + 5KI + 5H2SO4 3I2 + 5KHSO4 + 3H2O
Выделяется эквивалентное количество йода, который титруют натрия тиосульфатом.
![]()
Параллельно проводится контрольный опыт (без глицерина). Берут то же количество йодной кислоты, прибавляют калия йодид и серную кислоту и титруют раствором натрия тиосульфата.
HIO4 + 7KI + 7H2SO4 4I2 + 7KHSO4 + 4H2O
В расчетах учитывают разность объемов Na2S2O3:
V Na2S2O3 (контр. опыт) – V Na2S2O3 (на определение глицерина)
V Na2S2O3 (контр. опыт) >V Na2S2O3 (на определение глицерина),
т.к. в контрольном опыте вся HIO4 реагирует с KI, количество выделяющегося йода больше.
Расчет f экв. Проводится косвенным способом по изменению степени окисления реагента:
+7 +4 электрона +5
1 моль глицерина – 2 моль HIO4 2 моль HIO3
