
- •Лекция 2. Расчет основных термодинамических величин δu, q, w.
- •1. Термодинамические характеристические функции (функции состояния).
- •1.1. Внутренняя энергия и ее основное свойство.
- •1.2. Энтальпия.
- •1.3. Свободная энергия и свободная энтальпия.
- •1.4. Дифференциальные соотношения термодинамики.
- •2. Внешние воздействия (функции процесса).
- •2.1. Расчет количества теплоты и теплоемкости.
- •Расчет количества теплоты и энтропия.
- •3. Термодинамические свойства веществ.
- •3.1. Свойства веществ и расчет внутренней энергии и энтальпии.
- •3.1.1. Идеальный газ.
- •3.2. Внутренняя энергия идеального газа (свойства и расчет).
- •3.3. Свойства веществ и расчет изменения энтропии.
- •4. Расчет количества работы.
- •4.1. Введение.
- •4.2. Расчет работы в технической термодинамике.
- •5. Основы графического метода в термодинамике.
- •5.1. P – V диаграмма.
- •5.2. T – s диаграмма.
Лекция 2. Расчет основных термодинамических величин δu, q, w.
В предыдущей лекции первый закон термодинамики, будучи специализированной формой записи закона сохранения энергии, был записан в виде:
du=Tds–pdv(2.1)
Здесь приращение внутренней энергии выражено через параметры состояния рабочего тела: термические T и s и деформационные р и v. Первое слагаемое в (2.1) справа представляет собой количество термического взаимодействия между внешней средой и рабочим телом dq = Tds, т.е. количество теплоты, подведенной (отведенной) к рабочему телу. Второе – количество деформационного взаимодействия между внешней средой и системой, т.е. работу сжатия (расширения) dw = pdv. Поэтому иногда удобно записывать первый закон термодинамики (2.1) в виде:
du=dq–dw, (2.2)
где слева характеристика энергии системы, а справа – количества воздействий внешней среды на систему.
В основном уравнении термодинамики (2.2) фигурируют три величины. Чтобы это уравнение стало расчетным инструментом термодинамики, необходимо дать правила независимого расчета по крайней мере двух величин из трех, входящих в (2.2). Начнем с анализа функции u(s,v).
1. Термодинамические характеристические функции (функции состояния).
1.1. Внутренняя энергия и ее основное свойство.
Рассмотрим интеграл по замкнутому контуру (циклу) от основного уравнения (2.2)
![]()
и обратимся к рисунку (2.1).
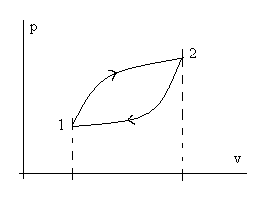
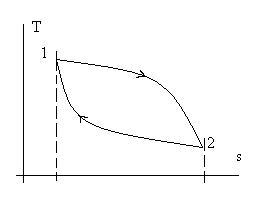
Рис. 2.1. Иллюстрация к пояснению полноты дифференциала du.
Пусть процесс начинается в состоянии (точке) 1, доходит до состояния (точки) 2 и завершается снова в точке 1. Из определения понятия уравнения состояния следует, что
T=T(s,v) иp=p(s,v).
Эти же аргументы относятся к функции (см. (2.1)) u=u(s,v), т.е. u(∙) зависит только от координат (параметров) состоянияsиvтермодинамической системы, и это естественно с физической точки зрения – ее возврат в исходное состояние (точка 1), где внутренняя энергия имеет толькоодноопределенное значение. Следовательно, для замкнутых (круговых) процессов – в термодинамике они названы циклами:
![]() (2.3)
(2.3)
Поэтому из математического анализа (из теории функций многих переменных) следует, что du – полный дифференциал и изменение функции Δuв любомпроцессе 1 - 2
u2–u1=![]() (2.4)
(2.4)
или в графической форме - при переходе от точки 1 к точке 2 - не зависит от траектории процессаперехода из точки в точку (см. рис 2.2), а в действительных явлениях характер процесса не влияет на изменение внутренней энергии – оно определяетсятолькосостоянием (параметрами) в начале и конце процесса.
Рис. 2.2. Изменение внутренней энергии u(s,v) не зависит
от траектории F(s,v) = 0 перехода из точки 1 в точку 2.
Определение. Величины (функции), изменение которых не зависят от характера процесса, а определяются только состояниями (параметрами) начала и конца процесса, называются функциями состояния.
1.2. Энтальпия.
Вновь вернемся к первому закону термодинамики, записанного через параметры состояния (2.1). Справа и слева в уравнении (2.1) прибавим полный дифференциал d(pv) и проведем простые преобразования:
du+d(pv) =Tds–pdv+d(pv) →d(u+pv) =Tds+vdp→dh=Tds+vdp. (2.5)
Эта цепочка равенств - справедлива, т.к. сумма полных дифференциалов равна дифференциалу суммы функций, а d(pv) = pdv + vdp по правилу дифференцирования произведения функций. В (2.5) мы приняли, что
h≡u+pv, Дж/кг или Дж/кмоль. (2.6)
Это тождество по существу является определениемновой функции h(s,v), которая по построению является функцией состояния и стандартизованно ее называют энтальпией (ранее в термодинамике называлась теплосодержанием).
