
Лекция № 6
Основные понятия и законы термохимии и термодинамики взрывчатых превращений. ОСНОВНЫЕ ФОРМЫ СОВЕРШАЕМОЙ РАБОТЫ ПРИ ВЗРЫВЕ
Химическая термодинамика изучает химические реакции и физико-химические процессы с помощью термодинамических методов. Она исследует возможность или невозможность протекания в системе строго определенных реакций, описанных уравнением, точно характеризующим начальное и конечное состояние системы. Промежуточные состояния не исследуются, не изучается и механизм реакций.
Основные задачи термодинамики:
определение тепловых эффектов реакций;
установление условий возможности или невозможности их протекания в том или ином направлении;
установление условий, при которых возможно химическое равновесие между компонентами в системе.
Специфической особенностью термодинамического подхода является то, что термодинамическая невозможность есть вывод окончательный, а термодинамическая возможность не всегда означает осуществимость реакции.
Уравнение, связывающее термодинамические параметры системы в равновесном состоянии, называется уравнением состояния.
Общий вид:
φ (P,V,T)=O
Уравнение состояния идеальных газов:
PV=nRT (Уравнение Менделеева-Клайперона)
1-й закон термодинамики. Представляет собой формулировку обобщённого закона сохранения энергии для термодинамических процессов. В наиболее простой форме его можно записать как dU = d'A + d'Q, где dU есть полный дифференциал внутренней энергии системы, а d'Q и d'A есть элементарное количество теплоты и элементарная работа, совершенная над системой соответственно.
2-й закон термодинамики: Второй закон термодинамики исключает возможность создания вечного двигателя. Имеется несколько различных, но в тоже время эквивалентных формулировок этого закона. 1 - Постулат Клаузиуса. Процесс, при котором не происходит других изменений, кроме передачи теплоты от горячего тела к холодному, является необратимым, то есть теплота не может перейти от холодного тела к горячему без каких либо других изменений в системе. Это явление называют рассеиванием или дисперсией энергии. 2 - Постулат Кельвина. Процесс, при котором работа переходит в теплоту без каких либо других изменений в системе, является необратимым, то есть невозможно превратить в работу всю теплоту, взятую от источника с однородной температурой, не проводя других изменений в системе.
3-й закон термодинамики: Теорема Нернста: Энтропия любой системы при абсолютном нуле температуры всегда может быть принята равной нулю.
Что такое энтропия? Ответ: От греческого entropia -- поворот, превращение. Понятие энтропии впервые было введено в термодинамике для определения меры необратимого рассеяния энергии.
Энтропия -- это функция состояния, то есть любому состоянию можно сопоставить вполне определенное (с точность до константы -- эта неопределенность убирается по договоренности, что при абсолютном нуле энтропия тоже равна нулю) значение энтропии.
Поэтому энтропия адиабатически изолированной (нет подвода или отвода тепла) системы при необратимых процессах может только возрастать.
Используя понятие энтропии Клаузиус (1876) дал наиболее общую формулировку 2-го начала термодинамики: при реальных (необратимых) адиабатических процессах энтропия возрастает, достигая максимального значения в состоянии равновесия (2-ое начало термодинамики не является абсолютным, оно нарушается при флуктуациях).
Подводим итог: Что бы мы не делали -- энтропия увеличивается, следовательно любыми своими действиями мы увеличиваем хаос, и, следовательно, приближаем "конец света". Вероятно, можно точно подсчитать, когда он, то есть "конец света", наступит, но я думаю, что ближайшие несколько миллиардов лет можно об этом не беспокоиться.
Следствием первого закона термодинамики (закона сохранения энергии) является следующее.
Изменение внутренней энергии ΔU при химической реакции может сопровождаться в общем случае отдачей тепла Q во внешнюю среду и совершением работы А против внешней среды.
ΔU = U2-U1 = Q-A = Q – pΔV = Q- P(V2-V1)
U2, U1 – внутренняя энергия продуктов реакции и исходных веществ.
Р – давление, при котором находится система.
V2, V1 – объёмы продуктов реакции и исходных веществ.
Если реакция протекает при постоянном объеме (изохорный процесс), то Q v = ΔU, т.е. тепловой эффект такой реакции равен изменению внутренней энергии.
Если реакция протекает при постоянном давлении (изобарный процесс), то
Qp=ΔU+A=U2-U1+P(V2-V1)=(U2+PV2)-(U1+PV1)
В термодинамике величину U+PV называют энтальпией и обозначают Н.
Q p =H2-H1=ΔH
|
H = U + PV |
где V – объем системы.
|
|
|
ΔH = ΔU + PΔV |
Энтальпия имеет размерность энергии (кДж). Ее величина пропорциональна количеству вещества; энтальпия единицы количества вещества (моль) измеряется в кДж∙моль–1.
В термодинамической системе выделяющуюся теплоту химического процесса условились считать отрицательной (экзотермический процесс, ΔH < 0), а поглощение системой теплоты соответствует эндотермическому процессу, ΔH > 0.
Уравнения химических реакций с указанием энтальпии процесса называют термохимическими. Численные значения энтальпии ΔH указывают через запятую в кДж и относят ко всей реакции с учетом стехиометрических коэффициентов всех реагирующих веществ. Поскольку реагирующие вещества могут находиться в разных агрегатных состояниях, то оно указывается нижним правым индексом в скобках: (т) – твердое, (к) – кристаллическое, (ж) – жидкое, (г) – газообразное, (р) – растворенное. Например, при взаимодействии газообразных H2 и Cl2образуются два моля газообразного HCl. Термохимическое уравнение записывается так:
|
|
|
|
При взаимодействии газообразных H2 и O2 образующаяся H2O может находиться в трех агрегатных состояниях, что скажется на изменении энтальпии:
|
|
|
|
|
|
|
|
Приведенные
энтальпии образования (реакций) отнесены
у стандартным условиям температуры и
давления (T
= 298 K, P
= 101,325 кПа). Стандартное
состояние
термодинамической функции, например,
энтальпии, обозначается нижним и верхним
индексами:
![]() нижний
индекс обычно опускают: Δ
нижний
индекс обычно опускают: Δ![]() .
.
То есть, тепловой эффект химической реакции при постоянном давлении равен изменению энтальпии при реакции.
Реакции с выделением тепла называются экзотермическими, с поглощением эндотермическими. Существует две системы знаков тепловых эффектов. В старой системе используют понятие теплота (реакции, сгорание и т.д.), в ней экзотермический тепловой эффект положителен. В новой эгоистической системе тепловые эффекты рассматривают с точки зрения системы. Поэтому экзотермический эффект в ней отрицательный (система отдает тепло).
В этой системе чаще используют понятие энтальпии. Энтальпия экзотермической реакции отрицательна (- ΔН0).
Пример: CH4 + 2O2→ CO2 +2H2O
-74,9 2х0 (-393,5) 2х(-241,8)газ
-74,9 -877,1
ΔН=Н2-Н1= -877,1-(-74,9)=-802,2 кДж
Реакция идет с выделением тепла (экзотермическая).
Вывод: термодинамически возможно протекание реакции в форме горения или детонации, но это не достаточное условие.
Кроме того, из первого закона термодинамики вытекает то, что изменение внутренней энергии круговых процессов равно нулю.
А это значит что, при разложении сложного вещества на простые элементы поглощается такое же количество тепла, какое выделяется при его образовании из них.
Другой, ещё более важный закон термодинамики, вытекающий из первого закона термодинамики, был открыт петербургским профессором
Г. И. Гессом ещё в 1840 году.
Закон Гесса
Количество тепла, выделяющееся или поглощающееся при химических реакциях, зависит только от начального или конечного состояния веществ, участвующих в реакциях, а не от пути, каким вещества перешли из начального в конечное состояние.
Оговорка: баланс работы должен быть равен нулю. Обязательным условием при проведении расчетов по закону Гесса является написание уравнения. Кроме того, закон является вполне строгим лишь для процессов, протекающих либо при постоянном давлении, либо при постоянном объеме.
Из вышесказанного видно, что закон Гесса позволяет обращаться с термохимическими уравнениями как с алгебраическими, т. е. складывать и вычитать их, если термодинамические функции относятся к одинаковым условиям.
Например, диоксид углерода можно получить прямым синтезом из простых веществ (I) или в две стадии через промежуточный продукт (II):
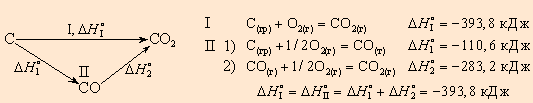
Закон Гесса позволяет очень точно определить тепловые эффекты достаточно сложных изменений системы исходя из других изменений в этой же системе.
Q0обр.пр.сгор.=Q0обр.вещества+Q0сгор.
Например, весьма сложно определить теплоту образования сложных химических соединений. Но если сжечь это вещество и замерить теплоту сгорания, то, зная продукты сгорания и теплоты их образования, можно очень точно рассчитать теплоту образования вещества.
Именно так на практике через теплоту сгорания и определяют теплоты образования сложных веществ.
Основные тепловые эффекты термохимии взрывчатых веществ.
В теории ВВ приходится иметь дело со следующими тепловыми эффектами: энтальпиями или теплотами образования, сгорания (в кислороде), горения и взрыва.
Стандартная энтальпия образования – тепловой эффект реакции образования одного моля соединения из простых веществ при стандартных условиях. Обозначается ΔН0298(обр).
Принято, что энтальпия образования простых веществ в том состоянии, в котором они находятся при стандартных условиях (атом или молекула, газ или жидкость, твердое ) равна нулю.
Теплотой сгорания называют тепловой эффект реакции одного моля или единицы массы данного соединения с кислородом, при котором образуются высшие окислы CO2 и H2O; азот и галоген (за исключением F) выделяются в свободном состоянии (N2,Cl2), сера образует сероводород (H2S). Теплоту сгорания относят к стандартным условиям. Обозначают ΔН0сгор.
Теплоту сгорания можно определить экспериментально с помощью калориметрической установки. При необходимости вносят поправки для того, чтобы тепловой эффект строго соответствовал указанным продуктам сгорания и стандартным условиям.
Существует ряд расчетных способов приближенной оценки теплот сгорания ВВ.
Способы отличаются «степенью приближения» или степенью учета энергетических вкладов функциональных групп, определенных типов связей в общий тепловой эффект сгорания. Одним из пригодных для инженерных расчетов является метод Караша.
В соответствии с этим методом сгорание вещества – есть процесс перемещения электронов от атомов углерода и водорода к атомам кислорода. Экспериментально установлено, что при образовании связи горючее – кислород выделяется 109,05 КДж тепла. Если учесть все уже имеющиеся связи и влияние различных заместителей, то теплота сгорания может быть определена по формуле:
Qр.сгор.ж.=109,05(4а+в-р)+ΣКiδi
где а, в – количество атомов углерода и водорода;
р– количество связей углерода и водорода с перемещенными электронами;
Кi - число однородных вкладов;
δi – вклад i-ного заместителя или связи.
Важнейшей характеристикой ВВ является теплота взрыва – количество тепла, которое выделяется при взрыве одного моля или единицы массы ВВ.
Теплота взрыва определяет работоспособность, скорость детонации, температуру взрыва, её знание необходимо при составлении уравнений взрывчатого превращения и т.д.
Теплота взрыва может быть вычислена на основании закона Гесса, но для этого необходимо определить теплоту образования ВВ и состав продуктов взрыва, а он значительно отличается от продуктов сгорания этого же вещества.
Если сравнить теплоты взрыва горения и сгорания в кислороде, то для большинства ВВ максимальное количество тепла выделяется при сгорании в кислороде, так как образуются высшие окислы. Наименьшее количество тепла выделяется при взрыве (при детонации). Во-первых, часто не хватает кислорода для образования высших окислов. Во-вторых, процесс очень быстрый и реакции не успевают пройти до конца.
Из сравнения скорости процессов горения и детонации нужно сделать вывод о том, что все расчеты процессов горения выполняют с учетом условия постоянства давления.
Расчеты процессов детонации выполняют при условии постоянства объема. Простейший пересчет можно выполнить по формуле:
QV=QP+(n2-n1)RT
n2, n1 - число молей газообразных исходных и конечных продуктов реакции.
Кислородный баланс, кислородный коэффициент
Конечные продукты взрыва, а значит и теплота взрыва, в значительной степени зависят от соотношения горючих элементов и кислорода во ВВ. Это соотношение оценивают кислородным балансом или кислородным коэффициентом.
Кислородный баланс – это избыток или недостаток кислорода в веществе по сравнению с количеством, необходимым для полного окисления содержащихся в нем углерода, водорода и других элементов, способных к окислению при взрыве (например, Al).
Кислородный баланс обычно выражают в процентах. Если ВВ имеет состав CaHbOcNd, то
КБ=![]()
16 – атомный вес кислорода
М – молекулярный вес ВВ
Кислородный баланс ВВ: гексоген = -21,6%; нитроглицерин =+3,5%; пироксилин =-28,5 %; октоген = -21,6 %; тетрил=-47,4%; ТЭН=-10,1%; тринитротолуол=-74,0%; нитрат аммония=+20%.
Кислородным коэффициентом называют содержание кислорода, выраженное в процентах от количества кислорода необходимого для окисления содержащихся в ВВ углерода и водорода.
А=![]()
Если кислородный баланс может быть положительным или отрицательным, то кислородный коэффициент всегда положителен.
Кислородный баланс удобно использовать для составления взрывчатых смесей. Наилучшие взрывчатые смеси имеют кислородный баланс близкий к нулю (например, аммонит содержит 21% тротила и 79% селитры)
Кислородный коэффициент используется в приближенных методах расчета теплоты взрыва и определении продуктов детонации. Исходя из КБ и А приближенно определяют продукты взрывчатого превращения. А это позволяет рассчитывать по закону Гесса теплоту взрыва.
Температуру взрыва определяют по формуле:
T=![]() .
.
где, Qвзр – теплота взрыва; Cν – теплоемкость продуктов взрыва
