
- •Книга выпущена при содействии оао "Газпром"
- •Скобло а.И., Молоканов ю.К., Владимиров а.И., Щелкунов вл-
- •Гэрячая струя
- •1 Потери II Нефть *н.О f отбензиненная
- •Глава I основные понятия
- •Глава II равновесные системы
- •Глава III испарение и конденсация
- •Глава IV ректификация
- •Глава V азеотропная и экстрактивная
- •Глава VI абсорбция и десорбция
- •Глава VII основные типы и расчет
- •Глава IX экстракция
- •Глава X сушка
- •Глава XII отстаивание
- •Глава XV электрическое осаждение
- •XlnR2/ я,dx
- •0,7(Лг£ iVin 106
- •Глава XVI разделение газовых
- •Глава XVII перемешивание жидкостей
- •Глава XVIII гидродинамика слоя
- •Глава XX классификация и дозирование
- •0 “ Ccpw
- •Расчет конвекционной поверхности
- •Нефтяного сырья
- •Глава XXIII основные закономерности
- •X, % (масс.)
- •Глава XXIV реакционные аппараты
- •Нагреватели 566 огневые 504
Глава I основные понятия
И ЗАКОНЫ МАССООБМЕНА
РОЛЬ МАССООБМЕННЫХ ПРОЦЕССОВ В НЕФТЕГАЗОПЕРЕРАБОТКЕ И НЕФТЕХИМИИ
Массообменные
или диффузионные процессы играют важную
роль при переработке нефти, различных
углеводородных и других смесей. Путем
ректификациииз нефти получают различные продукты:
бензин, керосин, дизельное топливо,
мазут, масляные фракции, узкие (по
температурам кипения) бензиновые
фракции. При ректификации сжиженных
газов выделяют этилен, этан, пропан,
бутан и другие компоненты. Путемперегонкив вакууме получают специальные масла.
Абсорбциюжидкими поглотителями иадсорбциютвердыми веществами используют для
извлечения из природных и попутных
газов, а также из газов нефтеперерабатывающих
заводов пропан-пропиленовой, бутан-бути-
леновой, бензиновой фракций, которые
служат сырьем для нефтехимической
промышленности.
Для
извлечения ароматических углеводородов
из бензиновых фракций при производстве
масел и очистке нефтепродуктов применяется
процесс экстракции.
Процесс
сушкинашел применение в производстве
катализаторов и адсорбентов.
Кристаллизацияиспользуется при депарафинизации масел,
производстве серы, парафинов и
церезинов, разделении ксилолов.
Даже такой неполный перечень использования массообменных процессов в нефтеперерабатывающей и нефтехимической промышленности свидетельствует об их широком распространении и важности решаемых с помощью этих процессов технологических задач.
ОБЩИЕ ПРИЗНАКИ МАССООБМЕННЫХ ПРОЦЕССОВ
Все массообменные процессы обладают рядом общих
признаков.
Они применяются для разделения смесей.
В любом процессе участвуют по крайней мере две фазы: жидкая и паровая (перегонка, ректификация), жидкая и газовая (абсорбция), твердая и парогазовая (адсорбция), твердая и жидкая (адсорбция, экстракция), две жидких (экстракция).
Переход вещества из одной фазы в другую осуществляется за счет диффузии.
Движущей силой массообменных процессов является разность концентраций (градиент концентраций) фактической в данной фазе
Gи равновесной с фактической в другой фазеL. Процесс протекает в направлении той фазы, в которой концентрация компонента меньше, чем это следует из условия равновесия (рис. 1-1).
а б в
G [ У > У, G | У<УРG У = УР
L— { —х<JtpI-— I-—х >ТР L— —х=хгр
Рис. 1-1. Схема переноса вещества между двумя фазами:
а— из фазыGв фазуL ; 6 —из фазыLв фазуG;в— равновесие фаз
Перенос вещества из одной фазы в другую происходит через границу раздела фаз.
Диффузионные процессы обратимы, т. е. направление процесса определяется законами фазового равновесия, фактическими концентрациями компонентов в обеих фазах и внешними условиями (температура, давление). Так, например, при повышении температуры и понижении давления поглощение газа жидкостью (абсорбция) может перейти в обратный процесс — в удаление газа из жидкости (десорбция).
Переход вещества из одной фазы в другую заканчивается при достижении динамического равновесия. При этом обмен молекулами через границу раздела фаз не прекращается, однако концентрации компонентов в обеих фазах остаются неизмененными и равными равновесным.
СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА ФАЗ
При изучении массообменных процессов приходится иметь дело не с отдельными компонентами, а с их смесями в различных фазах. Для характеристики состава такой смеси пользуются относительными содержаниями (концентрациями) тех или иных компонентов. Наиболее часто используют массовые, мольные и объемные концентрации, которые связаны между собой.
Поскольку
в процессах массообмена участвуют по
крайней мере две фазы, то относительное
содержание компонента с номером iв одной фазе
(например,
в жидкой) обозначим через х,,в другой фазе (например, в паровой) —
через у,.
Если
масса всей фазы равна д,а масса содержащихся в ней отдельных
компонентовд,(/ = 1, 2, л, гдеп
—число компонентов в смеси), то массовые
доли компонентов (массовые концентрации)
определяются следующим образом:
(и)

i=i
Очевидно,
что х,< 1 и
=i.
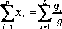
Аналогично для второй фазы можно записать
У,
£l
G

1=1
ХС,
Мольные
доли компонентов смеси х\определяются как отношение
числа
молей данного компонента N,
к общему числу молей смеси
N..
1=1

т.е.
Соответственно
х' < 1 и
=
1.

Аналогичные выражения можно записать и для компонентов у', второй фазы.
Массовые и мольные концентрации не зависят от температуры и давления, что выгодно отличает их от объемных концентраций.
Объемная доля и, представляет собой отношение объема данного компонента V, при заданном давлении к общему объему системы
п
V
=£
V, , т.е.
1=1
г);
_
V
1=1
Если выполняется правило аддитивности объемов при смешении, т.е. если при смешении объемы отдельных компонентов не изменяются, то
±v, =V,
(=1
и
в этом случае сумма объемных долей также
равна единице
= 1.

(1.2)
Для взаимного пересчета массовых и мольных долей используют соотношение между числом молей 7V, , массой д/и мольной массой М, произвольногоz-roкомпонента
И
Тогда уравнение взаимосвязи для мольных и массовых долей
9,
9i
x-
Ni _ Mi _ 9Mj
_ м,
9i
,=1 (=i M- (=i gMi (-1
т.е.
M
' _ 1*1
x,
1=1
M,
Аналогично
N. M
X.
_ 9i _
N,M,
N
±9i ±NiMi (M. tx’.M,
/=l /=1 i=x
tv (=l
т.е.
_
«;
Mi
(1.3)
1>; м,
i=1
Знаменатель выражения (1.3) представляет собой среднюю мольную массу смеси
МСР = Ё и.
(1.4)
7 =1
Среднюю мольную массу Мсрможно найти также и через массовые доли, преобразовав выражение (1.4):
м
ср
1

При
пересчете объемных концентраций в
массовые или мольные (например, при
пересчете кривых разгонок, построенных
в объемных долях) пользуются формулами
пересчета. Так, если в уравнении (1.1)
массу компонента д, записать через его
плотность р, и объем Vitто получим
х.
9i

/=1

Рем I 4
/ = 1
iff,
р,
ч р I
Рем
i
= i
т.е.
*, Рем = Ч Р, • (1-5)
Из уравнений (1.3) и (1.5) получаем соотношение
х'
М о=Моv.
i * iКем срК/
Среднюю плотность смеси рсмможно определить через объемные или массовые концентрации компонентов. Так, сложив левые и правые части уравнения (1.5), получим
л
Рсм р,
1=1
С другой стороны, воспользовавшись условием (1.2), из уравнения (1.5) получим
1
Рсм = •
На практике пользуются также объемной концентрацией с„ представляющей собой отношение массы /-го компонента д, к объему
п
смеси
V=^Vi
,т.е.
(=i
С:
El
v

(1.6)
Если просуммировать объемные концентрации с, всех компонентов, то получим массу смеси в единице ее объема, т.е, плотность смеси рсм:
Кроме
того, из выражений (1.5) и (1.6) получим
следующее соотношение

Рем

9i
С» = = = *,Pcm = 4P,
УРем
При расчетах массообменных процессов могут применяться и другие способы выражения состава смеси. Например, содержание компонентов могут определяться относительно одного из них или содержание компонентов на единицу массы (объема) растворителя и АР-
При абсорбции жирных газов, в процессах экстракции, когда происходит изменение составов и количества потоков по высоте аппарата, удобно пользоваться приведенными концентрациями X и Y, X’ иY', определяя составы контактирующих фаз по отношению к входящим потокам.
Если в процессе участвует вещество-носитель, количество которого не меняется, то состав фаз можно выразить в относительных концентрациях, т. е. в виде отношения массы или числа молей компонента (суммы компонентов) к массе или числу молей носителя. В отличие от концентраций хи у,х'и у', которые изменяются в пределах от 0 до 1, относительные концентрации могут изменяться в пределах от 0 до оо.
ОСНОВНЫЕ ЗАКОНЫ МАССООБМЕНА
Массообмен — диффузионный процесс переноса распределенного вещества из одной фазы в другую через разделяющую их границу или внутри одной фазы в неоднородном поле концентраций. Движущей силой служат градиенты концентраций, парциальных давлений, химических потенциалов или температур (при термодиффузии).
Различают два вида массообмена: односторонний (например, при абсорбции компоненты из газовой фазы переходят в жидкую) и двухсторонний (при ректификации).
Массообмен
осуществляется путем молекулярной,
турбулентнойиликонвективной
диффузии,из которых наиболее медленной является
первая. Перенос вещества внутри
неподвижной фазы осуществляется только
путем молекулярной диффузии. В движущейся
среде перенос вещества может происходить
как молекулярной диффузией, так и
конвективным переносом самой средой
в направлении ее движения.
Конвективный перенос вещества под действием турбулентных пульсаций называют турбулентной диффузией.
Молекулярная
диффузия обусловлена
переносом молекул вещества из области
с большей его концентрацией в область
с меньшей концентрацией и протекает
в неподвижной среде или ламинарных
пограничных слоях. Перенос вещества
при молекулярной диффузии определяется
законом Фика, который формулируется
следующим образом. Количество веществаdM,
диффундирующего через слой в единицу
времени, пропорционально площади
слояdF,перпендикулярной направлению
диффузионного потока, и градиенту
концентраций в направлении диффузииdc/dn,т.е.
( . \
dM=-D—dF.
{dn)
Знак минус указывает на то, что диффузия вещества идет в направ- лении уменьшения концентрации.
Движущей
силой процесса молекулярной диффузии
является градиент концентраций dc/dn,который в общем случае изменяется в
направлении переноса вещества. Средний
градиент концентраций в первом
приближении равен
Дс
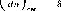
где Ас — изменение концентрации компонента по толщине слоя; 5 — толщина слоя.
Для заданной гидродинамической обстановки и конструкции контактного устройства, когда толщина пограничного слоя имеет вполне определенное значение, градиент концентрации можно считать пропорциональным изменению концентрации в пределах слоя.
Коэффициент
пропорциональности D,характеризующий скорость диффузии,
называюткоэффициентом
диффузии.
Он показывает, сколько вещества проходит
через единицу площади поверхности в
единицу времени при градиенте концентрации,
равном единице.
В СИ единица обозначения коэффициента диффузии — м2/с.
Коэффициент
диффузии представляет собой физическую
константу и характеризует природную
способность одного вещества проникать
в среду другого. Коэффициент диффузии
зависит от свойств диффундирующего
компонента и фазы, в которой он
диффундирует, а также температуры и
давления. Числовые значения Dопределяют экспериментально, они
приведены в справочной литературе.
Приближенно значения коэффициентов диффузии можно рассчитать по следующим уравнениям.
При диффузии газа Ав газеВ
где
Т— температура, К;Р— давление, МПа;VAиVB
—мольные объемы газовАиВ,
см3/моль;МАиМв— мольные массы газовА
и В,кг/моль.
При
диффузии газа Ав жидкостиВпри 20 °С коэффициент диффузии можно
рассчитать по формуле
где р — динамическая вязкость жидкости, мПа-с; А' и В'— поправочные коэффициенты для диффундирующего вещества и растворителя, которые учитывают отклонение свойств данного вещества от свойств неассоциированных веществ.
Для
температуры t
коэффициент
диффузии в жидкости определяется
уравнением
в котором коэффициент b определяется по формуле
где ц — динамическая вязкость жидкости при 20 °С, мПа-с; р — плотность жидкости, кг/м3.
Приведенные уравнения позволяют проанализировать влияние внешних факторов (давления и температуры) на диффузию. В частности, повышение температуры приводит к увеличению коэффициента диффузии как газов, так и жидкостей. Увеличение давления в системе уменьшает скорость диффузии в газах, а повышение вязкости жидкости снижает скорость диффузии газа в жидкости.
Следует отметить, что численные значения коэффициентов диффузии в газах примерно на четыре порядка больше, чем коэффициенты диффузии в жидкостях.
Турбулентная диффузия. Количество вещества, переносимого в пределах фазы турбулентной диффузией, по аналогии с молекулярной диффузией определяют по уравнению
dF,
где — коэффициент турбулентной диффузии.
Коэффициент
турбулентной диффузии имеет ту же
размерность, что и коэффициент молекулярной
диффузии D, т.е. м2/с,
однако в отличие отDон не является физической константой
и зависит от гидродинамических условий.
Конвективная
диффузия. Количество
вещества, переносимого в пределах
фазы вследствие конвективного переноса
вместе с самой средой в направлении ее
движения, пропорционально скорости
движения среды. Суммарный перенос
вещества в результате конвективного
переноса и молекулярной диффузии по
аналогии с теплообменом называютконвективным
массообменомиликонвективной
диффузией.
Распределение концентраций при переносе вещества путем молекулярной и конвективной диффузии определяется в самом общем виде дифференциальными уравнениями.
ДИФФЕРЕНЦИАЛЬНЫЕ УРАВНЕНИЯ МОЛЕКУЛЯРНОЙ И КОНВЕКТИВНОЙ ДИФФУЗИИ
Молекулярная
диффузия. Выделим
в среде параллелепипед с ребрами длинойdx,
dyиdzи рассмотрим потоки вещества в пределах
данного объема (рис. 1-2). Если объемная
концентрация на входе в выделенный
элемент равна с, то перенос вещества
будет происходить за счет наличия
градиента концентраций вдоль
соответствующих осей координат.
Рассмотрим,
например, перенос вещества в направлении
оси х.
Через
левую грань параллелепипеда площадью
dydzв единицу времени входит масса вещества
Мх, которая, согласно закону Фика,
равна
Мх= -D—dydz.
Эх
Одновременно
через правую грань уходит масса вещества
М
которая
определится следующим образом:
х + dx
b =
0,2\i
1/2
.1/3
Mx+dx =
с
+ — Эх dydz.
Эх
Рис. 1-2. Схема к выводу дифференциального уравнения молекулярной диффузии
Разность
приходной и расходной статей даст
приращение вещества за счет молекулярной
диффузии в направлении оси х
Э2с
dMx= Мж-M„dt=D—dxdydz.
Эх
Аналогично для диффузии вещества в направлении других осей получим выражения:
в направлении оси у
Э2с
dMy= Му - My+dy=D—dxdydz,
Эу
в направлении оси z
Э2с
dMz=Mz~Mz+d2 = D—dxdydz.
dz2
Общее приращение вещества в выделенном объеме будет равно
dM = dMr + dMv + dM, = D
{d2c
-.2
Э
c
-ч2 Л Э с
+
Эх
Эу
dz
dxdydz.
(1.7)
У
С другой стороны, это же накопление вещества в системе может быть выражено через изменение концентрации во времени
dM-—dxdydz. (1.8)
dz
Из сопоставления уравнений (1.7) и (1.8) получим уравнение молекулярной диффузии для нестационарного процесса:
(1.9)
|
Эс |
|
(-ч2 л2 Э С д С |
л 2 Л а с |
|
|
|
+ |
+ |
|
Эх |
|
удх Эу |
3z J |
Если процесс стационарный, т. е. концентрации во времени не изменяются, то уравнение (1.9) примет вид
Э2с Э2с Э2с
2+2+2=
Ъх1 Эу Ъг1
Конвективная
диффузия. В
общем случае перенос вещества
осуществляется путем как молекулярной,
так и конвективной диффузии при движении
вещества со скоростямиWx,
WyиW2по соответствующим осям координат (рис.
1-3).
В
этом случае поток вещества, например
Мхчерез левую грань вдоль осих,будет складываться из диффузионногоМ'хи конвективногоМ"х
потоков
X'
+ М

М
= М'
1
*x+dx
1
lx+dx
+ м
//
x+dx
'
Приращение
массы вещества в объеме элементарного
параллелепипеда в направлении оси хсоставитdMx
=МХ
-Mx+dx
=dM'x
+dM;
.
Приращение
массы вещества dM‘xза счет молекулярной диффузии определяется
уравнением (1.7). Для определения приращения
массы вещества за счет конвективной
диффузииdM"xнайдем массу вещества, проходящую в
единицу времени через левую грань
параллелепипеда площадьюdyd2:
Мх=cWxdydz.
На противоположной (правой) грани параллелепипеда объемная концентрация и скорость будут отличаться от соответствующих величин на
левой грани и будут равны
|
|
|
|
|
aw.
|
|
|
|
И |
wx
|
|
|
V |
дх j |
|
|
|
Тогда через
правую грань параллелепипеда выйдет масса жидкости
Рис.
1-3. Схема к выводу дифференциального
уравнения конвективной диффузии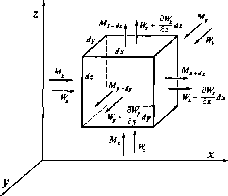
лГ
aw
л
w.
+—*-dx
м
x+dx
эС
с
+ — dx
Эх
\
Эх
dydz.
aw„ awv aw.
Эх
Эу
Эх
= о,
получим
M„d* =M'+d* +M?+d, = -~ Wx dxdydz.
Эх
Эс
Эс ^ Wr
+
— Wv
+
— W_
Эх
* Эу у
Эх * ,
э2с э2с а2с^
D
+
Эх2 Эу
Эг
dxdydz.
—
wx
+
— wv
+—
W,
Эх
х
Эу у
Эх *
— = а
Эт
Э с Э с Э с
Эх2 Эу2 Эх2
У
(
Эс
Эс
Эс
Л
(1.10)
Приведенные выше уравнения в общем виде не интегрируются, однако они могут быть использованы для получения так называемых критериев
подобия методами подобных преобразований.
При практических расчетах применяют закон конвективной диффузии в следующем
виде
dM =РдЛ-rpCi/7= Рд(с -cTp)dF, (1.11)
где Рл— коэффициент массоотдачи; = с — с^ — движущая сила между ядром потока и границей раздела фаз; с и сф— концентрации соответственно в ядре потока и на границе раздела фаз.
Уравнение (1.11) отражает факт переноса массы из ядра потока к границе раздела фаз (с > с ) или от границы в ядро потока (с < сгр).
Коэффициент массоотдачи рдпредставляет собой массу вещества, прошедшую через единицу поверхности в единицу времени при разности концентраций в ядре потока и на границе раздела фаз, равной единице.
Коэффициент массоотдачи характеризует скорость переноса массы в пределах одной фазы; его величина зависит от гидродинамических и физико-химических факторов, а также типа и размеров аппарата.
При переносе вещества в пределах одной фазы движущей силой является разность концентраций с — сгрв ядре потока и на границе раздела фаз.
Для расчета коэффициента массоотдачи /?добычно используют уравнения вида
NuA=ARemPi£, (1.12)
В . J W1 Win
критерии
где Nu. = —— — диффузионный критерий Нуссельта;Re=
А D v \i
Рейнольдса; Ргд= = — — диффузионный критерий Прандтля;1— характерный линейный
р D D
размер, м; р — плотность потока, кг/м3;v— кинематическая вязкость потока, м2/с; р — динамическая вязкость потока, н с/м2.
Величины коэффициента Аи показателей степени тип определяют в результате обработки экспериментальных данных.
ОСНОВНОЕ УРАВНЕНИЕ МАССОПЕРЕДАЧИ
Для расчета размеров аппарата, в котором должен осуществляться данный процесс массопередачи, необходимо знать скорость этого процесса.
Скорость
процесса массопередачиравна массе вещества, переданного через
единицу поверхности в единицу времени,
т. е.dM/dF.
С
другой стороны, скорость массообменного
процесса пропорциональна движущей
силе процесса А и обратно пропорциональна
сопротивлению массопереноса R.
Следовательно, можно записать, что
Ё± = ± = КА
dF R ИЛИ
dM = KAdF. (1.13)
Величина
Кназываетсякоэффициентом
массопередачи,он характеризует массу вещества,
переданную из фазы в фазу через единицу
поверхности в единицу времени при
движущей силе, равной единице.
Коэффициент
массопередачи отражает уровень
интенсификации процесса: чем больше
величина К,тем меньших размеров требуется аппарат
для передачи заданного количества
вещества. Наибольшее влияние на
интенсивность массопереноса оказывают
гидродинамические и конструктивные
факторы, определяющие интенсивность и
характер взаимодействия контактирующих
фаз.
Поскольку
обычно движущая сила изменяется в ходе
процесса массопередачи, пользуются
усредненными величинами КАи Дср. Тогда уравнение (1.13) в
интегральной форме запишется в следующем
виде
M = KaacpF. (1.14)
Движущая сила А или Дсрможет быть выражена в любых единицах концентраций, о которых речь шла выше, однако независимо от этого, А = с — ср, где с — рабочая (фактическая) концентрация компонента в ядре потока соответствующей фазы, ср— концентрация компонента для данной фазы, равновесная с фактической концентрацией в другой фазе.
Из
сопоставления уравнений (1.11) и (1.13) видно,
что коэффициенты массоотдачи рди массопередачиКАимеют одинаковую размерность. В
зависимости от способа выражения
движущей силы процесса массо- обмена
будут изменяться как единицы измерения
рди Кд, так и уравнения для
их расчета.
Движущая сила процесса массообмена может быть выражена разностью концентраций в той или другой фазе. Поэтому уравнение массопередачи (1.14) можно записать в виде
М= “,(У-У, =
Очевидно,
что
(1.15)
*р
-*
У-у,
СР _ ^Уср
Ах,
ср
ср
определяет средний тангенс угла наклона линии равновесия в рассматриваемом диапазоне изменения концентраций, т.е. коэффициенты массопереда-
чи
КиКхвзаимосвязаны через соответствующие
движущие силы.
Когда действительная поверхность контакта фаз не определена, в качестве расчетного параметра используют условную поверхность контакта (например, площадь поперечного сечения аппарата) или рабочий объем аппарата. В этом случае получают условные величины коэффициентов массопередачи, которые, как правило, могут быть использованы при расчетах аппаратуры только определенного типа.
Если в качестве рабочей характеристики использовать рабочий объем аппарата V,то уравнение (I. 14) запишется в следующем виде:
м
= k4acpf
=
(kjv)дсрг =KVACPV,
где fv— поверхность контакта фаз в единице рабочего объема аппарата, м2/м3;Kv — коэффициент массопередачи, отнесенный к единице рабочего объема аппарата.
Для тарельчатого массообменного аппарата коэффициент массопередачи может быть отнесен к контактной площади тарелки
М
= КдДсрР =(kjf
)acpsna
=
kfacpsnx.
где fF— поверхность контакта фаз, приходящаяся на единицу контактной площади тарелки,mVm2; Kf— коэффициент массопередачи, отнесенный к единице контактной площади тарелки; 5 — контактная площадь тарелки, м2;NA— число тарелок в колонне.
Уравнение массопередачи (1.14) и его разновидности обычно используются для нахождения поверхности контакта фаз, рабочего объема аппарата или числа тарелок в колонне при найденных по соответствующим уравнениям коэффициенте массопередачи и средней движущей силе процесса.
ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА МАССОПЕРЕДАЧИ ЧЕРЕЗ КОЭФФИЦИЕНТЫ МАССООТДАЧИ
Схема переноса вещества между фазами представлена на
рис. 1-4.
Пусть
в фазе Gконцентрация рассматриваемого компонента
больше концентрации того же компонента
в фазе I, т. е. компонент переходит из
фазыGв фазуL.
Рис. 1-4. Схема к определению коэффициента массопередачи через коэффициенты массоотдачи
Перенос
вещества к границе раздела фаз
осуществляется как путем молекулярной
диффузии,т. е. движения молекул вещества через
слой данной фазы, так и путемконвективной
диффузии,т.е. за счет движения частиц данной фазы.
dF

В
каждой фазе различают ядро потока, в
котором перенос вещества осуществляется
преимущественно за счет конвективной
диффузии, и пограничные слои толщиной
8Си8ив которых массоперенос происходит в
основном за счет молекулярной диффузии
(роль которой возрастает при затухании
вихрей по мере приближения к границе
раздела фаз). Толщина пограничных слоев
в первую очередь зависит от скоростей
движения взаимодействующих фаз, т. е.
от гидродинамического режима в каждой
фазе. Поскольку в пограничном слое
перенос вещества происходит медленнее,
чем в ядре потока, то считают, что основное
сопротивление переходу вещества из
одной фазы в другую сосредоточено в
пограничном слое.
В ядре потока частицы вещества перемешиваются интенсивно, что приводит к усреднению всех характеристик процесса. Поэтому принимают, что в ядре потока концентрации не меняются, а все изменение концентраций компонентов в каждой из фаз имеет место в пределах пограничного слоя.
На
границе раздела фаз предполагается
равновесие между фазами, определяющее
граничные концентрации угрсо
стороны фазыGи хгрсо стороны фазыL.
Перенос
массы dMвещества из фазыGк границе раздела фаз в единицу времени
определяется по уравнению конвективной
диффузии
(Мб)
Соответственно то же количество вещества передается от границы раздела фаз в фазу L, т.е.
dM=P,(Xcp-X)dF. (1.17)
*
Кроме того, согласно основному уравнению массопередачи, можем записать, что
dM = Ку(у -yp)dF. (1.18)
Состояние равновесия, в том числе и на границе раздела фаз, описывается уравнением
ур=Арх-Вр.(1.19)
В
общем случае АриВрмогут быть некоторыми функциями
концентраций. При Вр= 0 коэффициент
Аротождествляется с константой
фазового равновесия.
Из уравнений (1.16) — (1-18) выразим разности концентраций через остальные переменные
(1.20)
|
XT' IT — |
dM |
|
У Угр |
P ydP |
|
*rp - * = |
dM |
|
P *dF | |
|
|
dM |
|
У Ур - |
KydF |
Приняв во внимание уравнение равновесия (1.19), второе уравнение системы (1.20) запишем в виде
Угр
-Ур
ApdM
MF
(1.21)
Сложив левые и правые части первого уравнения системы (1.20) и уравнения (1.21), получим
У-Ур
dM
dF

(
1
—-
+

(1.22)
Сопоставив между собой третье уравнение системы (1.20) и уравнение (1.22), приходим к следующему соотношению
= _L+ip.(1.23)
курур,
Это уравнение и отражает закон аддитивности фазовых сопротивлений массопереносу. Общее сопротивление массопередаче равно сумме диффузионных сопротивлений со стороны контактирующих фаз.
Если основное уравнение массопередачи записать в виде
dM=Кх(хр-xjdF,
то путем аналогичных преобразований получим выражение
1_ 11
(1.24)
кхр,лрзу'
Это вторая форма закона аддитивности фазовых сопротивлений мас- сопереносу.
Из
уравнений (1.23) и (1.24) следует, что кж
=
Арку.(1.25)
В отличие от уравнения (1.15), описывающего зависимость между средними величинами коэффициентов массопередачи, уравнение (1.25) справедливо для локального участка процесса.
Уравнения
(1.23) и (1.24) позволяют определить величины
коэффициентов массопередачи КуиКх,
располагая коэффициентами массоотдачи
Руи р*. При этом коэффициенты Руи Р, можно определять экспериментально
для опытных систем, моделирующих
сопротивление массопереносу
преимущественно только в одной фазе.
Если
равновесная зависимость криволинейна,
то для нахождения коэффициентов
массопередачи КуиКхпо двум коэффициентам массоотдачи
процесс массопередачи разбивают на
отдельные участки, в пределах каждого
из которыхАрсчитают величиной постоянной. В этом
случае коэффициент массопередачи будет
изменяться по длине аппарата (зависеть
от концентраций).
Если сопротивление массопереносу сосредоточено в одной из фаз (один коэффициент массоотдачи значительно меньше другого), то величина коэффициента массопередачи процесса может быть приравнена к меньшему коэффициенту массоотдачи.
Коэффициенты массоотдачи зависят от многих факторов, определяющих скорость молекулярной и конвективной диффузии, т.е. скоростей фаз и их физико-химических свойств. Теоретически показано и экспериментально установлено, что
ft р^(0,50-0,56).

МАТЕРИАЛЬНЫЙ БАЛАНС МАССООБМЕННОГО ПРОЦЕССА
Взаимодействие фаз в пределах всего аппарата или его отдельных участков (контактных устройств) может осуществляться по трем основным схемам: в противотоке, прямотоке или в перекрестном токе. От схемы движения потоков зависят пределы изменения концентраций в аппарате.
Противоточный
контакт фаз. Пусть
через массообменный аппарат движутся
потоки двух фаз (рис. 1-5). Секундный расход
одной фазы (например, газа или пара),
движущейся снизу вверх, составляетG,а другой фазы (например, жидкости),
движущейся сверху вниз,—
L.Концентрации компонентов в контактирующих
фазах обозначим соответственно через
у
и
х.В результате массообмена концентрации
рассматриваемого компонента изменятся
в одной фазе от ундо ук, а
в другой — отхндо хк, В первом приближении будем
считать, что потокиСиLне изменяются по высоте аппарата.
б
Рис. 1-5. Схема к расчету потоков и концентраций в противоточном массообменном аппарате:
а — схема потоков; (> — изменение концентраций вдоль поверхности контакта фаз

Общий материальный баланс по данному компоненту для всего аппарата запишется так:
Су„ + *•*„ = GyK+LXK.
Следовательно,
количество переданной массы Мможно выразить следующим образом
М=G(y„-у„)=
фж
-*„)■
Отсюда соотношение между потоками контактирующих фаз равно
Ун “Ук

(1.26)
- X.
При
заданных концентрациях это выражение
может быть использовано для определения
величины 1,
а при заданной величинеI
—для расчета одной из конечных концентраций
укилихк.
Для
определения составов внутренних потоков
в произвольном сечении аппарата 1—1составим уравнение материального
баланса, например, для части аппарата,
расположенной ниже сечения1—1.Отбросив бесконечно малые первого
порядка, получим
Gy+LxK=GyH+Lx.
Записав это уравнение в несколько ином виде, получим так называемое уравнение рабочей линии
У =
L
— х
+ G(
Ун
\


(1.27)
Уравнение рабочей линии дает зависимость между рабочими (неравновесными) составами фаз в произвольном сечении аппарата. Оно позволяет выявить изменение концентраций компонента по высоте аппарата.
В
координатах х—ууравнение рабочей линии является
уравнением прямой с тангенсом утла ее
наклона к оси абсцисс равным1(рис. 1-6)
=— =const.
G
При
х
— хн
и у = укуравнение рабочей линии приводится к
уравнению (1.26).
На
диаграмме х—урабочая линия в зависимости от направления
переноса данного компонента из фазыGв фазуLили наоборот может располагаться как
ниже, так и выше равновесной кривой. На
рис. 1-7 даны взаимные положения равновесной
и рабочей линий, соответствующие разным
случаям переноса компонента между
фазами.
Значение движущей силы процесса определяется как разность концентраций Дув отдельных участках массообменного аппарата: она равна при массопередаче из фазы Gв фазу I {см. рис. 1-7, а) А у = у — у , а при массопередаче из фазыLв фазуG А у =у — у (см. рис. 1-7,б).
Движущая сила процесса может измеряться также разностью концентраций в фазе L А х = хр—хпри переходе вещества из фазыGв фазуL(см. рис. 1-7,а)и Ах=х—хрпри массопередаче из фазыLв фазуG(см. рис. 1-7, б).
Из графиков видно, что величины движущей силы по фазам GиLдля разных сечений аппарата будут изменяться, поэтому для аппарата в целом необходимо определять среднюю движущую силу массообменного процесса Аусри Ахср.
В общем случае значения А у и А хне равны между собой и поэтому коэффициенты массопередачиКупо фазеGиК хпо фазеL.будут иметь неодинаковые значения.
Движущая сила процесса изменяется по его ходу. Она тем меньше, чем ближе расположены друг к другу рабочая и равновесная линии. Пересечение или касание их означает, что диффузионный процесс не может идти в заданных пределах.
Рис.
1-6. График уравнения рабочей линии для
противоточного процесса
б
за

Рис. 1-7. Взаимные положения рабочей (J) и равновесной (2) линий при разных направлениях переноса вещества:
а — из фазы G в фазу L; б — из фазы L в фазу G

Для
характеристики потоков и концентраций
в локальном объеме аппарата выделим в
нем элементарный объем между сечениями
1—1и2—2
(см.
рис. 1-5) и составим для него материальный
покомпонентный баланс

откуда
-Gdy+Ldx= 0.
(1.28)
Проинтегрировав уравнение (1.28) в пределах от начальных до конечных концентраций получим для всего аппарата уравнение (1.26), а для части аппарата — уравнение рабочей линии (1.27).
Необходимо отметить, что при противотоке может быть обеспечена большая разность концентраций уки хкв потоках, покидающих аппарат. В этом состоит одно из преимуществ противоточного контактирования фаз.
Прямоточный контакт фаз. Схема прямоточного движения фаз и график изменения концентраций вдоль поверхности контакта приведены на рис. 1-8.
В случае прямотока общий материальный баланс для аппарата записывается, как и для противотока, в виде уравнения (1.26). Соответственно материальный баланс для локального объема аппарата будет представлен уравнением (1.28).
Уравнение
рабочей линии может быть получено при
рассмотрении материальных потоков для
части аппарата ниже сечения 1—1
Су и + =Gy+Lx.
Отсюда получим уравнение рабочей линии для прямотока:
У
= -

Таким образом, при прямотоке в отличие от противотока тангенс угла наклона рабочей линии отрицателен. График рабочей линии прямоточного процесса представлен на рис. 1-9.
Отличительной особенностью прямоточного процесса является также то обстоятельство, что в предельном случае выходные концентрации фаз ук и хкстремятся к равновесию. Поэтому, как правило, разность концентраций компонента в фазах на выходе из аппарата незначительна.
а
б

Рис. 1-8. Схема к расчету потоков и концентраций в прямоточном массообменном аппарате:
а — схема потоков; б — изменение концентраций вдоль поверхности контакта фаз
В этой связи прямоток обычно создают в пределах отдельного контактного устройства, тогда как в целом в аппарате реализуется противоток. Это достигается соответствующей схемой соединения потоков фаз смежных контактных устройств.
Перекрестный ток. Схема потоков и график изменения концентраций при перекрестном способе контактирования фаз приведены на рис. 1-10.
Общий материальный баланс для случая перекрестного тока представляется уравнением (1.26).
Если
ввести относительную координату £ (% =
h
/
Н,
1 > £ > 0, гдеН
—общая длина контактной зоны), то для
произвольного сечения1—1
можно
составить следующий покомпонентный
материальный баланс, подразумевая
подусреднюю концентрацию на выходе из
рассматриваемого участка контактной
зоны:
= Ьс + GEy.
Отсюда получим уравнение рабочей линии для случая перекрестного
тока
(1.29)
|
1 |
f |
/ ^ |
|
-X + |
Ун |
+ ГХн |
|
|
|
1 ) |

-Рк
-Л £_
Рис. 1-0. График уравнения рабочей линии для прямоточного процесса
Рис. I-10. Схема к расчету потоков и концентраций в массообмеином аппарате перекрестного тока:
а— схема потоков;6— изменение
концентраций вдоль поверхности контакта фаз
а
\с,
\с$,у
TnTf\dGy
L,
.и
и t m м

л
и

Хк
*В(хи,ун). Разбив контактную зону на
несколько участков, можно получить
изменение концентраций вдоль контактной
зоны.
Рис. 1-11. График уравнения рабочих линий для процесса с перекрестным током фаз
у
В j>
АлА. А
г
X

х
Н
I
\
На рис. 1-11 дано графическое представление рабочих линий при перекрестном токе.
При
£ = 1 и х
= хк,
у =укуравнение (1.29) сводится к
уравнению общего материального баланса
(1.26).
Поскольку при перекрестном токе изменение концентраций в пределах контактной зоны определяется совокупностью рабочих линий, условия равновесия на выходе из аппарата уже не оказывают столь сильного влияния на величины концентраций хки ук. Поэтому при перекрестном токе в пределах контактной зоны обеспечивается большее изменение концентраций, чем при прямотоке. В этом отношении перекрестный ток занимает промежуточное положение между прямотоком и противотоком, приближаясь к противотоку. Обычно в аппарате устанавливают ряд контактных устройств, работающих по схеме перекрестного тока и соединенных последовательно по потокам фаз. При этом по аппарату в целом осуществляется противоток.
Для
бесконечно малого участка аппарата
между сечениями 1—1и2—2
(см.
рис. 1-10) материальный баланс будет
выглядеть следующим образом:
Lx+dGyH=L(x+dx) +dGy
или
(Ун-y)dG
= Ldx.
Проинтегрировав это уравнение в пределах от £ = 0 до заданного значения £, получим уравнение (1.29) рабочей линии, а в пределах от £ = 0 до £ = 1 — уравнение (1.26) общего материального баланса.
СРЕДНЯЯ ДВИЖУЩАЯ СИЛА ДИФФУЗИОННОГО ПРОЦЕССА И ЧИСЛО ЕДИНИЦ ПЕРЕНОСА
Как следует из основного уравнения массопередачи (1.14), средняя движущая сила процесса определяет количество переданной массы вещества. Поскольку рабочие и равновесные концентрации изменяются вдоль поверхности контакта фаз, необходимо рассчитывать среднюю движущую силу процесса.
Поверхность
фазового контакта Fопределяется из уравнения (1.14) следующим
образом:
м м
F= илиF= . (1.30)
КуДУср КхАхср
Для
вычисления, например, А усрнапишем
дифференциальные уравнения материального
баланса фазыGи массопередачи
dM= -Gdy
и
dM
=Ky(y-yp)dF,
откуда
dF=-C_J«y-.
КуУ-Ур
С другой стороны,
м=с(ун-ук),(1.31) т.е.
М dy
ку(у„-Ук)у-Ур
Интегрируя последнее выражение в пределах изменения концентраций в аппарате, получим
F=—r^Л (1.32)
КуУн-Ук ГУ-Ур
V J У YL
Сравнив это выражение с уравнением (1.30), запишем
А У
ср
_ Ун-Ук
(1.33)
Ун
/
У к
dy
У-Ур
Написав
дифференциальное уравнение материального
баланса и уравнение массопередачи
для фазы Lи проинтегрировав его, получим
к
dF=
X
dx
хр-х

Сопоставив найденное уравнение с уравнением (1.30), имеем
. хк - х„
Ахср=— *
При
практическом использовании полученных
равенств интегралы этих выражений могут
быть найдены численным или графическим
интегрированием. На рис. 1-12 приведен
пример графического интегрирования.
Для ряда значений у находят соответствующие
им величины х,ур,у— ури 1/(у _ур)(
затем
в координатах у, 1/(у — ур) строят
кривую. Площадь5у
между
ординатами уки уни полученной
кривой в соответствующем масштабе
и определяет искомый интеграл.
Интегралы
У-Ур
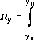
Ун - Ук
Ду ср
(1.34)
и
*к
dx
хк
- хи
хр
-X &хср
хн
имеют
и определенный физический смысл. В
подынтегральной дроби числитель выражает
изменение концентрации в фазе СилиLв результате массообмена фаз на
поверхностиdF,
а знаменатель — движущую силу на этой
поверхности.
Дробь
в целом представляет собой изменение
концентраций в
пределах
контактной зоны, приходящееся на единицу
движущей силы, и называется числом
единиц переноса(ЧЕП). В некоторых случаях удобнее
вести расчет массообменного аппарата, используя единицы переноса.
Для
насадочных аппаратов поверхность
массообмена можно выразить как
произведение рабочего объема аппарата
на поверхность контакта фаз в единице
его объема fv, тогда уравнение (1.31) можно записать в
виде
откуда с учетом уравнений (1.31) и (1.34) получим
Н =
KyfvS
?
dy Сд У-У р Kyfv
■Л
У '
(1-35)
где НиS— соответственно высота и сечение аппарата;G— расход фазы ’G"(Kr/c);GA= — — массовая скорость фазы "G" (кг/м^-с).
Так как в левой части уравнения (1.35) используется величина высоты аппарата, а в правой — произведение безразмерного числа единиц переноса и соотношения GJK^V,то последнее должно выражать высоту, эквивалентную одной единице переносаН.1у1которую определяют экспериментально. Окончательно расчетное уравнение имеет вид
М—М Эулу.
Аналогично можно получить уравнение для расчета высоты аппарата, если расчет вести по другой фазе L:
Н Н эх л х .
Сечение и диаметр аппарата необходимо определять при том же значении массовых скоростей, при которых были получены значения ИиН.)Х.
Если равновесная и рабочая линии являются прямыми, то могут
быть получены более простые соотношения для вычисления средних
движущих сил и числа единиц переноса.
Пусть уравнение рабочей линии будет представлено в виде у = Ах + В,
а уравнение равновесия в виде ур= Арх + йр.
Найдем разность рабочей и равновесной концентраций У - Ур = [a-Apjx+(в“ ВР)
и проинтегрируем это выражение, приняв во внимание, что dy=Adx.
о--*).
х + -
в-а
в-
ЛУ
=
Ун
J
dy
А-А
р у
хн +
In
А-А
£_
-
А ,
ш
Ук
У-Ур А-Ар
х +
B-Bf
А-А,
А - А,
хк +
В- Вг
к
А- А,
А - А.
y-yt

С другой стороны,
У и У к [ Дун ДУк г
Д - Ар ^ 7
Применяя уравнение (1.33), получим
ЛУср
ДУн
- ЛУк
In
ДУн
Ду.
III
~
Д*к
Д*Н
А*нД*к
Ах
ср
Таким образом, если равновесная и рабочая линии являются прямыми, то средняя движущая сила процесса рассчитывается как средняя логарифмическая движущих сил в начале и его конце.
ЧИСЛО ТЕОРЕТИЧЕСКИХ ТАРЕЛОК
При
расчетах массообменных аппаратов
широко используется понятие о
теоретической
тарелке (теоретической ступени контакта),под которой понимают такое контактное
устройство, которое обеспечивает
получение равновесных потоков фаз,
покидающих контактную зону.
На рис. 1-13 дана схема потоков для теоретической тарелки.
Потоки
СиLконтактирующих фаз входят в контактную
зону, имея начальные концентрации
компонента уни хн, В
результате процесса массообмена
концентрации компонента в потоках
изменяются и станут равными уки хк. Для теоретической тарелки
эти концентрации будут равновесными,
т.е.
У к = Ур.к = фк) ■
Концентрации
унихкили уки хнсоответствующих
встречных потоков удовлетворяют
уравнению рабочей линии.
Поскольку для достижения равновесия требуется определенное время контакта фаз, то в реальных условиях такое состояние не всегда может быть обеспечено. Это требует внесения корректив в расчеты, выполненные с использованием представления о теоретической тарелке.
В целом ряде случаев использование этого понятия позволяет ис-
Рис. ЫЗ. Схема потоков для теоретической тарелки
б
°>У*-Ур-/(**) L>*H


Рис. 1-14. Графическое определение числа теоретических тарелок:
а — схема потоков; 6 — расчетный график; 1—3 — номера теоретических тарелок; АВ — рабочая линия

следовать основные закономерности процесса и получать важные практические результаты при расчете массообменной аппаратуры.
Достоинством методов расчета, основанных на использовании понятия о теоретической тарелке, является то обстоятельство, что для их реализации необходимо располагать лишь уравнениями равновесия и рабочей линии, в отдельных случаях привлекая лишь уравнения тепловых балансов.
Чтобы получить желаемое изменение концентраций потоков в аппарате, в нем необходимо иметь определенное число теоретических тарелок.
Рассмотрим
графический расчет числа теоретических
тарелок (ЧТТ) на примере противоточного
аппарата (рис. 1-14) при переходе компонента
из фазы Gв фазуL(у > ур).
На
первой тарелке поток Gс начальной концентрацией компонента(Ун)
контактирует
с потокомL,стекающим с вышележащей тарелки и
имеющим концентрацию компонента (х2).
В
результате взаимодействия указанных
потоков их концентрации изменятся и
получат значения ухих{= хк. Согласно определению
теоретической тарелки концентрацииухи х^^ находятся в равновесии, а концентрации
уни х^х* должны удовлетворять
уравнению рабочей линии.
Это определяет следующий характер процедуры построения числа теоретических тарелок.
Точка
В
скоординатами унихх=хкнаходится на рабочей линии и определяет
составы потоковGна входе в аппарат и I на выходе из
аппарата. ТочкаDс абсциссойxt=xK,
находящаяся на равновесной кривой, дает
состав парауиуходящего с первой тарелки. Этот состав
пара у, и состав стекающей со второй
тарелки жидкостих2должны удовлетворять уравнению рабочей
линии. Проведя горизонталь через точкуDдо пересечения с рабочей линией, получим
точкуЕ,абсцисса которой равнах2.
Поток
Gс концентрациейухпоступает на вторую тарелку, где вступает
в контакт с потокомL,имеющим концентрацию х3. В результате
получаются потоки фаз соответственно
с концентрациями у2их2,
находящимися
в равновесии. Проведя рассуждения,
аналогичные тем, которые использовались
при построении первой теоретической
тарелки, можем определить концентрации
потоков для второй теоретической
тарелки, начав построение с точкиЕ.
Подобные
построения проводятся до тех пор, пока
последняя горизонтальная прямая не
пройдет через точку Ас координатами уки хн. При
этом получается ломаная линия, состоящую
из горизонтальных и вертикальных
участков, которая вписана между рабочей
и равновесной линиями. Нетрудно видеть,
что число горизонтальных или вертикальных
отрезков ломаной линии равно числу
теоретических тарелокNT,
необходимых для заданного изменения
концентраций контактирующих фаз. В
данном случаеNT= 3.
Число
теоретических тарелок зависит от
взаимного расположения рабочей и
равновесной линий, т. е. от величины
движущей силы процесса. При взаимном
сближении рабочей и равновесной линии
средняя движущая сила процесса
уменьшается, а число теоретических
тарелок увеличивается. При увеличении
расстояния между рабочей и равновесной
линиями средняя движущая сила процесса
возрастает, что приводит к уменьшению
числа теоретических тарелок. Найденное
число теоретических тарелок используется
для определения высоты контактной зоны
аппарата Нили числа реальных тарелокNA.
В первом случае используют высоту
контактной зоны Нэ, эквивалентную
одной теоретической тарелке (ВЭТТ),
тогда
H = H3NT.
Во втором случае определяют число реальных тарелок NA, используя понятие КПД тарелки т/т:
N=^~
J>A'
Пт
а
высоту контактной зоны тарельчатого
аппарата рассчитывают, зная число
реальных тарелок NAи расстояние между ними Нт:
H = H.N..
~ А
Величины
Нэиц,определяют экспериментально или
рассчитывают по эмпирическим уравнениям.
Для
расчета массообменных аппаратов
используют также понятие эффективности
тарелки по парам Е
Gи по жидкостиЕ
L.В отличие от КПД тарелки7jT,
величина
которой всегда меньше единицы, значение
эффективности определяется схемой
движения потоков на тарелке и может
быть как меньше, так и больше единицы.
ПОДОБИЕ В ПРОЦЕССАХ МАССООБМЕНА
Полученные ранее дифференциальные уравнения молекулярной и конвективной диффузии не решаются аналитически в общем виде. Однако они могут быть использованы для получения безразмерных критериев подобия, применение которых при обработке экспериментальных данных по массообмену позволяет получать достаточно простые расчетные уравнения. Применение критериев подобия указывает более рациональные пути постановки эксперимента (какие величины следует измерять в опытах, в каком виде обрабатывать опытные данные и в каких пределах справедливы полученные экспериментальные зависимости).
Критерии подобия могут быть получены, например, при приведении дифференциального уравнения к безразмерному виду. При этом следует руководствоваться правилом, в соответствии с которым размерность дифференциала л-roпорядка совпадает с размерностью самой переменной, а произведение л дифференциалов первого порядка имеет размерность переменной в п-й степени, т.е.
(1.36)
|
- |
|
|
|
|
|
dnx |
= |
X |
i |
|
|
dxn |
|
И |
► | |
|
|
|
|
|
|
Рассмотрим, например, перенос вещества из ядра потока к границе раздела фаз. Тогда, согласно закону Фика, к границе раздела фаз за счет диффузии поступит следующее количество вещества в единицу времени
f del
dAf = -D — dF.
IdnJ
Toже количество вещества будет передано к границе раздела фаз, согласно закону конвективной диффузии
dM = РД cdF.
Приравняв левые и правые части двух последних уравнений, получим dF= РДс.
Jdc4 -D —
\dn;
Разделив правую часть уравнения на левую и приняв во внимание соотношения (1.36), получим диффузионный критерий Нуссельта
Nua
Е
D '
где I— характерный линейный размер.
Критерий Нуссельта содержит искомую величину — коэффициент массоотдачи р.
Для получения других критериев воспользуемся уравнением (МО) молекулярной и конвективной диффузии.
Разделив все члены уравнения на dc/dtс учетом правила (1.36), получим диффузионный критерий Фурье
который характеризует нестационарные диффузионные процессы.
Деление слагаемого, например, {д с/д x)WxнаD(д 2с/д2х) приводит к диффузионному критерию Пекле
W7
Ре
А
D
Критерий Пекле можно представить также в виде произведения двух критериев: критерия Рейнольдса Re, характеризующего гидродинамическое подобие потоков в массообменных аппаратах, и диффузионного критерия ПрандтляРгд=у/Дхарактеризующего влияние сил вязкости
Ре г л
VV7
D
т
V
— =
RePr, D _ ;Гидродинамическое подобие в системах, где основное влияние оказывает сила тяжести, характеризуется критерием Фруда
gi
Для потоков ламинарных и переходных перенос массы определяется критерием Архимеда, аналогичным критерию Грасгофа в теплопередаче:
Дг= j3gАРj3P2gАР
v2Р ц2Р
где р — плотность рассматриваемой массы вещества до массообмена; Ар — изменение плотности, вызванное массообменом (изменением концентраций).
Критериальное уравнение массопереноса можно представить в следующем виде:
Nua = / Re, Fr, Аг, Ргд , FoA
Для установившегося процесса критерий Фурье исключается. В случае вынужденного движения (влияние объемных сил несущественно) критерии Фруда и Архимеда можно исключить.
В итоге формулу для расчета величины коэффициента массоотдачи ftобычно записывают в виде уравнения (1.12)
Nua =ARemPrA.
Если в результате обработки данных экспериментов найдены величины коэффициента Аи показателей степенишип,то, определив из последнего уравнения критерий Нуссельта, находят коэффициент массоотдачи
Nu.D
р
=
А
1
Определив коэффициенты массоотдачи для каждой из фаз, находят коэффициент массопередачи по уравнению аддитивности фазовых сопротивлений массопереносу.
В
приведенные выше критерии входит
характерный размер 1,выбор которого для аппарата, в котором
осуществляется процесс массообмена
между двумя и более фазами, далеко не
однозначен. В каждом отдельном случае
для аппарата определенного типа
приходится специально решать вопрос о
выборе характерного линейного размера.
При этом для уравнений массообмена в
каждой фазе могут быть взяты различные
характерные линейные размеры. Очень
часто в качестве характерного линейного
размера используется комбинация
физико-химических характеристик, имеющая
размерность длины, например капиллярная
постоянная
где а — поверхностное натяжение на границе раздела фаз.
МАССООБМЕН В СИСТЕМАХ С ТВЕРДОЙ ФАЗОЙ
В случае массообмена твердой фазы с жидкостью или газом процесс массопередачи происходит по схеме, приведенной на рис. 1-15. Концентрация компонента внутри твердого вещества уменьшается в направлении к поверхности раздела фаз. Перемещение вещества к границе раздела фаз происходит по законам массопроводности, являющихся аналогом законов молекулярной диффузии для жидкостей и газов. У поверхности твердой фазы возникает пограничная пленка жидкости (газа) толщиной <5, в пределах которой перенос вещества осуществляется молекулярной диффузией. На внешней границе пленки, сопрягающейся с ядром потока жидкой (газовой) фазы, происходит выравнивание концентрации с концентрацией в ядре потока сж. В ядре потока жидкости (газа) концентрации выравниваются за счет конвективной и молекулярной диффузии.
При переходе вещества из твердой фазы его содержание в этой фазе будет непрерывно уменьшаться как во времени, так и по направлению к границе раздела фаз. Поэтому все процессы с участием твердой фазы являются нестационарными.
Диффузия передаваемого компонента в твердой фазе происходит аналогично молекулярной диффузии и уравнение массопроводности записывается аналогично закону Фика
dM = -К
'de}
\dnJ
dF,
(1.37)
где
К
—коэффициент массопроводности, аналогичный
коэффициенту молекулярной диффузииD.
Количество вещества, перешедшее в ядро потока жидкости (газа), определяется уравнением конвективной диффузии
О С.

Пограничный слой
г/с° о С
; о
^ фазы L или G
соо
с
г>
с
О
с

с
Рис. 1-15. Схема массопередачи с участием твердой фазы
dM
=p(ccp- сж^Р =PAcdF.
Поскольку на границе раздела фаз вещество не накапливается и не исчерпывается, то из уравнений (1.37) и (1.38) получим
(1.38)
-К—
=(ЗДс. (1.39)
dn
Разделив правую часть уравнения (1-39) на левую и приняв во внимание соотношения (1.36), получим диффузионный критерий Био для массообменных процессов в присутствии твердой фазы
Bi
А
Аналогично уравнению (1.9) молекулярной диффузии можно получить следующее дифференциальное уравнение массопроводности
—
=
Эт
/
э2
с+_ + —
Эх2 Эу'
Эг‘
(1-40)
При делении левой части уравнения (1.40) на один из членов правой части с учетом соотношений (1.36) получим диффузионный критерий Фурье для процесса массопередачи в твердой фазе
Fo, =—.
А
В пределах твердой фазы концентрация распределенного вещества все время изменяется. Чтобы получить общее уравнение взаимосвязи между переменными оказалось удобным ввести безразмерную концентрацию
с -
I
с
н
С
Р
где
с, сни ср— соответственно
текущая, начальная и равновесная
концентрации. В числителе этого выражения
стоит величина движущей силы в любой
момент процесса, а в знаменателе —
максимальная величина движущей силы в
начале процесса. Очевидно, что безразмерная
концентрация изменяется в пределах
от единицы до нуля. Кроме того, величины
концентраций в отдельных точках тела
зависят от их относительного положения,
т.е. от симплексап/1,где п — расстояние в данном направлении,
а1— характерный линейный размер.
На основе вышеизложенного обобщенное уравнение массопередачи с участием твердой фазы будет иметь вид
с-ср т. п
у сн ср
, BiA.Foa,у = 0.
(1.41)
В практических расчетах обычно определяют время тк, в течение которого средняя концентрация компонента в твердой фазе достигнет заданной величины ск. Тогда из уравнения (1.41) можно исключить симплекс
Рис. 1-16. Общий вид зависимостей при массообмене с участием твердой фазы
геометрического
подобия п/1и результирующее уравнение представить
в общем виде
С —С к '-р
.
Bi.
РОд = /
С —С
\ Lp
Общий вид подобных зависимостей приведен на рис. 1-16.
Определив величину критерия Фурье, рассчитывают требуемую продолжительность процесса
п
1
=Fo. —.
Ак
