
Лекция № 4. Растворы.
План.
-
Введение. Основные термины.
-
Типы растворов.
-
Процессы, происходящие при растворении.
-
Способы выражения концентрации растворов.
-
Растворы электролитов. Степень и константа диссоциации.
-
Диссоциация воды, рН, гидролиз солей.
-
Произведение растворимости.
-
Растворимость газов, твердых и жидких веществ в жидкостях.
-
Свойства разбавленных растворов.
Самопроизвольное распределение одного вещества в другом в результате диффузии приводит к образованию растворов. Однако раствор нельзя рассматривать как простую смесь молекул различных веществ, так как свойства растворенного вещества и растворителя в общей системе раствора изменяются. Например, объем раствора не равен сумме объемов растворителя и растворенного вещества. Образование растворов происходит в результате взаимодействия молекул растворителя и растворенного вещества с образованием молекулярных ассоциатов переменного состава за счет действия межмолекулярных сил. Растворяющееся вещество диффундирует по всему объему раствора, содержание растворяемого вещества выравнивается во всех микрообъемах. Этот процесс тоже необратим, т.к. в результате его протекания энтропия увеличивается. В результате образуется однородная, гомогенная система.
Раствором называют находящуюся в состоянии равновесия гомогенную систему переменного состава из двух или более веществ. Характерной особенностью раствора является то, что его компоненты неразличимы невооруженным глазом.
Компонентами раствора называют вещества, составляющие раствор. Компонентами раствора являются растворитель и растворенное вещество. Однако эти понятия в известной степени условны. Например, в зависимости от соотношения количеств спирта и воды эта система может быть раствором спирта в воде (воды много, спирта мало) или воды в спирте (воды мало, спирта много).
Обычно растворителем считают тот компонент, который в растворе находится в том же агрегатном состоянии, что и до растворения. Например, в водном растворе сахара растворителем будет вода. В растворах электролитов вне зависимости от соотношения компонентов электролиты считают растворенными веществами, например, 96%-ый раствор серной кислоты в воде.
Растворы могут существовать в жидком и твердом агрегатных состояниях, но они обязательно должны состоять из одной фазы, т.е. из одной различимой на вид части системы. Жидкие растворы могут быть построены по типу:
-
жидкость – газ (СО2 в воде, HCl, NH3 в воде)
-
жидкость – жидкость (спирт в воде, бром в воде, уксусная кислота в воде)
-
жидкость – твердое вещество (соль в воде, сахар в воде, йод в спирте).
Это наиболее часто встречающиеся и наиболее изученные растворы. Они имеют большое значение в биологических процессах, химической, машиностроительной и приборостроительной технологиях.
Твердые растворы могут быть образованы твердыми (кристаллическими) веществами: металлами (сплавы), солями, оксидами металлов. Твердым раствором называют кристалл, кристаллическая решетка которого построена из двух или нескольких компонентов.
Металлические твердые растворы благодаря их высокой однородности широко используются в машиностроении, приборостроении в качестве конструкционных материалов, устойчивых к коррозии. Например, однофазная аустенитная сталь 1Х18Н9 («нержавеющая сталь») представляет собой твердый раствор, содержащий 18% хрома, 9% никеля и не более 0,1% углерода в γ-железе.
Отличительные свойства растворов:
1) от смесей – гомогенность
2) от химических соединений – переменность состава, изменение свойств растворителя и растворенного вещества не носит радикального характера.
По характеру взаимодействия растворяемого вещества с растворителем растворы бывают:
-
ионного типа (растворы электролитов)
-
молекулярного типа (растворы неэлектролитов).
Вещества с ионным типом химической связи в молекуле (ионные вещества), если их удается растворить в воде, образуют растворы ионного типа. Например. при растворении в воде ионного вещества NaCl образуется однородная смесь ионов Na+ и Cl– с водой.
При растворении большинства газов, органических веществ и некоторых неорганических веществ их молекулы остаются недиссоциированными. Такие растворы называют молекулярными. Растворенное вещество в них просто распределено в виде отдельных молекул между молекулами растворителя. Например, кислород, когда растворяется в воде, то существует в ней в виде молекул О2.
Главное отличие ионных растворов от молекулярных заключается в том, что ионные растворы проводят электрический ток, а молекулярные – нет.
В зависимости от концентрации растворенного вещества растворы:
-
концентрированные – содержание растворенного вещества свыше 5% массовых;
-
разбавленные – содержание до 5%.
Раствор, содержащий при данной температуре максимально возможное количество растворенного вещества и находящийся в равновесии с избытком растворяемого вещества, называют насыщенным (рис.2).
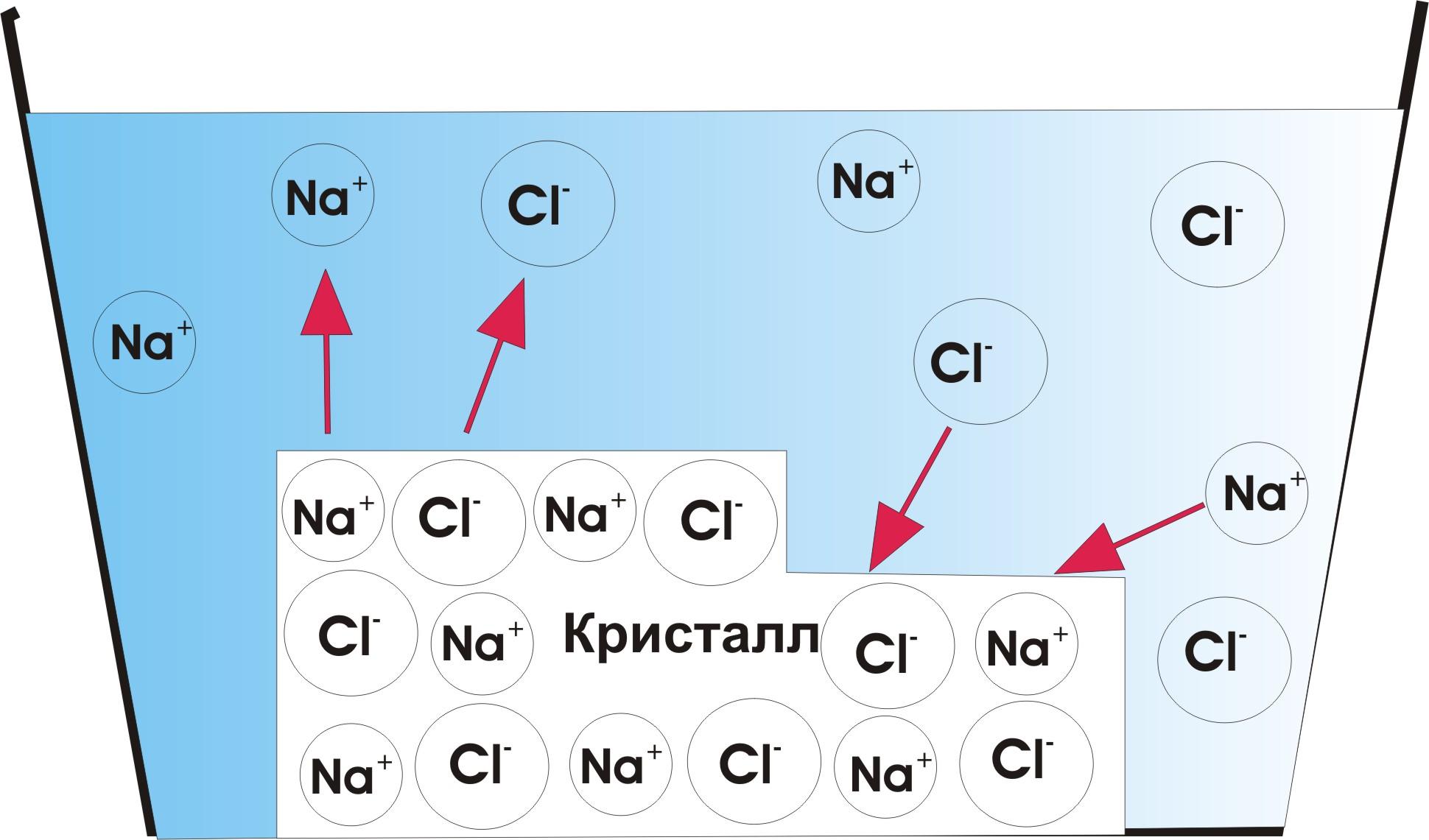
Рис. 1. Динамическое равновесие в насыщенном растворе.
Способность вещества растворяться в том или ином растворителе называют растворимостью. Численно растворимость вещества равна концентрации его насыщенного раствора. Для характеристики растворимости также используют коэффициент растворимости – масса вещества, при растворении которой в 100 г растворителя при данной температуре, образуется насыщенный раствор. Этот показатель зависит от температуры, при которой происходит растворение.
Ненасыщенный раствор – раствор, в котором содержание растворенного вещества меньше, чем его растворимость.
Пересыщенный раствор – раствор, в котором содержание растворенного вещества больше, чем его растворимость. Такие растворы можно получить при осторожном переохлаждении. Пересыщенные растворы метастабильны (условно стабильны), так как при внесении в такой раствор какой-либо затравки или при перемешивании возможно самопроизвольное выделение избытка растворенного вещества (либо выпадает осадок, либо появляется еще одна жидкость).
Универсальной теории растворения веществ нет, но существует эмпирическое правило:
Подобное растворяется в подобном: полярное – в полярном, неполярное – в неполярном.
(демонстрация растворения йода в воде с йодидом калия и спирте, четыреххлористого углерода в воде)
При растворении одного вещества в другом происходят следующие процессы:
-
смачивание
-
разрушение кристаллической решетки твердого вещества
-
сольватация (гидратация, если растворитель – вода)
-
диссоциация.
При растворении веществ могут происходить химические реакции между молекулами растворяемого вещества и растворителя, а могут и не происходить. Когда растворение вещества не сопровождается явно выраженной химической реакцией, между растворяемым веществом и растворителем происходит взаимодействие, которое называют сольватацией. Однако сольватация – это широкое понятие, относящееся к любому растворителю. Когда же растворителем является вода, это взаимодействие называют гидратацией. В результате гидратации образуются ассоциированные группы частиц, которые называют гидратами. Например, Al(H2O)63+, Cu(H2O)42+, Ni(H2O)62+, Со(Н2О)62+. Количество молекул воды зависит от:
1) размера катиона металла и его заряда,
2) строения атома металла.
Маленькие по размерам катионы металлов могут быть окружены лишь небольшим количеством молекул воды, но большой ион (например, Ce3+, K+, Na+) может присоединить к себе много молекул воды.
Способность воды гидратировать ионные вещества объясняется ее одной особенностью – большой величиной диэлектрической проницаемости ε. Диэлектрическая проницаемость служит мерой способности вещества ориентировать свои молекулы в электрическом поле и зависит от дипольного момента молекулы. Например, для воздуха ε=1, а для воды ε≈100. Следовательно, молекулы воды обладают большей способностью ориентироваться в электрическом поле.
Процесс растворения начинается с ориентации диполей воды вокруг всех выступов и граней кристалла (рис. 1). Поверхностные ионы K+ и Cl– гидратируются. Причем, энергия гидратации оказывается сильнее, чем энергия связи ионов в кристаллической решетке. Поэтому гидратированные поверхностные ионы K+ и Cl– освобождаются от непосредственного окружения в кристаллической решетке и переходят в раствор, а процессу гидратации подвергается следующий, более глубокий слой.
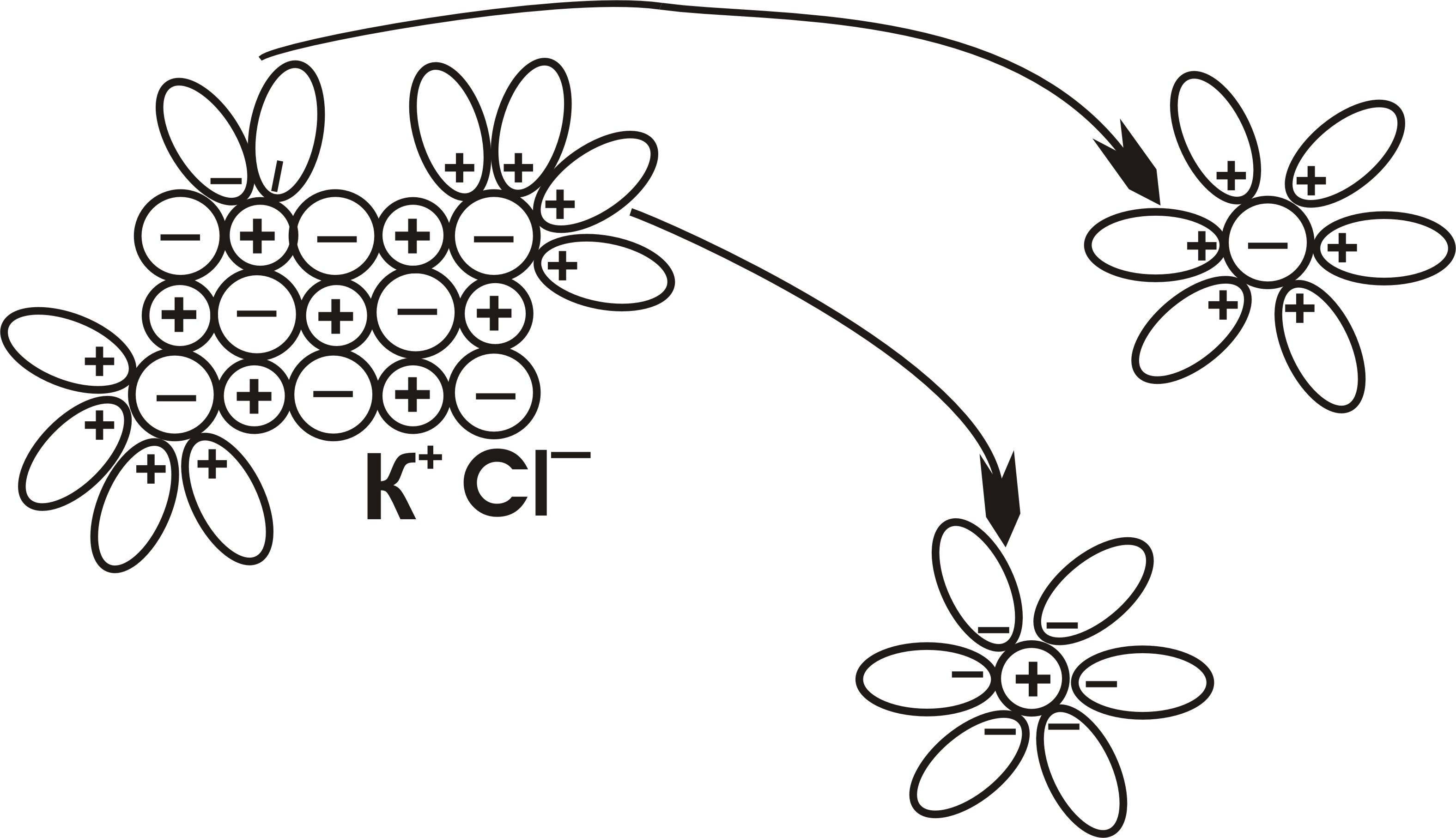
Рис. 2. Растворение кристалла хлорида калия в воде.
Растворение, как правило, сопровождается каким-либо тепловым эффектом. Тепловая энергия, которая выделяется или поглощается при растворении 1 моль вещества с образованием 1 л раствора, называется молярной энтальпией растворения.
Относительное содержание вещества в растворе характеризуется его концентрацией.
Способы выражения концентрации растворов
Концентрация вещества в растворе – величина, измеряемая количеством растворенного вещества, содержащегося в определенной массе или объеме раствора или растворителя.
Существует несколько способов выражения концентрации растворов: массовая концентрация, массовая доля, молярная доля, процентная, молярная, моляльная, нормальность (молярная концентрация эквивалента), титр.
Массовую концентрацию выражают в единицах массы растворенного вещества в единице объема раствора: г/л, мг/л, кг/л и т. д.
Массовую долю выражают в долях единицы или в процентах и рассчитывают по формулам:
ω = m (X) / m(р-р)
ω = m (X) / m(р-р) • 100%
m (X) – масса растворенного вещества, г; m(р-р) – масса раствора, г.
Объемную долю φ выражают в долях единицы или в процентах и рассчитывают по формуле:
φ = V (X) / V(p-p)
φ = V (X) / V(p-p) • 100%
V (X) – объем компонента Х раствора (растворенного вещества), V(p-p) – объем раствора.
Молярную концентрацию выражают в моль/л, моль/дм3 и рассчитывают по формуле:
СМ = n / V(р-р) = m / M•V(р-р)
n – количество молей растворенного вещества, m – масса растворенного вещества, M – молярная масса растворенного вещества, V – объем раствора, л.
Растворы электролитов
Полярные молекулы или вещества с ионной связью образуют растворы, проводящие электрический ток. Электропроводность в растворах электролитов создается направленным движением ионов – электрически заряженных частиц. В целом электролит нейтрален, т.к. сумма его положительных и отрицательных зарядов равна 0.
Растворы электролитов – растворы, в которых в заметной концентрации присутствуют ионы, обусловливающие прохождение электрического тока. Электролиты также называют проводниками 2 рода. В узком смысле слова электролиты – это вещества, молекулы которых в растворе вследствие электролитической диссоциации распадаются на ионы.
Различают:
-
электролиты твердые
-
растворы электролитов
-
ионные расплавы.
В соответствии с природой ионов, образующихся при диссоциации различают:
-
солевые электролиты (при диссоциации солей)
-
кислоты (преобладают ионы Н+)
-
- основания (преобладают ионы ОН-).
В 1887 г. шведский ученый Сванте Аррениус предложил теорию электролитической диссоциации в растворах, согласно которой диссоциация молекул на ионы происходит уже при растворении.
Электролитическая диссоциация (ионизация) – распад молекул электролитов на ионы в растворителе.
Теория Аррениуса не учитывала химического взаимодействия растворенного вещества с растворителем. Поэтому количественно она не могла объяснить различную степень диссоциации одного и того же вещества в разных растворителях.
В работах И.А Кублукова и В.А. Кистяковского была развита теория электролитической диссоциации на основе химической (гидратной) теории растворения Д.И. Менделеева. Они отмечали, что диссоциация вызывается не только ослаблением притяжения ионов в присутствии растворителя, но и сольватацией – взаимодействием полярных молекул растворителя с частицами растворенного вещества.

Именно сольватация (гидратация для водных растворов) является главной причиной диссоциации молекул растворенного вещества.
В водных растворах гидратация является 1 стадией диссоциации. Диполи воды взаимодействуют с полярными молекулами (тоже диполи) или ионами растворяемого вещества. В полярных молекула, например, хлороводороде HCl, под действием диполей воды происходит сильное смещение связывающих электронов и связь H-Cl становится ионной. Эту вторую стадию диссоциации называют поляризацией молекулы растворяемого вещества. И 3 стадией является собственно диссоциация – разрушение поляризованной молекулы и образование гидратированных ионов. При растворении веществ с ионной связью (кристаллы солей) 2 стадия – поляризация – отсутствует, т.к. связь уже достаточно сильно поляризована.
Роль растворителя заключается не только в создании условий для поляризации и разделения ионов противоположного знака, но и в замедлении их рекомбинации – образование из ионов молекул (процесс обратный диссоциации). Ведь при гидратации образуются относительно устойчивые соединения ионов с молекулами воды – гидраты. И гидратная оболочка ионов как раз и предотвращает их рекомбинацию.
С учетом гидратации уравнение диссоциации НCl можно записать
HCl + Н2О → H3О+ + Cl- .
Сильные электролиты – электролиты, которые полностью диссоциируют на ионы. А слабые электролиты не полностью диссоциируют. В растворах слабых электролитов наряду с ионами существуют неионизированные молекулы. Для количественной характеристики полноты диссоциации введено понятие степени диссоциации – отношение числа молекул, распавшихся на ионы, к общему числу молекул, введенных в раствор. Выражается в долях единицы или процентах:
α = Nи / N,
Nи – число молекул, распавшихся на ионы; N – число молекул, введенных в раствор. Степень диссоциации зависит от концентрации раствора, например: для раствора уксусной кислоты концентрации 0,1 моль/л α=0,013 или 1,3%.
В концентрированных растворах степень диссоциации меньше, чем в разбавленных, т.к. не хватает молекул Н2О для полной гидратации всех ионов электролита.
Если α>30% - сильные электролиты; α<3% - слабые; α в промежутке от 3 до 30% - электролиты средней силы.
Сильные – почти все соли; кислоты (H2SO4, HCl, HBr, HI, HNO3), основания (NaOH, KOH, Ca(OH)2, LiOH, Ba(OH)2).
Слабые – большинство органических кислот, некоторые неорганические (H2S, HCN, H2CO3, H2SO3, HСlO, H3BO3, Hg2Cl2, Fe(SCN)3).
Диссоциация сопровождается выделением или поглощением теплоты. Поэтому степень диссоциации зависит от температуры, влияние которой можно оценить по принципу Ле Шателье. Если диссоциация протекает с поглощением теплоты, то с повышением температуры диссоциация увеличивается, а если с выделением теплоты, то степень диссоциации уменьшается.
Степень диссоциации также зависит от концентрации раствора: при разбавлении растворов степень диссоциации возрастает. Это становится понятным, если рассмотреть диссоциацию как равновесный обратимый процесс с учетом гидратации:
KtAn + mH2O ↔ Kt+(H2O)x + An-(H2O)m-x
То в соответствии с принципом Ле Шателье разбавление водой смещает равновесие в сторону гидратированных ионов, т.е. степень диссоциации возрастает.
Количественно равновесие диссоциации можно охарактеризовать константой диссоциации (ионизации):
KtnAnm ↔ nKtm+ + mAnn-
Kд = [Ktm+]n [Ann-]m / [KtnAnm] = const при данной температуре!!!.
[Ktm+] и [Ann-] – молярные равновесные концентрации ионов электролита; [KtnAnm] – молярная равновесная концентрация недиссоциированных молекул электролита.
Пример: СН3СООН ↔ СН3СОО- + Н+
Кд = [СН3СОО-] [Н+] / [СН3СООН] = 1,8 •10-5.
Приведенное выше уравнение Кд справедливо только для разбавленных растворов слабых электролитов. Чем больше величина Кд, тем сильнее диссоциирует электролит, и наоборот.
Диссоциация воды. Водородный показатель.
Гидролиз солей
Полярные молекулы воды могут диссоциировать, проявляя при этом свою амфотерность:
Н2О ↔ Н+ + ОН- или 2 Н2О ↔ Н3О+ + ОН- + 56,6 кДж/моль –
эндотермический процесс
Т.е. одна молекула воды отдает протон, а другая присоединяет. В этом и есть проявление амфотерности воды. Этот процесс называют авто ионизацией воды.
Вода – очень слабый электролит, степень ее диссоциации равна ≈ 2•10-9. Чистая вода почти не проводит электрический ток.
Однако на все ионные равновесия в водных растворах присутствие ионов Н+ и ОН- оказывает влияние и процесс диссоциации воды необходимо учитывать.
Т.к. диссоциация воды обратима, то для нее также можно записать константу диссоциации:
Кд (Н2О) = [Н+]•[ ОН-] / [Н2О] = const при Т= const
Вообще говоря Кд зависит от температуры и для воды тоже. А т.к. диссоциация воды – эндотермический процесс, то с повышением температуры диссоциация увеличивается и Кд тоже увеличивается:
toC 0 22 50 100
Кд(Н2О)•1014 0,13 1,0 5,6 74
Для воды при 298 К Кд определена измерением электропроводности воды и равна 1,8•10-16. Учитывая ничтожно малую степень диссоциации воды ее концентрация может считаться постоянной величиной и равна 1000г/л : 18г/моль = 55,5 моль/л. Тогда:
Кд (Н2О) •[Н2О] = [Н+]•[ ОН-] =const
1,8 •10-16• 55,5 = [Н+]•[ ОН-] =const
[Н+]•[ ОН-] = 10-14 = const – ионное произведение воды, при 298 К.
Т.к. при диссоциации воды из 1 моль молекул образуется по 1 моль Н+ и ОН-, то их концентрации равны:
[Н+] = [ ОН-] = √10-14 = 10-7.
Для удобства пользования числами ввели новую величину:
-lg ([Н+]•[ ОН-]) = -lg10-14
-lg [Н+] + (-lg[ОН-]) = -lg10-14
рН + рОН = 14 = const
рН – водородный показатель – показатель концентрации ионов водорода; рОН – гидроксильный показатель - показатель концентрации гидроксид-анионов.
Растворы, в которых [Н+] = [ ОН-] = 10-7 и рН = рОН = 7, называют нейтральными.
Для кислых растворов:
[Н+] > 10-7> [ ОН-]
рН < 7 < рОН
Для щелочных растворов:
[Н+] < 10-7 < [ ОН-]
рН > 7 > рОН.
Гидролиз
В общем случае под гидролизом понимают обменную реакцию между веществом и водой (от греч. hýdor – вода и lysis – разложение).
Гидролиз соли – взаимодействие соли с молекулами воды, приводящее к образованию трудно диссоциирующих соединений.
В большинстве случаев гидролиз – обратимая реакция может быть охарактеризован константой гидролиза.
При гидролизе солей образуются слабые кислоты и основания, т.к. ионы, полученные при растворении соли, взаимодействуют с ионами Н+ и ОН-, всегда имеющимися в воде.
Механизм гидролиза солей заключается в поляризационном взаимодействии ионов соли с их гидратной оболочкой: ион соли взаимодействует с диполем воды. В поле иона диполь может поляризоваться еще сильнее, т.е. связь Н–ОН становится еще более полярной и разрывается. Чем сильнее это поляризационное взаимодействие, тем интенсивнее протекает гидролиз. Сильным поляризующим действием обладают ионы с высокой плотностью заряда, т. е. с меньшим размером и одновременно большим зарядом (Al3+, Zn2+, Cr+3, Cr+6, Mg+2 и др.). Среди катионов металлов наиболее сильным поляризующим действием обладают катионы атомов с 18-электронной внешней оболочкой, т. е. это d-элементы. Ионы с сильным поляризующим действием образуются из слабых электролитов: катионы – из оснований, а анионы – из кислот.
Типы гидролиза:
1) Гидролиз по катиону – гидролиз солей, образованных слабым основанием и сильной кислотой:
NH4Cl + HOH ↔ NH4OH + HCl
NH4+ + Cl- + HOH ↔ NH4OH + Cl- + H+ pH < 7
Константа равновесия реакции гидролиза называется константой гидролиза и рассчитывается:
Кг = [NH4OH][ HCl] / [NH4Cl][ HOH] = const при Т= const
2) Гидролиз по аниону – гидролиз солей, образованных слабой кислотой и сильным основанием:
K3PO4 + HOH ↔ K2HPO4 + KOH
3K+ + PO43- + HOH ↔ 3K+ + HPO42- + OH- pH >7
Кг = [K2HPO4][ KOH] / [K3PO4][ HOH] = const при Т= const
3) Полный гидролиз – гидролиз солей, образованных слабой кислотой и слабым основанием:
NH4CN + HOH ↔ NH4OH + HCN
NH4+ + CN- + HOH ↔ NH4OH + HCN
В таких случаях, чтобы определить реакцию раствора необходимо сравнить константы диссоциации кислоты и основания:
Кд (NH4OH) = 1,8·10-5 > Кд (HCN) = 7,2·10-10,
Значит основание диссоциирует лучше и, следовательно, концентрация ОН- будет выше, чем концентрация Н+, среда щелочная.
Соли многоосновных кислот и много кислотных оснований гидролизуются ступенчато, но при комнатной температуре гидролиз идет преимущественно по 1 ступени, т.е. в реакцию с 1 молекулой соли вступает только 1 молекула воды.
Произведение растворимости
Накопление недиссоциированных молекул в результате смещения равновесия диссоциации может привести к насыщению раствора и выпадению осадка.
Рассмотрим раствор BaSO4, по концентрации близкий к насыщению. Так как в насыщенном растворе существует равновесие между растворяющимся веществом и растворенным, то можно допустить обратимость диссоциации:
BaSO4 ↔ Ba2+ + SO42-
Кд = [Ba2+] [SO42-] / [BaSO4] = const при Т=const.
Для насыщенного раствора концентрация [BaSO4] будет постоянной величиной при данной температуре и ее можно внести в величину константы:
Кд [BaSO4 ]= [Ba2+] [SO42- ] = const = ПР – произведение растворимости.
Чем меньше величина ПР, тем труднее данная соль растворима в воде. Это связано с тем, что чем меньше величина ПР, тем меньше концентрации ионов, при которых может образоваться осадок соли. Например для BaSO4 ПР= 1,8•10-10, для PbS ПР = 1,7•10-29. ПР показывает, при каком произведении концентраций ионов в растворе может выпадать осадок вещества, состоящего из данных ионов. С другой стороны, если нам известны концентрации ионов, то посчитав их произведение, мы можем определить, выпадет осадок или нет. ПР широко используется в аналитической химии и технологии.
Растворимость твердых и жидких веществ в жидкостях
При растворении твердых и жидких веществ в воде объем системы обычно изменяется незначительно, поэтому давление практически не влияет на растворимость таких веществ. Только при очень высоких давлениях такое влияние становится заметным. Например, растворимость нитрата аммония в воде снижается почти в 2 раза при повышении давления до 106 кПа.
Зависимость растворимости твердых веществ от температуры определяется знаком и числовым значением теплоты растворения. В тех случаях, когда процесс растворения является эндотермическим (происходит с поглощением тепла), повышение температуры приводит к увеличению растворимости. Когда растворение – экзотермический процесс (с выделением тепла), с ростом температуры растворимость снижается. Зависимость растворимости от температуры изображают графически в виде кривых растворимости.
При смешении двух жидкостей возможны три варианта:
1) неограниченная растворимость
2) ограниченная растворимость
3) практически полная нерастворимость.
Например, спирт и вода неограниченно растворимы друг в друге, т.е. образуют гомогенную (однородную) систему при смешении в любых пропорциях.
Ограниченная растворимость жидкостей наблюдается, например, при смешении воды и анилина C6H5NH2, анилина и гексана. Например, если смешать анилин и гексан С6Н14 при комнатной температуре, то образуются 2 слоя: верхний слой – насыщенный раствор анилина в гексане, нижний – насыщенный раствор гексана в анилине. С повышением тепературы растворимость анилина в гексане и гексана в анилине увеличивается до тех пор, пока не будет достигнута температура, выше которой образуются гомогенные анилино-гексановые растворы. Рост взаимной растворимости обусловлен эндотермичностью процесса растворения.
Примером практически полностью нерастворимых друг в друге жидкостей являются бензол и вода, вода и хлороформ, вода и тетрахлорметан (см. демострационный опыт).
Растворимость газов в жидкостях
Растворение газа в жидкости может осуществляться либо в результате ван-дер-ваальсова притяжения между молекулами газа и растворителя либо в результате химического взаимодействия между ними.
Силы ван-дер-ваальса (представление о них впервые было введено голландским ученым Ван дер Ваальсом) обусловлены взаимодействием положительных и отрицательных зарядов соседних атомов.
Так О2 растворяется в воде только за счет сил притяжения Ван-дер-Ваальса. А при растворении аммиака в воде молекулы аммиака сильно гидратируются молекулами воды. Часть растворенного аммиака вступает в реакцию с водой:
NH3 + H2O → NH4+ + OH– .
А СО2 частично просто смешивается с водой, а частично реагирует с ней по схеме:
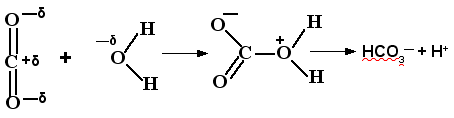
Растворение газов в жидкостях почти всегда сопровождается выделением теплоты. Поэтому растворимость газов в жидкости с повышением температуры согласно принципу Ле Шателье понижается, а при понижении температуры – повышается. Эту закономерность часто используют для удаления растворенных в воде газов кипячением.
При растворении газа в жидкости происходит значительное уменьшение объема системы, поэтому повышение давления приводит к значительному увеличению растворимости газов в жидкостях. Если газ мало растворим в данной жидкости и давление невелико, то растворимость газа прямо пропорциональна его парциальному давлению над поверхностью жидкости. Эта зависимость называется законом Генри и выражается следующим образом:
С (Х) = Кг (Х) р (Х)
С(Х) – молярная концентрация газа в насыщенном растворе, моль/л; р(Х) – парциальное давление газа над раствором, Па; Кг(Х) – постоянная Генри для газа Х, моль·л-1·Па-1. Она зависит от природы газа, растворителя и температуры.
Растворимость газов в воде снижается также при растворении в ней электролитов. В результате гидратации часть молекул воды связывается с ионами электролита, поэтому ее способность к растворению молекул газа снижается. (Демонстрация снижения растворимости СО2 в питьевой газированной воде при добавлении в нее пищевой соли).
Свойства разбавленных растворов
Свойства разбавленных растворов подразделяются на 2 группы:
-
зависящие от природы растворенного вещества (цвет, плотность),
-
независящие от природы растворенного вещества, а только от количества растворенных частиц – коллигативные свойства.
Основная причина зависимости свойств растворов от количества растворенных частиц – уменьшение количества свободных молекул растворителя.
