
Лекции по химии. Судакова Т.В. / Лекция 11метал сплавы
.docЛекция 11. Общие свойства металлов. Сплавы.
План
1. Введение. Классификация металлов.
2. Металлическая связь.
3. Химические свойства.
4. Природные соединения металлов.
5. Общие методы получения.
6. Сплавы.
7. Интерметаллические соединения.
Металлы служат основным конструкционным материалом в машиностроении и приборостроении. Все они обладают общими так называемыми металлическими свойствами, но каждый элемент проявляет их в соответствии с его положением в периодической системе элементов, т.е. в соответствии с особенностями строения его атома.
Из 110 известных к настоящему времени элементов только 22 относится к неметаллам, остальные – большинство - металлы. Последние отличаются от неметаллов химическими, физическими, механическими свойствами. К металлам относятся все s-, d-, f- элементы, а также небольшое количество (7 из 30) p- элементов – алюминий, галлий, индий, таллий, олово, свинец, висмут. В подавляющем большинстве простых веществ этих элементов реализуется металлическая связь.
Металлам присущи характерные признаки, проявляющиеся, как правило, одновременно. Почти все металлы тяжелее воды и являются твердыми веществами в компактном состоянии. Им присущ так называемый металлический блеск. Большинство из них серые или белые, но медь, цезий и золото – красного или желтого цвета. В высокодисперсном состоянии (порошки) металлы обычно имеют черный цвет и не блестят.
Металлы можно подразделить на группы: черные (Fe), тяжелые цветные (Cu, Pb, Zn, Ni, Sn, Hg, Co, Sb, Bi, Cd, ρ≥ 5 г/см3), легкие (Al, Ca, Mg ρ≤ 5 г/см3), драгоценные (Au, Ag), платиновые (Ru, Rh, Pd, Os, Ir, Pt), редкоземельные (La и лантаноиды, Y, Sc). Драгоценные и платиновые металлы вместе образуют группу благородных металлов.
Металлическая связь определяет физические свойства металлов и сильно сказывается на химических соединениях металлов. Атомы металлов содержат мало валентных электронов на внешних энергетических уровнях (1-2), а количество орбиталей с низкой энергией значительно больше. Поэтому электроны в металлах сильно делокализованы - могут мигрировать по орбиталям. Вследствие малой плотности электронов на внешних уровнях атомы металлов при кристаллизации сближаются и обобщают электроны. При этом при перекрывании внешних орбиталей, в отличие от ковалентной связи, не наблюдается направленного взаимодействия между атомами. Электроны мигрируют от одного атома к другому, осуществляя металлическую связь.
В электрическом поле мигрирующие электроны получают направленное движение – электрический ток и способны ускоряться. Такое состояние электронов называется состоянием проводимости. Плотность электронов проводимости 1022 – 1023 см-3.
На границе раздела двух различных металлов возникает контактная разность потенциалов. Это обусловлено различной концентрацией электронов проводимости и различной работой выхода электрона у соприкасающихся металлов. Некоторые пары металлов обладают значительной контактной разностью потенциалов. Величина этой разности потенциалов зависит от температуры, что используется для измерения температур (принцип термопар). Чаще применяются термопары из платины и ее сплава с родием.
Деформация внешних атомных орбиталей при кристаллизации и образование ненаправленной металлической связи определяют строение кристаллических решеток металлов. Прежде всего они характеризуются высокими координационными числами – от 8 до 12. Относятся решетки к кубической сингонии: объемно-центрированный куб, гранецентрированный куб, или гексагональной – гексагональная плотная упаковка.
Характерная особенность металлических кристаллов, связанная с ненаправленностью металлической связи, создаваемой мигрирующими электронами, является способность к пластической деформации. Смещение плоскостей, заполненных атомами, в кристалле металла не означает его разрушения, если только расстояния между ними изменяются в допустимых пределах, так чтобы металлическая связь не нарушалась.
Пластичность – способность к пластическому деформированию – более присуща металлам, чем, например, керамическим материалам. В металлах внешние электроны стремятся рассосредоточиться между атомами, поэтому напряжение, возникшее на остром краю малой трещины легко снимается: для этого достаточно всего небольшого сдвигового усилия. В керамике элеткроны сильно локализованы в своих атомах и химическая связь имеет строгую направленность. Смещение дефекта требует разрыва этих связей и образования новых, так что сила, неспособная сместить дефект оказывается сильнее прочности материала и он разрушается.
Химические свойства.
Для металлов характерны следующие общие химические свойства:
1) малая электроотрицательность как следствие низких потенциалов ионизации и малого, чаще отрицательного, сродства к электрону;
2) атомы металлов образуют только положительные элементарные ионы, отдавая электроны
Me0 → Men+ + nē;
3) в сложных ионах или полярных молекулах атомы металлов всегда образуют положительные центры.
Двумя характерными свойствами многих металлов являются образование основных оксидов и гидроксидов, когда металл находится в степени окисления +1 или +2. В этом состоянии металлы в кислых водных растворах существуют в виде гидратированных катионов.
Элементы середины d-блока проявляют значительное разнообразие химических свойств, т.к. могут существовать в различных степенях окисления и способны образовывать множество комплексов. Химические свойства d- элементов определяются степенью заполнения электронами d- подуровня, возможностью возбуждения электронов подуровней d и s для образования связей. Для d- элементов 4 периода наблюдается сходство в распределении электронов с р- элементами этого же периода:
Sc 4s2, 3d1 Ti 4s2, 3d2 V 4s2, 3d3 Cr 4s2, 3d4 Mn 4s2, 3d5
Ga 4s24p1 Ge 4s24p2 As 4s24p3 Se 4s24p4 Br 4s24p5
Поэтому наблюдается некоторое сходство химических свойств металлов с р- элементами и в первую очередь, возможность проявлять высокие степени окисления. Однако это сходство наблюдается только для d – металлов, заполняющих подуровень только до половины непарными электронами. Начиная со структуры d6s2, т.е. с момента появления в подуровне d электронных пар, это сходство утрачивается, т.к. спаренные электроны обычно не принимают участия в образовании химической связи и высшая степень окисления снижается.
Для d – металлов 5 и 6 периодов это снижение задерживается, т.к. они обладают вакантными f и g – орбиталями. В состоянии возбуждения d –электроны могут распариваться и переходить на свободные f и g – орбитали. Этот процесс реализован в виде соединений RuO4 и OsO4 для аналогов Fe. Для остальных d- металлов такие соединения по-видимому, еще не получены.
Все соединения d –металлов в зависимости от степени окисления можно разделить на 3 группы:
1) соединения высшей степени окисления (+4, +5, +6, +7, +8)
2) соединения промежуточной степени окисления (+3, +4)
3) соединения низшей степени окисления (+1, +2).
Соединениям высшей степени окисления свойственны ковалентнополярные связи, приближающие эти соединения к соединениям р- элементов этих групп. В соединениях промежуточной степени окисления еще сохраняется значительная доля ковалентной полярной связи. Эти соединения обычно проявляют амфотерность и если не в водных средах, то при сплавлении. Соединения низшей степени окисления образуют молекулы или кристаллы ионного типа.
Химические свойства металлов разнообразны, но в свободном виде общим для всех металлов является то, что они всегда бывают восстановителями. Поэтому они вступают в реакции с типичными окислителями – простыми веществами неметаллами. Отношение металлов к простым веществам окислителям представлено в таблице:
|
Окис- литель |
Реагируют |
Реагируют и пассивируются |
Не реагируют |
Основной продукт |
|
F2
|
Почти все |
Al, Fe, Ni, Cu, Zn – без нагревания |
_ |
Фторид (NaF, AlF3, ZnF2) |
|
Cl2
|
Почти все |
Fe – в отсутствие влаги |
_ |
Хлорид (KCl, NiCl2, AlCl3) |
|
O2
|
Многие |
Al, Ti, Pb, Be, Mg – без нагревания |
Au, Pt |
Оксид (Al2O3, MgO, Na2O) |
|
S
|
Многие, но при нагревании |
_ |
Большинство (при н.у. и охлаждении) |
Сульфид (Na2S, MgS) |
|
H2
|
Щелочные и щелочно-земель-ные металлы |
_ |
Большинство, но многие рас- творяют водо-род |
Гидрид (NaH, CaH2, MgH2) |
|
N2 |
Li, щелочно-земель-ные металлы
|
_ |
Почти все |
Нитрид (Li3N, Ca3N2) |
Почти все металлы реагируют с кислородом, но термодинамическая вероятность и скорость этой реакции меняются при переходе от цезия, который загорается при контакте с воздухом, к металлам типа алюминия и цинка, устойчивым в этих условиях.
Отношение металлов к воде и водным растворам окислителей.
В водных растворах восстановительная активность металлов характеризуется значением стандартного окислительно-восстановительного потенциала. Ионы металлов являются окислителями, а металлы в виде простых веществ – восстановителями. Чем ближе металл к началу ряда напряжений, тем более сильные восстановительные свойства проявляет простое вещество – металл. Чем дальше от начала ряда расположен металл, тем более сильным окислителем в растворе является катион металла.
Металлы способны вытеснять друг друга из растворов солей. Направление реакции определяется при этом их взаимным расположением в ряду напряжений.
Взаимодействие с водой.
Окислителем в воде формально является катион водорода. Поэтому принципиально окисляться водой могут те металлы, стандартные электродные потенциалы которых меньше потенциала восстановления водорода в воде. Последний зависит от рН раствора:
φ = - 0,059•рН = 0,059•7 = -0,413В.
|
Активные Li - Al |
Средней активности Al – H2 |
Малоактивные H2 - Au |
|
Реагируют Ме0 + Н2О → Ме+ОН + Н2
|
Реагируют при нагре-вании, пассивируются: Al, Ti, Cr, Fe, Co, Ni, Zn, Sn, Cd, Pb |
Не реагируют |
Взаимодействие со щелочами. Со щелочами могут реагировать:
1) металлы, дающие амфотерные оксиды:
Ме0 + 2ОН– → МеО2– + Н2
Ме0 + Н2О + 2ОН– → [Ме(ОН)4]– + Н2
Взаимодействие с кислотами.
С кислотами металлы реагируют различно в зависимости от активности металла и окислительных свойств кислоты. Наиболее типичная реакция для свободных металлов и кислот:
Ме0 + 2Н+ → Ме2+ + Н2 , окислитель - 2Н+ .
Если кислоты кислородсодержащие и атомы неметаллов, их образующие, будут иметь высшие степени окисления, то окислителем будут не катионы водорода, а кислотообразующие атомы неметаллов. Они могут восстанавливаться до различных степеней окисления.
Для конц. H2SO4 (окислитель - S+6)
|
Активные |
Средней активности |
Малоактивные |
|||
|
Реагируют
|
Реагируют; реагируют и пассивируются Al, Fe |
Реагируют: Cu, Hg |
Не реагируют: Ag, Au, Ru, Os, Rh, Ir, Pt |
||
|
Кислота восстанавливается до продуктов: |
|||||
|
H2S |
S |
SO2 |
- |
||
Кроме того. Образуются соли серной кислоты – сульфаты.
Для разбавленной HNO3 (окислитель N+5):
|
Активные |
Средней активности |
Малоактивные |
|
|
реагируют |
Реагируют, пассивируется Ti |
Реагируют: Cu, Hg, Ag |
Не реагируют: Au, Ru, Os, Rh, Ir, Pt |
|
Кислота восстанавливается до продуктов: |
|||
|
NH4NO3 |
N2, N2O |
NO |
- |
Кроме этого, в большинстве случаев образуются соли азотной кислоты – нитраты.
Для конц. HNO3 (окислитель N+5):
|
Активные |
Средней активности |
Малоактивные |
|
|
реагируют |
Реагируют, реагируют и пассивируются Al, Ti, Cr, Fe |
Реагируют Cu, Hg, Ag |
Не реагируют Au, Ru, Os, Rh, Ir, Pt |
|
Кислота восстанавливается в основном до NO2 |
|||
Как уже было сказано, металлы подразделяются на s-,d-,f-,p- семейства. Металлы разных семейств несколько отличаются друг от друга по химическим свойствам, т.к. имеют различное строение внешнего энергетического уровня.
Руды – природные соединения металлов.
Вследствие высокой активности большинство металлов в природе встречается в соединениях. Только металлы малой химической активности (Cu, Ag, Hg, Au, Pt) встречаются в природе в свободном состоянии, в виде вкраплений в горные породы или в результате разрушения горных пород в россыпях (золотоносный песок). Иногда эти металлы встречаются в значительных россыпях – самородки.
В природе металлы образуют соединения с различными окислителями и по этому признаку классифицируют руды.
Оксидные руды.
Fe2O3 - гематит,
Fe2O3 • H2O - гетит
Al2O3 - боксит
TiO2 – рутил.
Карбонатные – легко переходят в оксидные, разлагаясь при нагревании:
CaCO3 - Мрамор, мел, известняк; MgCO3 - магнезит, CuCO3•Cu(OH)2 малахит.
Силикатные и алюмосиликатные.
Полевой шпат ортоклаз K2O•Al2O3•6SiO2, каолинит Al2O3•2SiO2•2H2O, берилл 3BeO•Al2O3•6SiO2. Очень трудно поддаются переработке. Из них добывают только те металлы, которые не встречаются в других соединениях.
Сульфидные.
FeS2 – железный колчедан, Cu2S•FeS2 – медный колчедан, PbS – свинцовый блеск, ZnS – цинковая обманка. Обычно сульфидные руды содержат несколько металлов.
Галидные.
NaCl- каменная или поваренная соль, KCl - сильвин, KCl•MgCl2•6H2O – карналлит.
Общие методы получения металлов.
1. Вытеснение металла более активным металлом. Этот процесс можно проводить:
-
в водном растворе – гидрометаллургия
2[Au(CN)2]– + Zn → [Zn(CN)4]2– + 2Au
-
при высоких температурах – металлотермия
3V2O5 + 10Al →5Al2O3 + 6V
TiCl4 + 4Na → Ti + 4NaCl
2. Восстановление металлов неметаллами - газообразными СО и Н2 или твердым углеродом – пирометаллургия (только при высоких температурах):
МеО + СО ↔ Ме + СО2
МеО + С ↔ Ме + СО
МеО + Н2 ↔ Ме + Н2О
3. Электрометаллургия - электролиз либо водных растворов либо расплавов. Этим способом можно выделить металл любой активности, но только из соединений с ионной связью. Ковалентные полярные соединения (TiCl4, ZrCl4) не подвергаются гидролизу. Обычно электролизом получают металлы высокой активности(Na, K, Be, Mg, Al, Ca), которые другими методами получить практически невозможно.
Сплавы
Сплав - макроскопически гомогенная система, обладающая металлическими свойствами и состоящая из двух или более химических элементов. Составной частью сплава может быть любой химический элемент, хотя в значительных количествах в них содержатся только металлы.
При образовании сплавов атомы компонентов координируют свои положения в кристаллической решетке так, чтобы наступило термодинамическое равновесие, т. е. чтобы свободная энергия Гиббса достигала своего наименьшего значения.
Образуя жидкие растворы, в результате кристаллизации которых получаются сплавы, металлы дают системы с разнообразными свойствами. Образование различных типов сплавов зависит от сил взаимодействия между атомами, образующими данный сплав.
Классификация сил взаимодействия и образующихся систем:
1. Отсутствие взаимодействия или очень слабое взаимодействие является причиной того, что эти металлы не образуют гомогенных растворов даже в жидком состоянии и дают расслаивающиеся жидкие фазы из чистых металлов. При охлаждении такой системы образуются два затвердевших слоя различной плотности. Такие системы дают алюминий и свинец, алюминий и кадмий, цинк и свинец. Поэтому эти пары не используются для получения сплавов.
2. Более сильное взаимодействие между атомами металлов приводит к образованию непрерывных или неограниченных жидких растворов, при кристаллизации которых металлы выделяются в свободном состоянии и не образуют твердых растворов. Полученный сплав представляет собой гетерогенную систему из кристаллов отдельных компонентов. Сплавы этого типа в технике встречаются довольно часто.
3. Еще более сильное взаимодействие между атомами металлов приводит к образованию растворов не только в расплавленном состоянии, но и в твердом. При кристаллизации расплава выпадают кристаллы твердого раствора двух или более металлов и сплав получается гомогенным. Такими сплавами являются, например, нержавеющие или жаропрочные стали, содержащие хром, никель и другие добавки в небольших количествах, растворенные в железе.
Твердым раствором называется однородное (гомогенное) кристаллическое вещество переменного состава, в кристаллическую решетку которого входят атомы или ионы нескольких компонентов. Твердые растворы по растворимости компонентов разделяют на непрерывные твердые растворы с постепенно меняющейся концентрацией от 0 до 100% и ограниченные растворы, в которых существует предел растворимости одного металла в другом.
Большое распространение твердых растворов среди сплавов, связано с тем, что большинство растворов построено по металлическому типу, предусматривающему соединение не химическими связями, а притяжением к свободным электронам, находящимся между ними. Связи этого типа мало чувствительны к соблюдению точного количественного соотношения атомов, участвующих в образовании раствора и к их точному расположению в атомных местах. Это благоприятствует образованию разупорядоченных твердых растворов в широком интервале составов. В отличие от этого в неметаллических кристаллах, например таких, как хлористый калий, ионная природа связи требует соблюдения точного соотношения разнородных атомов и строго определенного их расположения.
По физическому строению твердые растворы подразделяют на ряд типов, основными из которых являются растворы замещения и растворы внедрения, а также упорядоченные растворы. Растворы замещения образуются, когда атомы одного металла последовательно замещают в кристаллической решетке атомы другого металла, и постепенно кристаллическая структура одного металла переходит в структуру другого. Например, медь может образовывать непрерывный ряд растворов замещения с никелем.
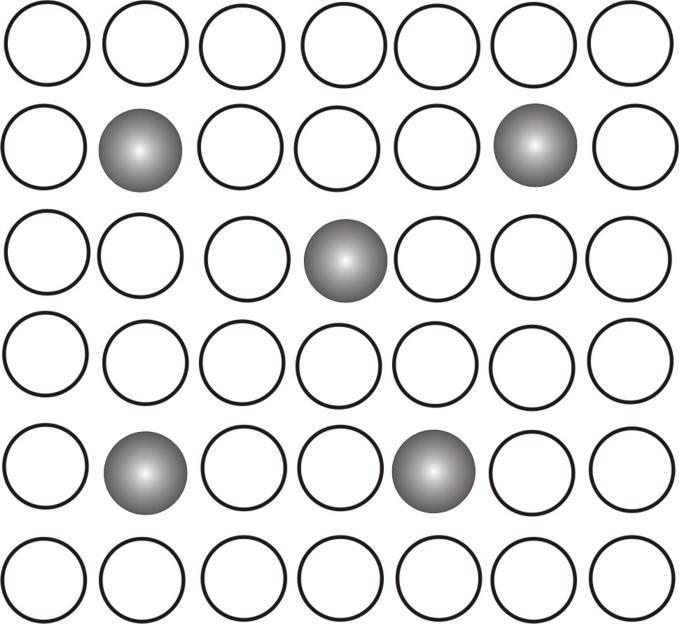

А) раствор замещения б) раствор внедрения
В )
упорядоченный раствор
)
упорядоченный раствор
Растворы внедрения образуются за счет проникновения в межатомное пространство кристаллической решетки данного метала других атомов металлического или неметаллического типа. Эти атомы имеют меньший радиус, чем атомный радиус основного металла, и занимают свободное пространство между узлами решетки. В это пространство могут внедряться атомы неметаллов с радиусом менее 0,1 нм (H, N, C, B). Растворы внедрения чаще всего образуются переходными металлами (d- элементы).
Упорядоченные твердые растворы – растворы, в которых расположение атомов растворенного элемента в кристаллической решетке основного металла имеет определенную закономерность (порядок). Перестройка структуры раствора при переходе из одного упорядоченного состояния в другое влияет на физические и механические свойства сплава. Упорядоченность может быть уменьшена или полностью устранена при пластической деформации. Например, упорядоченные сплавы образуют медь и золото Cu3Au или CuAu.
4. Очень сильное взаимодействие атомов металлов приводит к образованию интерметаллических соединений (интерметаллиды, металлиды). Интерметаллиды – от латинского inter – между и metall металл - химические соединения металлов между собой. К ним также относятся соединения переходных металлов с неметаллами (Н, В, С, N и др.). В таких соединениях металлическая связь, поэтому состав их обычно не отвечает формальной валентности их компонентов и может изменяться в значительных пределах.
ПРИМЕРЫ:
Примеры интерметаллидов: ScMn2, Sc3Fe, ScFe3, Sc2Co, TiCr3, CrMn3, CrFe, MnFe2, Mg2Si, Mg2Ge, Mg2Sn, Mg2Pb, Mg3P2, Mg3As2, Mg3Sb2, Mg3Bi2, Ag3Sn .
Эти соединения имеют свою собственную кристаллическую структуру и свойства. Устойчивость интерметаллидов различна: одни из них могут существовать и в жидкой и в твердой фазах, а другие только в твердой фазе, распадаясь при нагревании. Интерметаллиды образуются в результате взаимодействия металлов при сплавлении, конденсации из пара, при реакциях в твердом состоянии вследствие взаимной диффузии, в результате интенсивной пластической деформации при механическом сплавлении (механоактивации). Для интерметаллидов характерен преимущественно металлический тип связи и специфические металлические свойства и, прежде всего, значительная способность к пластической деформации. Однако среди них имеются также солеобразные соединения с ионной связью, а также соединения с ковалентной и ковалентно-ионной связью. Ионные интерметаллиды обладают свойствами, характерными для солей: высокая температура плавления, пониженная по сравнению с металлами электропроводимость, многие разлагаются водой.
Металлы группы железа и платины при образовании интерметаллидов проявляют нулевую валентность. Это доказывает их магнитное поведение: в чистом виде они парамагнитны (т.е. обладают магнитными свойствами), а в интерметаллических соединениях – диамагнитны (т.е. не обладают магнитными свойствами), т.к. их свободные электроны теперь заполняют d-орбитали).
В сплавах интерметаллиды ведут себя, обычно, как самостоятельные компоненты, характеризуясь определенным составом и температурой плавления.
Примеры некоторых сплавов:
-
Чугун – сплав Fe с С, содержание С выше 2% масс.;
-
Сталь – сплав Fe с С, содержание С менее 2% масс.;
-
Зеркальный чугун – сплав Fe с С (3,5-5,5%) и Mn (5-20%);
-
Марганцовистая сталь – сталь, содержащая марганец; добавление в сталь более 1% марганца делает сталь более твердой и износостойкой, но менее пластичной;
-
Манганин – сплав 11% Mn, 2,5-3,5% Ni и 86% Cu; обладает высоким электросопротивлением и очень малой термоэлектродвижущей силой в паре с медью, поэтому используется для катушек сопротивления; под действием очень высокого давления (15000-30000 атм.) меняет свое сопротивление, поэтому используется в электрических манометрах. Манганины обладают ценным свойством – демпфированием, т.е. поглощают энергию механических колебаний – при ударе по сплаву звук не звучит громко. Самые «тихие» сплавы содержат 70% Mn и 30% Cu и некоторые из них по прочности не уступают стали.
Свойства металлов можно улучшить, подвергая их различным воздействиям: деформируя металл, его можно сделать тверже, подвергая нагреву – более жаропрочным. Чтобы получить металлы с такими свойствами, необходимо придать им определенную кристаллическую структуру!
Атомы в металле плотно упакованы, подобно уложенным в коробке шарам, и стремятся образовать тесно прилегающие плоскости. Характер такого сопряжения плоскостей определяет многие механические свойства металла. Добавление в один металл атомов другого металла (получение сплавов) изменяет характер сопряжения атомных плоскостей, следовательно меняются и механические свойства, особенно прочность. Например, бронза (сплав меди и олова) оказывается прочнее и меди и олова.
Дефекты кристаллической структуры – места, в которых нарушается сопряжение атомных плоскостей, - играют доминирующую роль в объяснении таких свойств металлов, как пластичность, хрупкость, их поведение при высоких температурах.
Германские физики из Исследовательского центра Дрезден-Россендорф и Дрезденского технического университета экспериментально зарегистрировали редкий эффект — сосуществование сверхпроводящего и ферромагнитного состояний — в наноразмерных образцах интерметаллического соединения никеля и висмута Bi3Ni.

