
- •ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- •Я. Х. Вант- Гофф
- •Зависимость скорости реакции от температуры
- •Зависимость ln k от 1/T.
- •Изменение энергии реагирующей системы:
- •ТЕОРИЯ
- •Распределение молекул по скоростям при данной температуре
- •КИНЕТИЧЕСКИЕ МОДЕЛИ ДЛЯ БИОЛОГИЧЕСКИХ СИСТЕМ
- •ОСОБЕННОСТИ КИНЕТИКИ БИОЛОГИЧЕСКИХ СИСТЕМ (БС)
- •Модель Мальтуса.
- •Модель Ферхюльста. Рост популяции, ограниченный ресурсами
- •Вито
- •Совместное существование жертв и хищников
- •ФЕРМЕНТАТИВНЫЙ
- •ОСОБЕННОСТИ ФЕРМЕНТОВ
- •АКТИВНЫЙ ЦЕНТР ФЕРМЕНТА –ЭТО
- •АКТИВНЫЙ ЦЕНТР
- •АКТИВНЫЙ ЦЕНТР АЦЕТИЛХОЛИНЭСТЕРАЗЫ
- •Фермент -химотрипсин
- •Синтезированная модель ключевого элемента активного центра фермента цитохромоксидазы (По
- •РОЛЬ ФУНКЦИОНАЛЬНЫХ ГРУПП
- •ЧАСТО АКТИВНЫЙ ЦЕНТР РАСПОЛОЖЕН НА СТЫКЕ ДОМЕНОВ, ЛИБО В СТАНДАРТНО РАСПОЛОЖЕННОЙ «ВМЯТИНЕ»
- •СУБСТРАТ ОКРУЖЕН МНОГИМИ БОКОВЫМИ ЦЕПЯМИ БЕЛКА
- •МОДЕЛИ АКТИВНОГО ЦЕНТРА ФЕРМЕНТА
- •МОДЕЛЬ «КЛЮЧ – ЗАМОК» (Г.Э.ФИШЕР)
- •ТЕОРИЯ
- •ТЕОРИЯ
- •Изменения структуры активного центра, вызванные субстратом, согласно модели «индуцированного соответствия» Д. Кошланда
- •ИНДУЦИРОВАННОЕ
- •1.ДО СВЯЗЫВАНИЯ С СУБСТРАТОМ ФЕРМЕНТ НАХОДИТСЯ В
- •ЭТАПЫ
- •Генри
- •В реальных системах ни субстрат, ни фермент не являются жесткими молекулами. При связывании
- •ТЕРМОДИНАМИЧЕСКАЯ СУЩНОСТЬ
- •Катализ приводит к ускорению достижения равновесия за счет снижения энергии активации (Еа), часто
- •Разложение перекиси водорода
- •МЕХАНИЗМ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ
- •ТИПЫ ВЗАИМОДЕЙСТВИЙ МЕЖДУ АКТИВНЫМ ЦЕНТРОМ ФЕРМЕНТА И СУБСТРАТОМ
- •Прямые доказательства существования фермент-
- •ВЫВОД УРАВНЕНИЯ
- •Леонор МИХАЭЛИС
- •Допущения:
- •ЗАВИСИМОСТЬ СКОРОСТИ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ СУБСТРАТА
- •РАССМОТРИМ ФЕРМЕНТАТИВНУЮ РЕАКЦИЮ
- •РАССМОТРИМ ПРИНЦИП ЗАКРЫТОСТИ
- •ВЫРАЗИМ [ES]
- •ОТНОШЕНИЯ КОНСТАНТ СКОРОСТЕЙ
- •ПОЛУЧИМ
- •УЧТЕМ, ЧТО
- •В ИТОГЕ ПОЛУЧИМ УРАВНЕНИЕ
- •Константа Михаэлиса измеряется
- •ЛИНЕЙНЫЕ
- •УРАВНЕНИЕ ЛАЙНУИВЕРА - БЕРКА
- •УРАВНЕНИЕ ЛЭНГМЮРА используется, если отклонения от линейности наблюдаются при высоких концентрациях субстрата
- •УРАВНЕНИЕ ИДИ - ХОФСТИ
- •Зависимость скорости ферментативной реакции (V) от температуры
- •Зависимость скорости ферментативной реакции (V) от рН среды.
- •Оптимальные значения рН для некоторых ферментов

В ИТОГЕ ПОЛУЧИМ УРАВНЕНИЕ
МИХАЭЛИСА – МЕНТЕН
V Vmax S
KM S
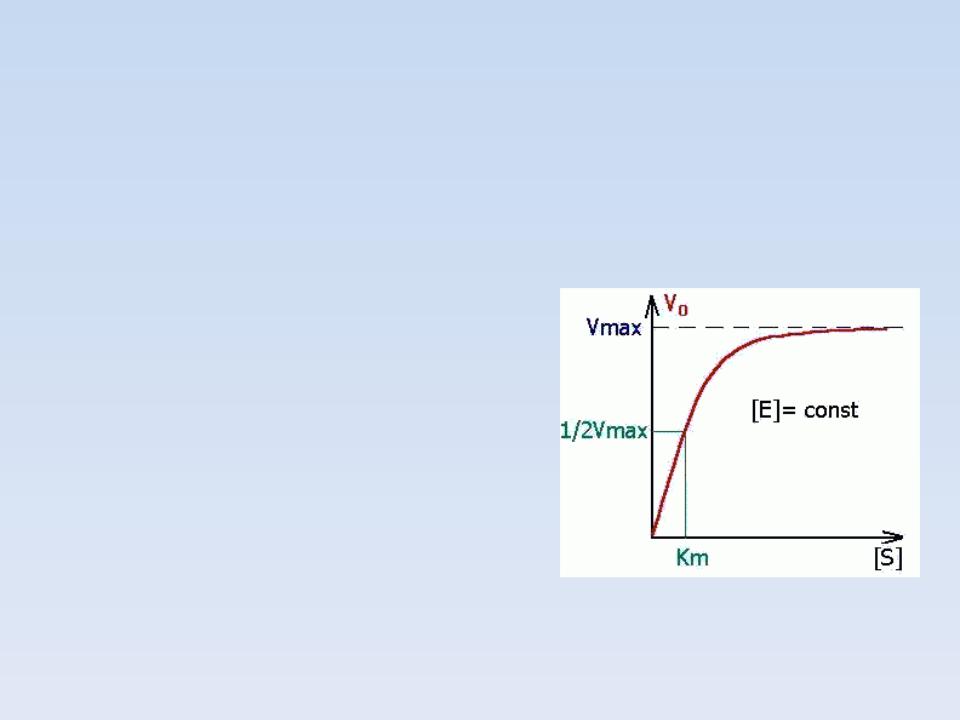
Константа Михаэлиса измеряется
в молях на литр и колеблется от
10-2 до 10-7 моль/л.
Чем меньше КМ, тем активнее
фермент.
При V=1/2Vmax, имеем КМ =
[S].
Однако определение Vmax и КМ затруднительно.
Для определения КМ и Vmax
используют прием линеаризации
уравнения Михаэлиса – Ментен.

ЛИНЕЙНЫЕ
ПРЕОБРАЗОВАНИЯ УРАВНЕНИЯ МИХАЭЛИСА
– МЕНТЕН
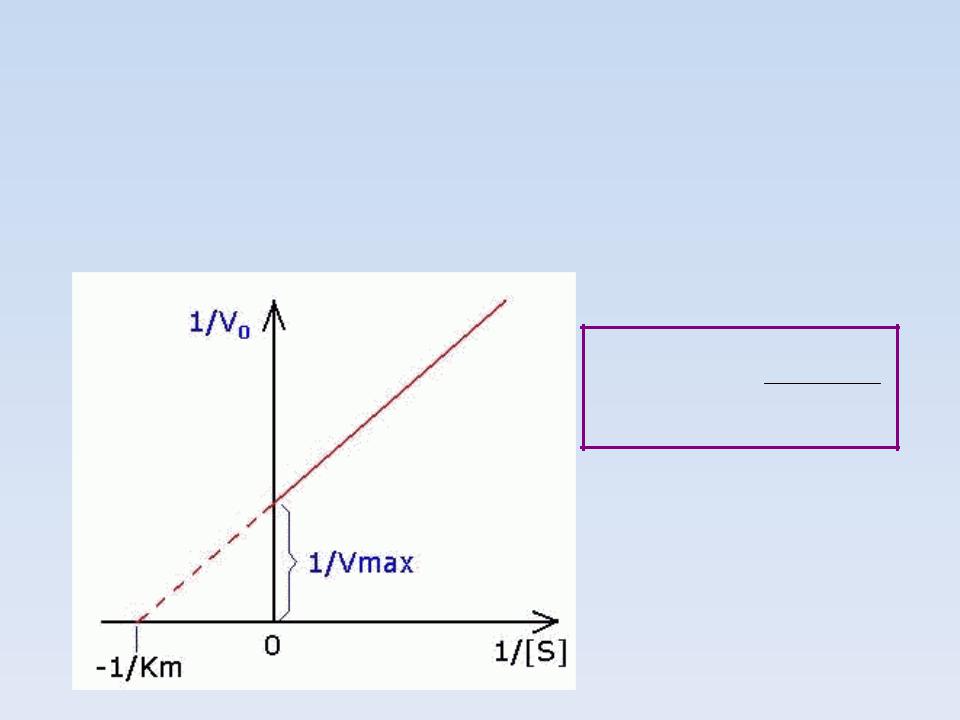
УРАВНЕНИЕ ЛАЙНУИВЕРА - БЕРКА
1 |
|
K |
1 |
1 |
|
||||
|
|
|
M |
|
|
|
|
|
|
V |
Vmax |
S |
|
Vmax |
|||||
tg KM
Vmax
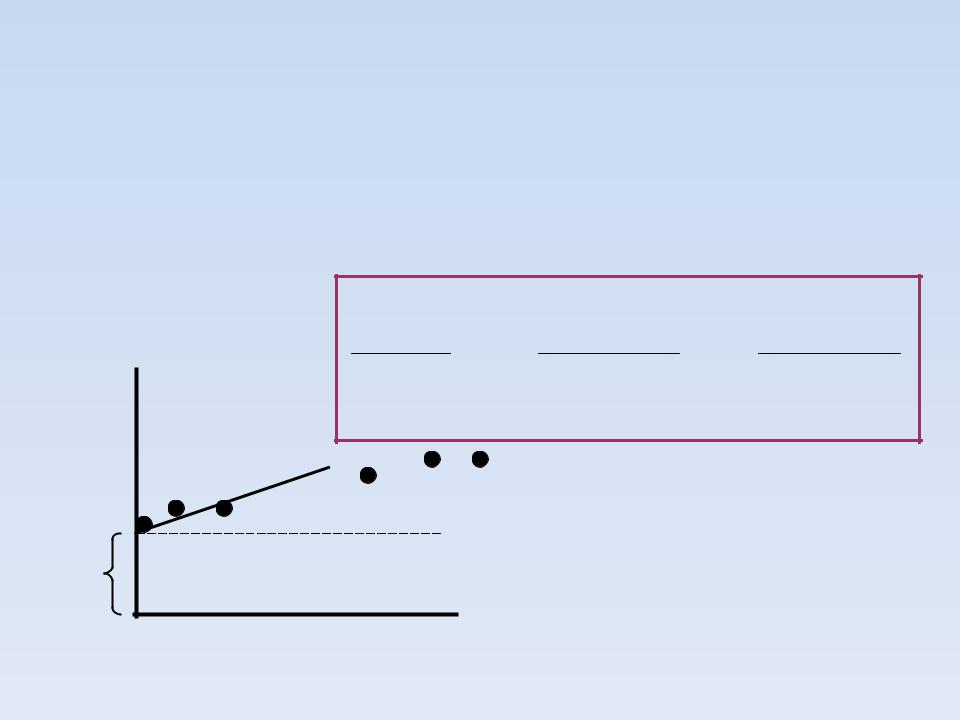
УРАВНЕНИЕ ЛЭНГМЮРА используется, если отклонения от линейности наблюдаются при высоких концентрациях субстрата
ПОЛУЧИМ, УМНОЖАЯ ОБЕ ЧАСТИ УРАВНЕНИЯ ЛАЙНУИВЕРА – БЕРКА НА [S]
[S]/V |
S |
S |
KM |
|
V |
Vmax |
Vmax |
|
|
а = KM/Vmax |
|
а |
|
tg = 1/Vmax |
|
|
|
||
|
[S] |
|
|
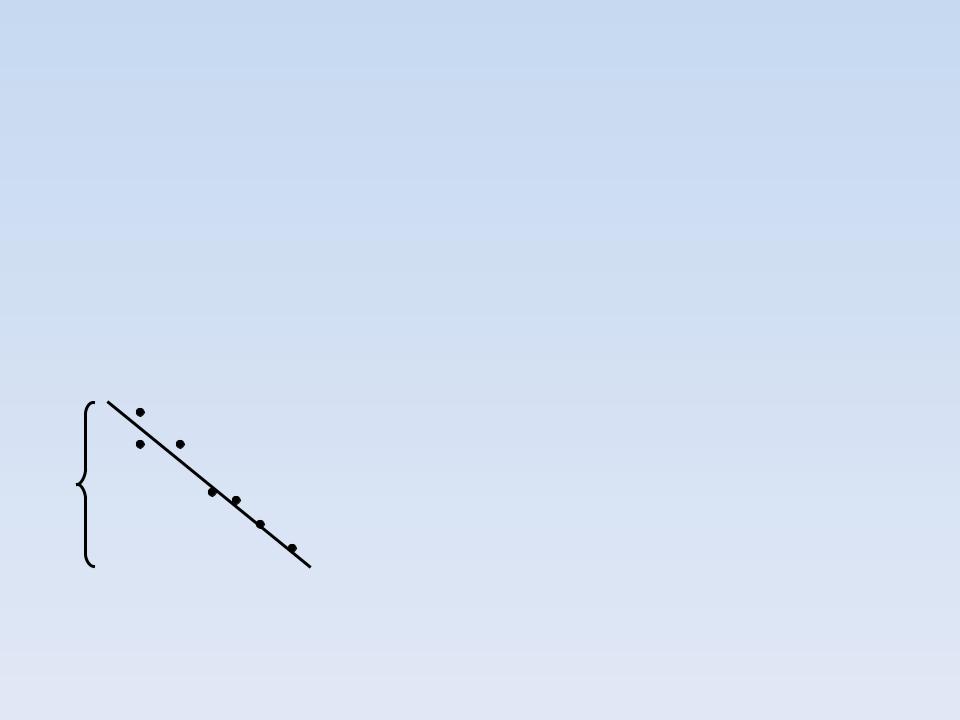
УРАВНЕНИЕ ИДИ - ХОФСТИ
ПОЛУЧИМ, УМНОЖАЯ ОБЕ ЧАСТИ УРАВНЕНИЯ ЛАЙНУИВЕРА – БЕРКА НА V VMAX
|
|
|
V |
|
|
1 |
|
|
K V V |
|
||
V |
|
|
S |
|
|
|
||||||
|
|
max |
|
|
|
|
|
M |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
V V |
|
|
1 |
K V |
|
||||
|
|
|
|
|
S |
|
||||||
a |
|
|
|
max |
|
|
|
M |
|
|||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V/[S]
a Vmax ;tg K M

Зависимость скорости ферментативной реакции (V) от температуры
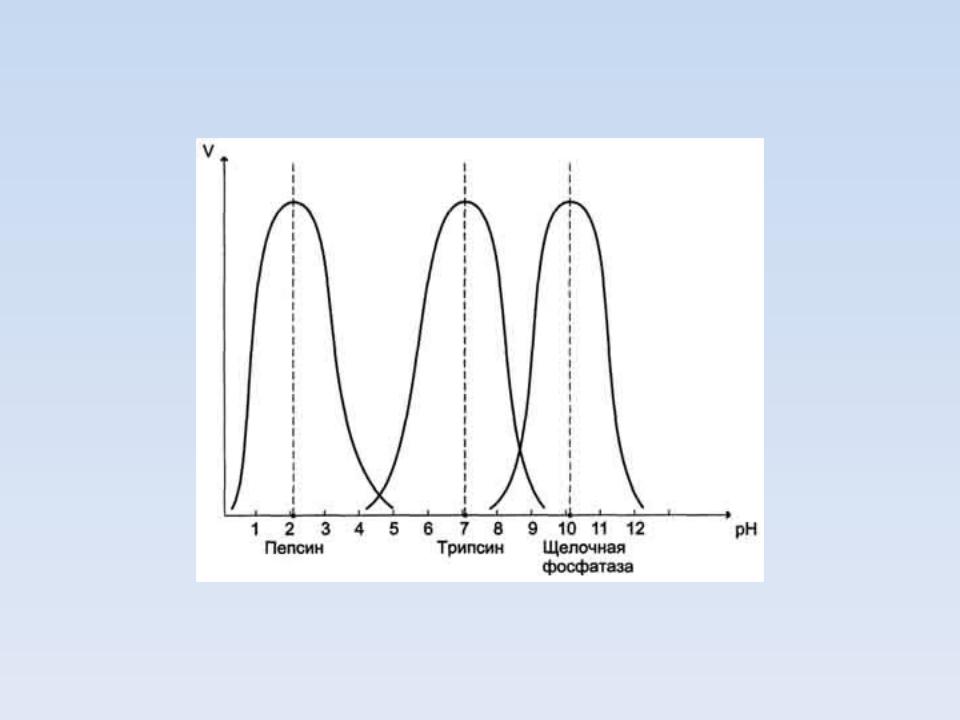
Зависимость скорости ферментативной реакции (V) от рН среды.

Оптимальные значения рН для некоторых ферментов
Фермент |
Оптимальное значение рН |
Пепсин |
1,5-2 |
Пируват-карбоксилаза |
4,8 |
Каталаза |
6,8-7 |
Фумараза |
6,5 |
Уреаза |
6,8-7,2 |
Кабоксипептидаза |
7,5 |
Трипсин |
6,5-7,5 |
Аргиназа |
9,5-9,9 |
