
Глава 6. Функции крови
К функциям крови относят: (1) перенос кислорода от легких к тканям и углекислого газа от тканей к легким (глава 8); (2) транспорт пластических (аминокислот, нуклеазидов, витаминов, минеральных веществ) и энергетических (глюкоза, жиры) ресурсов к тканям; (3) перенос конечных продуктов обмена к органам выделения (почкам, потовым железам, коже и др.); (4) участие в регуляции температуры тела (глава 11); (5) поддержание постоянства кислотно-щелочного состояния организма (глава 13); (6) обеспечение водно-солевого обмена между кровью и тканями (глава 12); (7) обеспечение иммунных реакций (глава 2), кровяного и тканевого барьеров против инфекции; (8) обеспечение гуморальной регуляции функций различных систем и тканей переносом к ним гормонов, биологически активных веществ; (9) секрецию клетками крови биологически активных веществ; (10) поддержание тканевого гомеостаза и регенерации тканей.
Цельная кровь состоит из жидкой части (плазмы) и форменных элементов крови, к которым относят эритроциты, лейкоциты и кровяные пластинки — тромбоциты. На долю форменных элементов крови приходится около 45 % ее общего объема, остальные 55 % составляет плазма. Отношение объема форменных элементов крови к объему плазмы называется "гематокритное число" или гематокрит. Физико- химические свойства цельной крови, компонентов плазмы и ее функции описаны в главе 2.
6.1. Функции эритроцитов
Функции и свойства эритроцитов. Функцией эритроцитов является перенос кислорода содержащимся в них гемоглобином от легких к тканям и углекислого газа от тканей к альвеолам легких. Выполнению этой задачи подчинены особенности организации эритроцита: он лишен ядра, 95 % его массы представлены гемоглобином, цитоскелет эритроцита обладает способностью к деформируемости, что позволяет ему многократно изменять форму, легко проникая через тонкие капилляры (имея диаметр от 8 до 7 мкм, он проникает через сосуды с диаметром меньше 3 мкм). Собственные потребности эритроцита в кислороде весьма малы. Глюкоза является основным источником энергии в этой клетке. Энергия, необходимая для восстановления формы деформированного в капилляре эритроцита, активного транспорта катионов через его мембрану, синтез глюкотатиона образуется в ходе анаэробного гликолиза по пути Эмбден-Мейергофа. В этом цикле расходуется 90% потребляемой эритроцитами глюкозы. Торможение гликолиза, уменьшающее в
200
клетке концентрацию АТФ, приводит к накоплению в ней ионов натрия и воды, ионов кальция, повреждению мембраны, что понижает механическую и осмотическую устойчивость эритроцита, ускоряет его разрушение. Энергия глюкозы в эритроците используется также в реакциях восстановления, зашишаюших компоненты эритроцита от окислительной денатурации. Благодаря этому, атомы железа гемоглобина поддерживаются в восстановленной форме, что препятствует превращению гемоглобина в метгемоглобин, неспособному к транспорту кислорода. Восстановление обеспечивается ферментом — метгемоглобинредуктазой. В восстановленном состоянии поддерживаются и серусодержащие группы, входящие в мембрану эритроцита, гемоглобин, ферменты, что сохраняет функциональные свойства этих структур. В ходе метаболизма по побочному пути гликолиза, контролируемого ферментом дифосфоглииератмутазой, образуется 2,3-дифосфоглииерат (2,3-ДФГ). Основное значение 2,3-ДФГ заключается в регуляции им сродства гемоглобина к кислороду.
Эритроциты имеют дисковидную, двояковогнутую форму, их объем достигает 85-90 мкм3, а поверхность — около 145 мкм2. Такое соотношение плошади к объему благоприятствует деформируемости эритроцитов. Уменьшение отношения поверхность/объем эритроцита, наблюдаемое при увеличении объема эритроцита, приобретении им сферичной формы при избыточном поступлении в эритроцит воды, делает его менее деформируемым. Это ведет к быстрому разрушению эритроцита. Большую роль в поддержании формы и деформируемости эритроцитов играют липиды их мембран, которые представлены фосфолипидами (глииерофосфолипидами, сфинголипидами), гликолипидами, холестерином. Увеличение соотношения холестерин-фосфолипиды в мембране увеличивают ее вязкость, уменьшает текучесть и эластичность мембраны. В результате снижается деформируемость эритроцита. Усиление окисления ненасыщенных жирных кислот фосфолипидов мембраны перекисью водорода (Н2О2) или супероксидными радикалами (О2) вызывает гемолиз эритроцитов (разрушение эритроцитов с выходом гемоглобина в окружающую среду), повреждение молекулы гемоглобина эритроцита. Образующийся в эритроците глютатион, а также антиоксиданты (а-токоферол и др.) защищают компоненты эритроцита от данного повреждения.
До 52% массы мембраны эритроцитов составляют белки. Среди них гликопротеины, в т.ч. формирующие вместе с олигосахаридами антигены групп крови — М, N, S, Kell. Гликопротеины мембраны содержат сиаловую кислоту, обеспечивающую эритроциту электронегативный заряд, отталкивающий эритроциты друг от друга. Спектрин и анкирин — белки цитоскелета, играющие важную роль в поддержании формы эритроцита.
Энзимы мембраны — Na+ K+-зависимая АТФ-аза обеспечивают активный транспорт Na+ из эритроцита и К+ в его цитоплазму. Са++-зависимая АТФ-аза обеспечивает выведение Са++ из эритроцита. Содержащийся в эритроците фермент — карбоангидраза катализирует реакцию синтеза угольной кислоты из воды и углекислого газа, после чего эритроцит транспортирует ее в виде бикарбоната к легким.
201
Гемоглобин. Гемоглобин — это хемопротеин, окрашивающий эритроцит в красный цвет после присоединения к содержащемуся в нем железу (Fe++) молекулы кислорода. У мужчин в 1 дкл содержится 14,5±1,5 г гемоглобина, у женщин — 13,0±1,5 г. Молекулярная масса гемоглобина составляет около 60 000. Его молекула состоит их четырех субъединиц, каждая из которых представлена ге-мом (содержащим железо производным порфирина), связанным с белковой частью молекулы — глобином. Глобин представлен двумя а- и двумя В- полипептидными цепями. Синтез гема протекает в митохондриях эритробластов, первым этапом которого является синтез а-амино- В- кетоадипиновой кислоты из глицина и сукцинил Коэнзима А (рис.6.1.). Синтез цепей глобина идет на полирибосомах и контролируется генами 11 и 16 хромосом. У взрослого человека глобин состоит из двух а- и двух В- полипептидных цепей. Гемоглобин, содержащий две а- и две В-цепи, называется А тип (от adult — взрослый). Он составляет основную часть нормального гемоглобина взрослого человека. В крови плода человека содержится гемоглобин типа F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В.
Гемоглобин обладает способностью обратимо присоединять кислород. 1 г гемоглобина связывает 1,34 мл кислорода. Соединения гемоглобина с молекулой кислорода называется оксигемоглобин. Сродство гемоглобина к кислороду выражают парциальным давлением кислорода, при котором гемоглобин насыщен кислородом на 50% (Р50). Молекулярный кислород обладает высоким сродством к гемоглобину. Однако, и другие соединения могут фиксироваться на его молекуле, ослабляя связь кислорода с гемоглобином. Поэтому сродство гемоглобина к кислороду и диссоциация оксигемоглобина (т.е. отсоединение молекулы кислорода от гемоглобина) зависят от напряжения кислорода, угольной кислоты в крови, концентрации протонов водорода (рН крови) и ее температуры, концентрации 2,3-дифосфоглицерата в эритроцитах. Изменение величин этих факторов (например, повышение рО2 или снижение рСО2 в крови, нарушение образования 2,3-дифосфоглицерата в эритроцитах) снижают скорость отдачи кислорода гемоглобином. Напротив, увеличение внутриклеточной концентрации 2,3-дифосфоглицерата, снижение рО2 крови, сдвиг рН в кислую сторону — уменьшают сродство гемоглобина к кислороду, тем самым облегчая отдачу его тканям. Увеличение концентрации 2,3-дифосфоглицерата наблюдается у лиц, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах.
Оксигемоглобин, отдавший кислород, называется восстановленным или дезоксигемоглобином. До 10-30% СО2 образует карбаминовое соединение с радикалом NH, глобина и в форме кабаминового соединения транспортируется от тканей к легким.
В первые 3 месяца жизни плода человека у него представлены эмбриональные гемоглобины, молекула глобина которых имеет отличный от гемоглобина А состав полипептидных цепей. Это гемоглобин типа Gower 1 (4эпсилон цепи) и Gower II (2а и 2 эпсилон
202

Рис.6.1. Схема синтеза гемоглобина у человека.
цепи). В последующем формируется гемоглобин F, молекула глобина которого состоит из 2а и 2у цепей. При рождении ребенка до 50-80% гемоглобина у него представлены типом F и 15-40% —типом А, а к 3 годам уровень гемоглобина F снижается до 2%. Гемоглобин F обладает большим сродством к кислороду, чем гемоглобин А, 2,3-ДФГ также меньше влияет на соединение гемоглобина F с кислородом. Поэтому гемоглобин F переносит на 20-30% больше кислорода, чем тип А, что способствует лучшему выполнению его функции — снабжению плода кислородом.
Старение и разрушение эритроцитов в организме. Максимальная продолжительность жизни эритроцитов достигает 120 дней, средняя — 60-90 дней. Старение эритроцитов сопровождается уменьше-
203
нием образования в них количества АТФ в ходе метаболизма глюкозы. Это нарушает требующие энергии процессы восстановления формы эритроцитов, транспорта катионов, защиты компонентов эритроцитов от окисления. Эритроциты становятся менее эластичны, их мембрана теряет сиаловые кислоты, в результате чего, они или разрушаются внутри сосудов (внутрисосудистый гемолиз- 20%), или же становятся добычей захватывающих и разрушающих их макрофагов селезенки, купферовских клеток печени и макрофагов костного мозга (внесосудистый или внутриклеточный гемолиз-80%). В ходе внутриклеточного гемолиза каждый день разрушается 6- 7 г гемоглобина, освобождая в макрофаги до 30 мг железа. После отщепления от гемоглобина гем превращается в желчный пигмент — билирубин, поступает с желчью в кишечник, и в виде стеркобилина и уробилина выводится с калом и мочой. При метаболизме 1 г гемоглобина образуется 33 мг билирубина.
При внутрисосудистом гемолизе разрушается 10-20 % эритроцитов. Их гемоглобин освобождается непосредственно в плазму, в которой он связывается плазменным белком — гаптоглобином. Это гликопротеин, при электрофорезе белков мигрирующий с а2- глобулином. Половина количества образовавшегося комплекса — гемоглобин-гаптоглобин уже за 10 минут покидает плазму и поглощается паренхиматозными клетками печени, что предупреждает поступление свободного гемоглобина в почки. У здорового человека в плазме содержится около 1 г/л плазмы гаптоглобина и 3-10 мг гемоглобина.
Обмен железа в организме. Из 4- 5 г железа, содержащегося в организме, 1/4 составляет резервное железо, а остальное — функционально активно. Из этого количества в состав гемоглобина эритроцитов входит 62-70%, 5-10% содержится в миоглобине, остальное — в тканях, где оно участвует во многих метаболических процессах: в составе металлосодержаших энзимов обеспечивает мито-хондриальный транспорт электронов, синтез ДНК и деление клеток, метаболизм катехоламинов (гормонов мозгового вещества надпочечников), детоксикационные механизмы, т.е. снижающие активность токсических веществ, поддерживая, в частности, концентрацию ци-тохрома Р450. Поэтому дефицит железа в организме человека понижает его физическую активность и работоспособность.
В организме человека происходит интенсивный обмен железа, оно постоянно перемещается из мест его накопления к местам использования и обратно. Так, эритропоэз ежесуточно требует от 20 до 25 мг железа. Почти все это количество железа костный мозг получает за счет его повторного использования. Только около 1 мкг железа вновь ежедневно всасывается в кишечнике, пополняя потери с калом, мочой, потом и слущиванием кожи. У молодых женщин потери железа больше (менструация, беременность). Fe++ поступает в эритробласты с белком плазмы — трансферрином, гликопротеином (MB 76000), мигрирующим при электрофорезе белков плазмы вместе с В1- глобулинами. Плазма содержит от 1,8 до 2,6 мг/л трансфер-
204
рина. Поскольку 1 мг белка связывает 1,25 мкг Fe++, то в общем объеме плазмы содержится около 3 мг железа. В норме лишь 1/3 трансферрина плазмы насыщена железом. Дополнительное количество железа, которое может связываться с ненасыщенным железом трансферрином плазмы, определяет ненасыщенную железосвязыва-ющую способность крови. Общее количество железа, которое может быть связано трансферрином, называется общей железосвязывающей способностью крови (ОЖСК). Концентрация железа в плазме достигает у мужчин 120 мг%, у женщин — 80 мг%. ОЖСК нормальной сыворотки крови составляет 290-380 мг%, с мочой выводится за сутки 60-100 мкг железа.
Комплекс трансферрин-железо фиксируется на рецепторах мембраны эритробласта, количество рецепторов уменьшается в ходе созревания эритроидных клеток, исчезая после созревания ретикуло-цитов. Поэтому зрелый эритроцит не включает железо. Освобождение железа из комплекса трансферрин-железо обеспечивается энергией АТФ. Молекула трансферрина, отдавшая железо, смещается с мембранного участка молекулами трансферрина, связанными с железом, поскольку их сродство к рецепторам более сильное. Железо, поступившее в эритробласт, используется в митохондриях для синтеза гема и депонируется в эритробласте в виде резерва. В макрофагах печени, костного мозга резервное железо депонируется в молекуле ферритина, состоящей из 24 единиц белка апоферритина, образующих подобие скорлупы, в центре которой аккумулируется железо. Молекулы ферритина, в свою очередь, образуют внутри лизосом большие аморфные нерастворимые агрегаты — гемосидерин. Таким образом, ферритин и гемосидерин — это формы резервного железа в клетках. При освобождении железа из клеточного резерва оно переводится в двухвалентное состояние (благодаря энзиму ксан-тиноксидазе, аскорбиновой кислоте и др.), соединяется с трансферрином и транспортируется к эритробластам.
Абсорбция железа эпителиальными клетками желудочно-кишечного тракта усиливается при увеличении концентрации трансферрина в слизистой кишечника, эритропоэтической активности костного мозга и снижается при увеличении концентрации железа в клетках слизистой оболочки кишечника. Абсорбция Fe++ в кишечнике более эффективна, чем Fe+++ и вещества, поддерживающие двухвалентную форму железа, его растворимость — аскорбиновая кислота, фруктоза, аминокислоты (цистеин, метионин), ускоряют абсорбцию железа. Важным условием абсорбции железа в кишечнике является его биодоступность. Например, железо, входящее в состав гема (мясные продукты, кровяная колбаса) лучше всасывается в кишечнике, чем железо из пищи растительного происхождения.
Роль витаминов и микроэлементов в кроветворении. Для нормального метаболизма кроветворная ткань нуждается в поступлении в костный мозг ряда вешеств. Витамин В12 и фолиевая кислота необходимы для синтеза нуклеопротеинов, созревания и деления ядер клеток. При их дефиците в наиболее интенсивно делящейся ткани
2ft!
организма — эритроидной, раньше, чем в других, возникают нарушения, выражающиеся в развитии анемии. Она связана с формированием в костном мозге огромных ядросодержаших эритроидных клеток — мегалобластов с замедленной скоростью созревания. Образующиеся из них большие эритроциты — мегалоциты обладают резко укороченным периодом жизни. Вследствие указанных нарушений — замедленного поступления эритроцитов в кровь и быстрого их разрушения в ней, возникает анемия. Это заболевание эффективно излечивается введением витамина В12. Причина дефицита В12 в организме связана с утратой способности париетальных клеток желудка продуцировать "внутренний фактор" — гликопротеин (MB 60000), который, связывая витамин В,,, поступающий с пищей, предохраняет его от расщепления пищеварительными ферментами. Эти нарушения возникают при атрофии слизистой желудка, часто наблюдающейся, например, у стариков (глава 20). И хотя запаса витамина В12 в печени хватает взрослому человеку на 1-5 лет, постепенное его истощение приводит к заболеванию.
Витамин В12 содержится в больших количествах в таких продуктах питания, как печень, почки, яйца. Ежесуточная потребность организма в витамине В12 достигает 5 микрограмм, содержание в плазме крови — 150-450 микрограмм/л. Поступив в кишечник, комплекс гликопротеин- В12 фиксируется специальными рецепторами слизистой тонкого кишечника и витамин поступает в интестинальные клетки, и далее — в кровь, в которой с помощью особых транспортирующих молекул — транскобаламинов (1, II и III типов) переносятся к печени и костному мозгу. Транскобаламины I и III типа продуцируются лейкоцитами, II — макрофагами. Поэтому при гиперлейкоцитозе отмечается гипервитаминоз В12.
Фолиевая кислота (витамин В9) поддерживает синтез ДНК в клетках костного мозга благодаря обеспечению этого процесса одним из нуклеотидов — диокситимидилатом, образующимся в результате митилирования диоксиуридиловой кислоты в присутствии тетрагидрофолата (одной из редуцированных форм фолиевой кислоты). Ежедневная нормальная потребность организма человека в фолиевой кислоте составляет 500-700 мгр. Ее резерв в организме равен 5- 10 мг, причем треть его находится в печени. Недостаточное поступление фолиевой кислоты с пищей уже через несколько месяцев вызывает анемию, связанную с ускоренным разрушением эритроцитов. Фолиевой кислотой богаты овощи (шпинат), дрожжи, молоко.
Витамин В6 (пиридоксин) является кофактором (т.е. дополнительным фактором активности) АЛК-синтетазы (рис.6.1.), участвующей в образовании гема в эритробластах, и его дефицит вызывает анемию вследствие нарушенного гемоглобинопоэза.
Витамин С поддерживает основные этапы эритропоэза, способствуя метаболизму фолиевой кислоты в эритробластах. Он участвует в метаболизме железа как на уровне его абсорбции в желудочно-кишечном тракте, так и мобилизациии депонированного в клетках железа.
206
Витамин Е (а-токоферол) осуществляет защиту фосфатиди-лэтаноламина мембран эритроцитов от перекисного окисления, усиливающего гемолиз эритроцитов.
Защиту гемоглобина и мембраны эритроцитов от окисления осуществляет и витамин РР, являющийся одним из составляющих пиридиннуклеотидов НАД и НАДФ.
Дефицит витамина В2, участвующего в окислительно-восстановительных реакциях, вызывает у человека анемию гипорегенера-тивного типа.
В метаболизме гемопоэтической ткани участвуют микроэлементы: медь, обеспечивающая лучшее всасывание железа в кишечнике и мобилизацию его резерва из печени и ретикулярных клеток; никель и кобальт, имеющие отношение к синтезу гемоглобина и гемсодер-жаших молекул, способствующих утилизации железа. Их недостаток вызывает анемию (например, в районах, где почвы бедны этими микроэлементами). Селен, тесно воздействуя с витамином Е, защищает мембрану эритроцита от повреждения свободными радикалами. Почти 75% всего цинка в организме человека находится в эритроцитах, в составе фермента карбоангидразы. Недостаток цинка вызывает лейкопению.
Эритропоэз. Под эритропоэзом понимают процесс образования эритроцитов в костном мозге. Первой морфологически распознаваемой клеткой эритроидного ряда, образующейся из колониеобразую-щей единицы эритроцитарной (КОЕ-Э) — клетки-предшественницы эритроидного ряда, является проэритробласт, из которого в ходе 4-5 последующих удвоений и созревания образуется 16-32 зрелых эритроидных клеток (например, 1 проэритробласт: (удвоение) — 2 базофильных эритробласта I порядка: 4 базофильных эритробласта II поряда: 8 полихроматофильных эритробластов I порядка: 16 поли-хроматофильных эритробластов II порядка: 32 полихроматофильных нормобласта -> 32 оксифильных нормобласта -> денуклеация нор-мобластов -> 32 ретикулоцита -> 32 эритроцита). Эритропоэз в костном мозге (до формирования ретикулоцита) занимает 5 дней.
В костном мозге человека и животных эритропоэз (от проэритроб-ласта до ретикулоцита) протекает при взаимодействии эритроидных клеток с макрофагами костного мозга. Эти клеточные ассоциации получили название эритробластических островков (ЭО) (рис.6.2.). У здоровых людей в костном мозге содержится до 137 ЭО на мкг ткани, при угнетении же эритропоэза их количество может уменьшаться в несколько раз, а при стимуляции —увеличиваться. Макрофаги ЭО играют важную роль в физиологии эритроидных клеток, влияя на их размножение (пролиферацию) и созревание за счет: 1) фагоцитоза вытолкнутых из нормобластов ядер; 2) поступления из макрофага в эритробласты с помощью пиноцитоза ферритина, других пластических веществ, необходимых для развития эритроидных клеток; 3) секреции эритропоэтинактивных веществ; 4) высокого сродства к эритроидным клеткам-предшественницам, позволяющим макрофагам создавать благоприятные условиях для развития эритробластов.
207
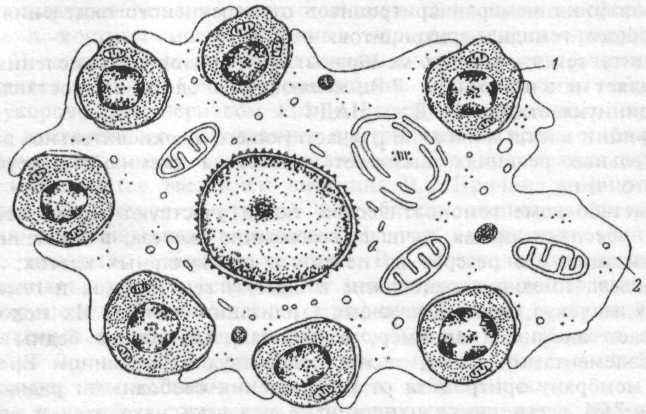
Рис.6.2. Эритробластический островок костного мозга человека.
1 — эритробласт, 2 — цитоплазма макрофага.
Из костного мозга в кровь поступают ретикулоциты, в течение суток созревающие в эритроциты. Поэтому количество ретикулоци-тов в крови отражает эритроцитарную продукцию костным мозгом, и по их количеству в крови судят об интенсивности эритропоэза. У человека их количество составляет 5- 10 %. За сутки в 1 мкл крови поступает 60-80 тыс.эритроцитов. В 1 мкл крови у мужчин содержится 5+0,5 млн, а у женщин — 4,5±0,5 млн эритроцитов.
Регуляция эритропоэза. Гуморальным регулятором эритропоэза является гормон эритропоэтин. Основным источником его у человека являются почки, их перитубулярные клетки — в них образуется до 85-90 % гормона, остальное количество вырабатывается в макрофагах (купферовские клетки и др.). Синтез и секреция эритроло-этина определяется уровнем оксигенации почек. Структурой почек, чувствительной к гипокисии, является гемсодержащий белок пери-тубулярных клеток, связывающий молекулу кислорода. При достаточной оксигенации почек оксиформа гемопротеина блокирует ген, регулирующий синтез эритропоэтина. В отсутствии кислорода деок-сиформа гемопротеина прекращает тормозить синтез эритропоэтина. При дефиците кислорода в почечных структурах активируются чувствительные к гипоксии ферменты. Например, фосфолипаза А2 ответственная за синтез простагландинов, в т.ч. Е1 и Е2-, активирующих аденилатциклазу и вызывающих рост концентрации цАМФ в перитубулярных клетках почек, синтезирующих эритропоэтин. Лак-
208
тан, адреналин, норадреналин, взаимодействующие с В2-адреноре-цепторами почек, также активируют аденилатциклазную систему, при этом нарастает концентрация цАМФ и цГМФ, вызывающих усиление синтеза и секрецию эритропоэтина в кровь. Так, продукцию эритропоэтина стимулирует пребывание человека в горах, где рО2 в атмосферном воздухе снижено; кровопотеря, уменьшающая кислородную емкость крови и т.д. У человека количество эритропоэтина составляет 0,01-0,08 МЕ/мл плазмы, но при гипоксии оно может возрастать в 1000 и более раз. Существует взаимосвязь между величиной гематокрита и уровнем эритропоэтина в плазме. При гематокрите, равном 40-45, количество эритропоэтина составляет 5-80 милиЕД/мл, а при гематокрите равном 10-20 — 1-8 ЕД/мл плазмы. Эритропоэтин усиливает пролиферацию клеток-предшественниц эритроидного ряда — КОЕ-Э, а также всех способных к делению эритробластов и ускоряет синтез гемоглобина во всех эрит-роидных клетках, включая ретикулоциты. Эритропоэтин "запускает" в чувствительных к нему клетках синтез иРНК, необходимых для образования энзимов, участвующих в формировании гема и глобина. Гормон увеличивает также кровоток в сосудах, окружающих эритро-поэтическую ткань в костном мозге, и увеличивает выход в кровь ретикулоцитов из его синусоидов.
Торможение эритропоэза вызывают особые вещества — ингибиторы эритропоэза, образующиеся при увеличении массы циркулирующих эритроцитов, несоответствующей потребностям тканей в кислороде. Они обнаруживаются, например, в крови у спустившихся с гор людей. Ингибиторы эритропоэза удлиняют цикл деления эрит-роидных клеток, тормозят в них синтез гемоглобина.
Эритропоэз активируют увеличивающие чувствительность ткани костного мозга к эритропоэтину мужские половые гормоны — андрогены. Стимулирующее влияние оказывают не сами андрогены, а продукты их 5-В- редуктазного превращения — 5-В- Н- метаболиты. Женские половые гормоны — эстрогены обладают противоположным действием на эритропоэз. После полового созревания устанавливающиеся различия в содержании эритроцитов и гемоглобина с более высокими их значениями у мужчин, чем у женщин, связаны с указанным эффектом половых гормонов. Катехоламины, взаимодействуя с В-адренорецеп-торами КОЕ-Э, усиливают пролиферацию этих эритроидных клеток- предшественниц.
Группы крови. Мембрана эритроцитов человека является носителем более 300 антигенов, обладающих способностью вызывать против себя образование иммунных антител. Часть этих антигенов объединена в 20 генетически контролируемых систем групп крови (АВО, Rh- Нг, Дафи, М, N, S, Леви, Диего). Система антигенов эритроцитов АВО отличается от других групп крови тем, что содержит в сыворотке крови естественные анти-А (а) и анти-В (В) антитела — агглютинины. Ее генетический локус расположен в длинном плече 9-й хромосомы и представлен генами Н, А, В и 0.
209
Гены А, В, Н контролируют синтез ферментов — гликолизилтран-сферраз, которые и формируют особые моносахариды, создающие антигенную специфичность мембраны эритроцита — А, В, и Н. Их образование начинается на самых ранних стадиях формирования эрит-роидных клеток. Антигены А, В, и Н под влиянием ферментов образуются из общего вещества — предшественника — церамид-пента-сахарида, состоящего из 4 Сахаров — N-ацетилгалактозамина, N-ацетилглюкозамина, L-фрукозы и Д-галактозы. Вначале ген Н через контролируемый им энзим формирует из данного предшественника антиген "Н" эритроцитов. Этот антиген, в свою очередь, служит исходным материалом для формирования антигенов А и В эритроцитов, т.е. каждый из генов А и В через активность контролируемого ими энзима формирует из Н- антигена антигены А или В.
Ген "О" не контролирует трансферазу и "Н" антиген остается неизмененным, формируя группу крови 0(1). У 20% людей, имеющих антиген А, обнаружены антигенные отличия, формирующие антигены А1 и А2. Антитела не вырабатываются против "своего", т.е. присутствующих в эритроцитах антигенов — А, В и Н. Однако, антигены А и В широко распространены в животном мире, поэтому после рождения человека в его организме начинается формирование антител против антигенов А, А1 А2 и В, поступающих с пищей, бактериями. В результате в их плазме появляются анти-А (а) и анти- В (В) антитела.
Максимум продукции анти-А (а) и анти-В (В) антител падает на 8-10 летний возраст. При этом содержание в крови анти-А (а) всегда выше анти-В (В). Эти антитела называются изоантителами
Таблица 6.1. Группы крови системы АВО
|
Ген |
Антигены на мембране эритроцита |
Антитела (в плазме крови) |
Группа крови системы АВО |
|
Н(О) |
Н |
Анти-А(а) + Анти-А2(а2) + Анти-В(В) |
КО) |
|
А1 |
А1 |
Анти-В(В) |
II (А1) |
|
А2 |
А2+Н |
Анти-А1 (а1) у 1% обследуемых + Анти-В(B) |
II (А2) |
|
В |
В |
Анти-А(a) + Анти-А1 (а1) |
III (В) |
|
А1 , В |
А1 + В |
Отсутствуют |
IV (А1 ,B ) |
|
А2,В |
А2+В |
Анти-А1 (a1) у 25 % обследуемых |
IV (А2,В) |
или агглютининами, поскольку они вызывают склеивание {агглютинацию) эритроцитов, содержащих на мембране соответствующие антигены (агглютиногены). Характеристика системы АВО представлена в таблице 6.1.
Антитела аиВ представлены в плазме крови иммуноглобулином М и иммуноглобулином G. Они не только склеивают эритроциты,
210
|
Группа крови исследуемых |
Антитела (антисыворотки), добавляемые к исследуемым эритроцитам |
||
|
|
Анти-А(а) |
|
Анти-В(B) |
|
0(I) |
- |
- |
|
|
А(II ) |
+ |
- |
|
|
0(III) |
- |
+ |
|
|
А,В (IV) |
+ |
+ |
|
|
(-) — агглютинация |
отсутствует; (+) - |
- агглютинация эритроцитов |
|
но и вызывают их гемолиз (иммуноглобулины G могут связывать комплемент, вызывая гемолиз; иммуноглобулины М — гемолизины). Поэтому при несовместимости групп крови донора (т.е. человека, у которого берут кровь для переливания) и реципиента (которому переливают кровь) возникает гемоконфликт, вызванный агглютинацией и гемолизом эритроцитов, сопровождающийся тяжелейшими осложнениями, заканчивающимися гибелью реципиента. Из сказанного следует необходимость определения группы крови человека перед переливанием ему крови.
Группу крови определяют, добавляя к ней антисыворотки или моноклональные антитела против антигенов эритроцитов. Для исключения гемоконфликтов необходимо переливать человеку лишь одногруппную кровь.
Синтез Rh- H2 антигенов эритроцитов контролируется генными локусами короткого плеча 1-й хромосомы. Rh-антигены представлены на мембране эритроцитов тремя связанными участками: антигенами С (Rh') или с (Н'2), Е (Rh") или е (НII2) и Д (Rh°) или d. Человек, имеющий "С"-антиген на мембране эритроцита не имеет "с"-антигена, у имеющего "Е" в эритроците отсутствует "е". Из этих антигенов лишь Д является сильным антигеном, т.е. способным иммунизировать не имеющего его человека. Все люди, имеющие Д-антиген называются "резус-положительными" (Rh+), а не имеющие его —"резус-отрицательными" (Rh-). Среди европейцев 85% людей — резус-положительные, остальные — резус-отрицательные. У некоторых народов, например, эвенов, отмечается 100% Rh+ принадлежность.
При переливании крови резус-положительного донора резус-отрицательном реципиенту у последнего образуются иммунные антитела (анти-Д). Поэтому, повторное переливание резус-положительной крови может вызвать гемоконфликт. Подобная же ситуация возникает, если резус-отрицательная женщина беременна резус-положительным плодом, наследующим резус-положительную принадлежность от отца. Во время родов эритроциты плода поступают в кровь матери и иммунизируют ее организм (вырабатываются анти-Д-антитела). Так, уже 0,25 мл плацентарной крови иммунизируют организм матери, что наблюдается у 20% резус-отрицательных матерей. Таким
211
же осложнением грозят акушерские вмешательства (ручное отделение плаценты, наружный поворот за ножку, аборты). При последующих беременностях резус-положительным плодом анти-Д- антитела проникают через плацентарный барьер, повреждают ткани и эритроциты плода, вызывая выкидыш, а при рождении ребенка — резусную болезнь, характеризующуюся тяжелой гемолитической анемией. Для предупреждения иммунизации резус-отрицательной женщины Д-антигенами плода во время родов, при абортах ей вводят концентрированные анти-Д-антитела. Они агглютинируют резус-положительные эритроциты плода, поступающие в ее организм, и иммунизации не наступает. Хотя остальные резусные антигены в иммунном отношении слабее Д-антигенов, однако и они при их значительном поступлении в организм резус-положительного человека, могут вызвать антигенные реакции.
