
- •37.Стандартні показники пожежо- та вибухонебезпечності.Пожежна небезпека - це можливість виникнення або швидкого розвитку пожежі, яка криється в речовині, стані або процесі.
- •51.Нормальна, масова і видима швидкість поширення полум’я при кінетичному горінні газових сумішей.
- •78. Розрахунок концентрації пари рідини в повітрі. Нкмпп та вкмпп.
- •79. Особливості розвитку пожеж класу а на відкритих просторах.
- •123. Перша з них - це негорючі речовини і матеріали, тобто не здатні горіти у повітрі.
51.Нормальна, масова і видима швидкість поширення полум’я при кінетичному горінні газових сумішей.
НОРМАЛЬНА
ШВИДКІСТЬ ПОШИРЕННЯ ПОЛУМ’Я – швидкість
переміщення фронту полум’я відносно
незгорілого газу в напрямку,
перпендикулярному до його поверхні.
масовою
швидкістю, обумовленої як кількість
згорілої речовини в грамах на одиницю
площі перетину заряду за одиницю часу
(г/см 2-з).
52.Мономери і полімери. Процеси полімеризації і поліконденсації. Тримірні (зшиті) структури. Мономе́р структурна ланка полімера, низькомолекулярна хімічна сполука, яка є первісним матеріалом для синтезу полімерів. Мономерами служать сполуки, що мають кратні зв’язки, циклічні групи та сполуки з різними функційними групами.
При хімічному позначенні полімера хімічна формула мономера береться в квадратні дужки, до яких добавляється індекс n. Наприклад, поліетилен позначається [-CH2-CH2-]n.
Полімери можуть скаладатися із мономерів одного типу, або різних типів. В останньому випадку вони називаються кополімерами.Полімери, що складаються з відносно невеликого, точно визначеного числа мономерів, називаються олігомерами. Для дуже малих олігоменів вживаютьсяназви димер, тример тощо.Мономерами білків є амінокислоти. З мономерів складаються вуглеводи, ліпіди, білки, вітаміни.Полімер —природні та штучні сполуки, молекули яких складаються з великого числа повторюваних однакових або різних за будовою атомних груповань, з'єднаних між собою хімічними або координаційними зв'язками в довгі лінійні або розгалужені ланцюги. Структурні одиниці, з яких складаються полімери називаються мономерами.
Реа́кція полімериза́ції кількох молекул в одну без зміни елементарного складу вихідних речовин.
Полімеризація — утворення високомолекулярних сполук (полімерів) з низькомолекулярних сполук (мономерів). Утворений полімер має такий же елементний склад, як і вихідна речовина (мономер).Продукт полімеризації двох молекул називають димером, трьох — тримером, а багатьох — полімером. Вихідну речовину, з якої одержують полімер, називають мономером.
Поліконденсація (рос. поликонденсация, англ. сondensation polymerization, нім. Kondensationsreaktion f) — ступінчастий процес утворення макромолекул шляхом взаємодії реакційних центрів усіх реагентів системи, яка включає бі- або поліфункціональні з'єднання. Зростання макромолекул відбувається шляхом хімічної взаємодії функціональних груп молекул мономерів одна з одною і з n-мерами, які накопичуються в ході реакції, а також молекул n-мерів між собою.Загальну схему поліконденсації можна представити у вигляді:
![]() ,
,
де Мn1, Мn2 — олігомери або макромолекули, які містять в ланцюгу n1 або n2 мономерних залишків.
53.Складання стехіометричних рівнянь процесу горіння речовин. Приклади рівнянь горіння сірковмісних сполук.Основний стехіометричний закон – координата хімічної реакції для кожної з реагуючих речовин в даний момент часу однакова. = / a,де - координата хімічної реакції;a - стехіометричний коефіцієнт;- зміна кількості реагуючої речовини.Рівняння матеріального балансу: 0де 0 - вихідна кількість речовини;
- кількість речовини в даний момент часу Формули для визначення кількості речовини m/M; V/Vm; Vm 22,4 л/моль;
N/NA; NA 6,02·1023 1/моль. Рівняння Клапейрона-Мендєлєєва pV = nRT; R » 3,14 (Дж/моль·К).
Сульфурвмісні речовини: горіння тіофену в повітрі: C4H4S + 6(O2 + 3,76N2) ( 4CO2 + 2H2O + SO2 + 6·3,76N2;
54.Дифузійна і теплова теорії поширення полум’я при кінетичному горінні газових сумішей.Згідно з дифузійною теорією, переміщення зони хімічної реакції в просторі пов'язано з дифузією активних частинок – радикалів. З зони горіння, де вони при високій температурі утворюються у великій кількості, радикали переходять у свіжу суміш. Згідно з тепловою теорією, головним є розігрів передфронтової смуги свіжої суміші за рахунок теплопровідності, потоку тепла. Теплова теорія доводить, що швидкість поширення полум'я залежить від тих самих факторів, що і швидкість будь-якої хімічної реакції:від температури, енергії активації і концентрації реагуючих речовин.
55.Перетворення пластичних мас різного типу, синтетичних волокон та гум при нагріванні і горінні.Синтетичні полімери – продукт спеціально проведених полімеризації або поліконденсації мономерних сполук. До полімерних матеріалів відносяться високомолекулярні сполуки природного, штучного та синтетичного походження. Синтетичні високомолекулярні сполуки отримують з мономерів. Хімізм їх утворення полягає в реалізації процесу полімеризації або поліконденсації. Натуральне – вовна, бавовна, льон.Штучне волокно, в основі теж має натуральний матеріал. Віскозний шовк – бавовна, перероблена через ксантогенат з обробкою СS2. Синтетичні волокна – продукт спеціально проведеної полімеризації, або поліконденсації. Капрон - продукт поліконденсації ε-амінокапронової кислоти:nH2N(CH2)5COOH + nH2N(CH2)5COOH – (2n-1)H2O
H2N(CH2)5CO–HN(CH2)5CO2n-1–HN(CH2)5COOH Лінійні полімери при горінні досить довгий час лишаються розплавленими, так, що встигають утворити значні калюжі розпеченої і липучої речовини. На вертикальних поверхнях така рідина стікає донизу, або дає краплі. На горизонтальних поверхнях лінійні полімери здатні утворювати розпечені калюжі глибиною до 10 см.
57.Рівняння
залежності нормальної швидкості
поширення полум’я при горінні
газових сумішей від параметрів процесу
(рівняння Я.Б. Зельдовича). Критичний
гасячий діаметр.Згідно тепловій теорії
Я.Б.Зельдовича, умова
 = 0 являється критичною умовою
спалахування.Для кожної суміші існує
діаметр, при якому полум’я вже не
поширюється. Такий діаметр називають
критичним гасильним діаметром. Критичний
гасильний діаметр – це мінімальний
діаметр, при якому полум’я ще здатне
поширюватися на будь-яку відстань від
місця виникнення. Для конкретних умов
горіння критичний (гасильний) діаметр
залежить від фізико-хімічних властивостей
суміші і визначається через критерій
Ре (Пекле):Рекр
=
= 0 являється критичною умовою
спалахування.Для кожної суміші існує
діаметр, при якому полум’я вже не
поширюється. Такий діаметр називають
критичним гасильним діаметром. Критичний
гасильний діаметр – це мінімальний
діаметр, при якому полум’я ще здатне
поширюватися на будь-яку відстань від
місця виникнення. Для конкретних умов
горіння критичний (гасильний) діаметр
залежить від фізико-хімічних властивостей
суміші і визначається через критерій
Ре (Пекле):Рекр
=
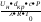 .
.
58.Спирти, альдегіди, кетони, пероксиди, нітрогліцерин. Будова. Пожежо- і вибухонебезпечність.
Спирти -
похідні вуглеводнів,
у молекулах яких один або кілька атомів
водню заміщені гідроксильними групами
(OH). Гідроксильну групу зв'язану
з sp3-гібридизованим атомом вуглецю (карбону)
називають спиртовою. Органічні сполуки
з двома гідроксильними групами
називаються діолами,
з трьома -триолами і
т.д. В українській мові їх також
називають багатоатомними
спиртами.
Альдегіди аліфатичні
та ароматичні органічні хімічні
сполуки, що містять альдегідну
групу НС=О Назва
утворена від алкоголю дегідратацій,
тобто алкоголю, з якого вилучений
водень. Аліфатичні альдегіди — це
зазвичай рідини, наприклад, метаналь
(формальдегід),
етаналь (ацетальдегід).
Ароматичні представники цього класу
можуть бути як рідкими (бензальдегід),
так і твердими (ванілін).Кетонами називаються
сполуки, в молекулах яких міститься
група атомів >С
= О, пов’язана з двома вуглеводневими
радикалами.
59.Продукти згоряння речовин. Дим. Розрахунок об’єму сухих та вологих продуктів згоряння. Дим — стійка дисперсна система, яка складається з дрібних твердих частинок, зважених у повітрі або інших газах. Дим — типовийаерозоль з розмірами частинок від 10-7 до 10-5 м. На відміну від більш грубодиспесної системи — пилу — дим не осідає під дією силиземного тяжіння. Частинки диму можуть слугувати ядрами конденсації атмосферної вологи, в результаті чого виникає туман.продукти згоряння: дим, сажа, аерозолі, в яких містяться токсичні гази,
канцерогенні речовини, важкі метали
60.Концентраційні межі поширення полум’я по газових сумішах. Формули розрахунку. НКМПП та ВКМПП - відповідно нижня і верхня концентраційні межі поширення полум'я - це мінімальна та максимальна об'ємна (масова) частка горючої речовини у сумінй з даним окислювачем, при яких можливе займання (самозаймання) суміші від джерела запалювання з наступним поширенням полум'я по суміші на будь-яку відстань від джерела запалювання.
tHKM і tBKM - відповідно нижня і верхня температурні межі поширення полум'я - температури матеріалу (речовини), за яких його (її) насичена пара чи горючі леткі утворюють в окислювальному середовищі концентрації, що дорівнюють нижній та верхній концентраційним межам поширення полум'я.
91. Вант-Гофф: «Умова теплового самоспалахування полягає у неможливості теплової рівноваги між системою, яка реагує, і середовищем, яке цю систему оточує». М.М.Семенов. Причиною виникнення горіння є перевищення виділення тепла над його відведенням. При тепловому спалахуванні теплота є і причиною самоспалахування і його наслідком. Припускаємо, що всередині колби маємо температуру, яка розвивається при горінні суміші в ній, а термостат і стінка мають температуру, на яку ми налагодимо термостат. Поки температура всередині колбочки досить низька, реакція окиснення іде дуже повільно. Якщо температуру в термостаті підняли до якоїсь Тз1, стінка колби передала цю температуру всередину i уся суміш має Тз1. Швидкість окиснення підвищується, що супроводжується підвищенням виділення теплоти. Кількість цієї теплоти qвид залежить від питомої теплоти горіння газу (Q г), кількості суміші, тобто об'єму колби (V), i швидкості реакції (v): qвид = Qг • V • v.
За
законом Аренiуса:
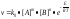 Це
означає, що в наведеній залежності 5
параметрів (Q, V, k, [A] та [B] ) є постійними
i можуть бути замінені спільною константою
Ксп.. Температурою самоспалахування
є та найнижча температура речовини або
матеріалу або суміші, при якій відбувається
різке з Причиною виникнення горіння є
перевищення виділення тепла над його
відведенням, яке веде до різкого
збільшення швидкості екзотермічних
реакцій. Температура самоспалахування
залежить від природи речовини, її
концентрації, об'єму i форми ємності i
наявності каталізатора.більшення
швидкості екзотермічних реакцій, що
закінчується виникненням полум’яного
горіння.
Це
означає, що в наведеній залежності 5
параметрів (Q, V, k, [A] та [B] ) є постійними
i можуть бути замінені спільною константою
Ксп.. Температурою самоспалахування
є та найнижча температура речовини або
матеріалу або суміші, при якій відбувається
різке з Причиною виникнення горіння є
перевищення виділення тепла над його
відведенням, яке веде до різкого
збільшення швидкості екзотермічних
реакцій. Температура самоспалахування
залежить від природи речовини, її
концентрації, об'єму i форми ємності i
наявності каталізатора.більшення
швидкості екзотермічних реакцій, що
закінчується виникненням полум’яного
горіння.
 61.
Органічні кислоти та їх похідні. Етери
та естери До
складу органічних кислот обов’язково
входить карбоксильна група - С-ОН .Назви
за систематичною номенклатурою утвор.
з назв вуглеводнів, до яких додають
суфікс -ова і слово кислота.
Нижчі
представники, з числом атомів карбону
до 3 – безбарвні легкорухомі рідини з
хар-м запахом. Кислоти, з числом атомів
карбону 4 – 9 – маслянисті в’язкі
рідини. Далі – тверді реч. Із збільшенням
кількості атомів карбону у молекулі
змен. густина кислоти і її розчинність
у воді. Мурашина і оцтова кислоти важчі
за воду, решта – легші. Т кипіння
органічних кислот ще більша ніж Т.
кипіння відповідних спиртів. Як і
мінеральні, органічні кислоти реагують
з лужними металами і лугами, утворюючи
солі: R-COOH + NaOH
R-COONa + H2O
У пож відношенні органічні кислоти
менш небезпечні ніж відповідні алканони,
алканалі, алканоли і, тим більше,
алкани.Із збільшенням молекулярної
маси пож небезпечність зростає.При
взаємодії двох молекул спирту можливе
утворення етерів типу R-O-R,
дуже летючих і легкозаймистих рідин.Якщо
в органічних кислотах замінити активний
атом гідрогену, або гідроксил, або і
гідроксил і карбоніл разом на інші
групи, утворюються похідні кислот. У
пожежному відношенні вони близькі до
спиртів з тим же числом атомів карбону.
Наприклад, температура кипіння етилового
спирту 78оС,
а ацетонітрилу СН3-С≡N
82оС.
Естери – це продукти взаємодії органічних
кислот з спиртами. Це легколетючі і
легкозаймисті рідини.Так, етилацетат
має температуру кипіння 77оС,
спалаху -3оС,
спалахування 6оС,
самоспалахування 446оС.
НКМПП для нього 3,55%. ВКМПП – 6,8%. У сумішах
з перманганатом калію і іншими окисниками
етилацетат здатен самоспалахувати.
61.
Органічні кислоти та їх похідні. Етери
та естери До
складу органічних кислот обов’язково
входить карбоксильна група - С-ОН .Назви
за систематичною номенклатурою утвор.
з назв вуглеводнів, до яких додають
суфікс -ова і слово кислота.
Нижчі
представники, з числом атомів карбону
до 3 – безбарвні легкорухомі рідини з
хар-м запахом. Кислоти, з числом атомів
карбону 4 – 9 – маслянисті в’язкі
рідини. Далі – тверді реч. Із збільшенням
кількості атомів карбону у молекулі
змен. густина кислоти і її розчинність
у воді. Мурашина і оцтова кислоти важчі
за воду, решта – легші. Т кипіння
органічних кислот ще більша ніж Т.
кипіння відповідних спиртів. Як і
мінеральні, органічні кислоти реагують
з лужними металами і лугами, утворюючи
солі: R-COOH + NaOH
R-COONa + H2O
У пож відношенні органічні кислоти
менш небезпечні ніж відповідні алканони,
алканалі, алканоли і, тим більше,
алкани.Із збільшенням молекулярної
маси пож небезпечність зростає.При
взаємодії двох молекул спирту можливе
утворення етерів типу R-O-R,
дуже летючих і легкозаймистих рідин.Якщо
в органічних кислотах замінити активний
атом гідрогену, або гідроксил, або і
гідроксил і карбоніл разом на інші
групи, утворюються похідні кислот. У
пожежному відношенні вони близькі до
спиртів з тим же числом атомів карбону.
Наприклад, температура кипіння етилового
спирту 78оС,
а ацетонітрилу СН3-С≡N
82оС.
Естери – це продукти взаємодії органічних
кислот з спиртами. Це легколетючі і
легкозаймисті рідини.Так, етилацетат
має температуру кипіння 77оС,
спалаху -3оС,
спалахування 6оС,
самоспалахування 446оС.
НКМПП для нього 3,55%. ВКМПП – 6,8%. У сумішах
з перманганатом калію і іншими окисниками
етилацетат здатен самоспалахувати.
62.
Екзо- та ендотермічні реакції. Теплота
утворення речовинРеакції,
при яких енергія виділяється, називаються
екзотермічними (екзо - назовні).Реакції,
при яких енергія поглинається, називаються
ендотермічними (ендо - всередину
).Теплотою утворення даної сполуки
називається кількість теплоти, що
виділяється при утворенні одного молю
складної сполуки з простих речовин.
Закон
І. І. Геса. Тепловий
ефект хімічної реакції не залежить від
характеру і послідовності окремих її
стадій і визначається лише початковими
та кінцевими продуктами реакції та їх
фізичним станом.Звідси випливає.
Тепловий ефект хімічної реакції дорівнює
сумі теплот утворення отриманих речовин
за мінусом суми теплот утворення
вихідних речовин.Теплоти утворення
найбільш стійких за нормальних умов
простих речовин прийняті рівними
нулю.Нулю дорівнює теплота утворення
Н2.
Нулю дорівнює теплота утворення 02:
(Нутв)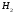 = 0 ; (Нутв)
= 0 ; (Нутв)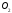 = 0. Але вже для О3
вона від нуля відрізняється: (Нутв)
= 0. Але вже для О3
вона від нуля відрізняється: (Нутв)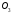 = + 142
= + 142 .В хімічній термодинаміці теплота,
що виділяється із системи при даному
процесі, має знак ''-''. а теплота, що
поглинається системою, збільшує запас
її енергії - знак ''+''.Теплота утворення
газоподібної води із водню і кисню
-241,8 кДж/моль. Тобто при згорянні водню
запас енергії в системі зменшується,
енергія виділяється.
.В хімічній термодинаміці теплота,
що виділяється із системи при даному
процесі, має знак ''-''. а теплота, що
поглинається системою, збільшує запас
її енергії - знак ''+''.Теплота утворення
газоподібної води із водню і кисню
-241,8 кДж/моль. Тобто при згорянні водню
запас енергії в системі зменшується,
енергія виділяється.
63. Детонаційне горіння газів і парів.
На малюнку, крива – нормальний фронт поширення полум’я; прямі А-В - детонаційні хвилі. Хвиля, яка виникла в точці А3, наздоганяє хвилі, які виникли в точках А0, А1 та А2. І наздоганяє їх у точці В. Нормальний фронт полум’я у цей момент знаходився у точці С. Але у точці В попереду фронту вже виникло детонаційне горіння, яке іде значно скоріше, ніж по кривій А - С. Між точками С і В лишилася частина вихідної суміші, яка горить з двох боків: по лінії С - Е з нормальною швидкістю і по лінії В - Е з детонаційною швидкістю. Потім ця хвиля В - Е іде і далі, по продуктах горіння Е - R, ретонаційна хвиля.

64. Правила зберігання і застосування речовин, що використовуються в сільському господарстві.До вибухонебезпечних пестецидних препаратів насамперед відноситься динітрокрезол (ДН, динок, селинон, 2-метил-4,6-динітрокрезол). Це жовта кристалічна речовина, погано розчинна у воді і добре - у спирті. Легко займається і, якщо не вибухає, то горить з великою швидкістю і з кіптявою.
Аналогічні властивості має динітро-орто-вторбутилфенол (ДНБФ, диносеб, 2-втор-бутил-4,6-динітрофенол).
І той і другий для зменшення вибухонебезпечності використовують в-основному у вигляді паст, у сумішах з водою і речовинами, що цю воду утримують ( сульфатом натрію і сульфатом амонію). При зберіганні треба слідкувати за тим, щоб паста не висохла, тобто час від часу додавати воду.Серед великої кількості добрив пожежну небезпеку становлять тільки азотовмісні речовини, особливо селітри, які здатні до вибуху як у чистому вигляді так і, особливо, у сумішах з деякими іншими речовинами, які виступають як відновники або каталізатори розкладу. Горіння азотовмісних добрив супроводжується виділенням токсичних продуктів горіння.
65. Перший і другий закони термохімії. Вища і нижча теплота згоряння.Закон І. І. Геса. Тепловий ефект хімічної реакції не залежить від характеру і послідовності окремих її стадій і визначається лише початковими та кінцевими продуктами реакції та їх фізичним станом.Звідси випливає.Тепловий ефект хімічної реакції дорівнює сумі теплот утворення отриманих речовин за мінусом суми теплот утворення вихідних речовин.Вищою теплотою згоряння Qв називають кількість тепла, що виділяється при повному згорянні І кг або 1 м3 горючої речовини при умові, що весь водень і гідроген, які містяться в ній, згоряють з утворенням рідкої води.Нижчою теплотою згоряння Qн називають кількість тепла, що виділяється про повному згорянні І кг або 1 м3 горючої речовини при умові згоряння водню і гідрогену до утворення водяної пари і випаровування вологи горючої речовини.
66. Концентраційні межі поширення полум’я у газових сумішах. Їх залежність від потужності джерела запалювання, домішок активних та інертних флегматизаторів, початкової температури.Мінімальний вміст горючої речовини в однорідній суміші з окиснювальним середовищем, при якому можливе поширення полум'я по суміші на будь-яку відстань від джерела запалювання, називається нижньою концентраційною межею поширення полум'я (НКМПП)Максимальний вміст горючої речовини в однорідній суміші з окиснювальним середовищем, при якому можливе поширення полум'я по суміші на будь-яку відстань від джерела запалювання, називається верхньою концентраційною межею поширення полум'я (ВКМПП).Із збільшенням потужності джерела запалювання концентраційні межі поширення полум’я розширюються, але не безмежно. Існує межа, вище якої зміна потужності іскор змін меж поширення полум’я не викликає. Таку іскру називають насиченою. Введення негорючих газів і парів не просто розводить суміш, знижуючи концентрацію горючої речовини і кисню. Такий домішок, а його іще називають флегматизатор, ще й впливає на систему за рахунок своїх теплофізичних характеристик, знижуючи температуру горіння. Вплив початкової температури суміші.З підвищенням початкової температури суміші НКМПП знижується, але не набагато. Верхня межа реагує більш помітно. Підвищення температури на 1000С зменшує НКМПП на 8-10 % і збільшує ВКМПП на 12 - 15 %. Так що при підвищеній температурі горіти здатні суміші, які при нижчій температурі - інертні.Вплив тиску.Якоїсь загальної залежності КМПП від тиску не встановлено. Зниження тиску нижче атмосферного викликає звуження КМПП для усіх сумішей. Причому для кожної з них існує така величина тиску, нижче якої спалахування взагалі не відбудеться, тобто у цьому випадку між нижньою та верхньою межами лежить область в 0 % концентрації горючої речовини.Нормальна швидкість поширення полум'я - величина, відносно невелика, порядку десятків метрів в секунду. Але буває горіння, коли полум'я поширюється з величезною швидкістю, до 5 км/с, детонаційне горіння. Така швидкість перевищує швидкість звуку. Фронт полум’я видовжується. За рахунок турбулізації він не тільки видовжується, але й вигинається, що ще збільшує поверхню фронту. А збільшення поверхні викликає прискорення горіння. Швидкість поширення полум’я може зрости до 1000 м/с.
67. Класифікація пожеж за умовами масо- і теплообміну та за видами горючих матеріалів.За умовами масо- і теплообміну розрізняють дві великі групи: поже на відкритих просторах (пож I класу) і пож в огородженні (пож II класу).Пож I класу умовно поділяють на ті, що поширюються (клас 1а); ті, що не поширюються (клас 1б) і масові (клас 1в). Пож, що пошир (клас 1а) – це пож, розміри яких, тобто межі яких (ширина фронту, периметр, радіус, подовженість флангів і т.п.) з часом пош. Пож, що не пош (локальними, клас 1б) наз пож, розміри яких з часом лишаються незмінними, Окремим типом пож I класу є пож масова (1в). Під масовою пож розуміють спільність окремих і суцільних пож в н/ п, на великих складах ГМ і на промислових під-х. Окрема пож– то пож що виникла в окремій будівлі або споруді.Суцільна – то одночасне інтенсивне горіння переважної більшості будівель та споруд на даній ділянці забудови.Масова пож може перейти у вогняний шторм – особливу форму пож яка хар-ся утвор єдиного спільного турбулентного факелу полум’я. Пож в огородженні ділять на закриті і відкриті. Відкриті пож(клас IIа) розвиваються при повністю або частково відкритих проємах (вікон, дверей, вентиляції і т.п.). Закриті пож (клас IIб) протікають при повністю закритих проємах. Коли газообмін здійснюється тільки внаслідок інфільтрації повітря і продуктів згоряння крізь нещільності огородження: крізь щілини у дверях, вікнах і т.п. В залежності від виду матеріалів і речовин, які горять, пожежі поділяють До пожеж класу А відносяться пожежі з горінням твердих речовин, за винятком металів. Якщо ця тверда речовина здатна тліти (папір, деревина, ганчір’я), пожежа відноситься до класу А1. Якщо тліти речовина нездатна (пластмаса), – до класу А2. До пожеж класу В відносяться пожежі з горінням рідин. Якщо горить рідина, нерозчинна у воді (бензин, нафта і т.п.), то пож відноситься до класу В1. Якщо ж горюча реч розчинна у воді (спирт, ацетон) – до класу В2. До пож класу С відносяться пож з горінням газоподібних речовин (водень, метан, гази з газової свердловини і т.п.).До пожеж класу Д відносяться пож з горінням металів. Якщо горить легкий метал –алюміній, магній або їх сплави, пожежа відноситься до класу Д1; якщо горить лужний метал (натрій, калій і т.п.) – до класу Д2; якщо горить металоорганічна сполука (метилнатрій, діетилмагній і т.п.) – до класу Д3.
68. Розрахунок теплоти згоряння індивідуальної речовини за законом Геса
Звідси випливає. Тепловий ефект хімічної реакції дорівнює сумі теплот утворення отриманих речовин за мінусом суми теплот утворення вихідних речовин.Таким чином, теплота утворення молю води є в той же час тепловим ефектом хімічної реакції згоряння молю водню: Н2 + 0,5 02 = Н20(г) + Q (Q = -241,8кДж). Нзг (Н2) = Нутв(Н2О) – Нутв(Н2) - Нутв(02),С + 0,502 = СО - 110,5 кДж/моль,СО + 0,502 = С02 - 28З,О кДж/моль.А можна С + 02 = С02 - 393,5 кДж/моль.Сума теплових ефектів двох перших реакцій буде точно такою, як тепловий ефект третьої.Вищою теплотою згоряння Qв називають кількість тепла, що виділяється при повному згорянні І кг або 1 м3 горючої речовини при умові, що весь водень і гідроген, які містяться в ній, згоряють з утворенням рідкої води.Нижчою теплотою згоряння Qн називають кількість тепла, що виділяється про повному згорянні І кг або 1 м3 горючої речовини при умові згоряння водню і гідрогену до утворення водяної пари і випаровування вологи горючої речовиниТеплота випаровування води становить + 44 кДж/моль. Теплота утворення газоподібної води становить -241,8 кДж/моль, а рідкої -285,8 кДж/моль.
70.Основні параметри розвитку пожежі (постійне та тимчасове пожежне навантаження, площа і фронт пожежі і т.п.).Тривалістю пож п (хв) наз час з моменту її виникнення до повного припинення горіння.Площею пож Fп (м2) наз площу проекції зони горіння на горизонтальну або вертикальну площину. У більшості випадків зону горіння проектують на горизонтальну площину.Тем-ра пож Тп (К) або tn (оС). Тем-ра пож в огородженні – то середньооб’ємна тем-ра у приміщенні, тобто тем-ра, до якої нагріваються продукти горіння всередині приміщення. Тем-ра пож на відкритому просторі – то тем-ра полум’я. Лінійна шв розповсюдження полум’я vр, або швидкість поширення полум’я. Це швидкість поширення полум’я по поверхні ГМ, тобто відстань, яку проходить фронт горіння в одиницю часу. Теплота пож Qn1 (кДж/с) хар-є к-сть тепла, що виділяється у зоні горіння в одиницю часу: Qn1 = vмFпQнx , в цій формулі:
-
- коеф хім недопалу;vм - приведена масова швидкість вигоряння, кг/м2с;Fп - площа пож, м2;Qн - нижча теплота згоряння, кДж/кг.Приведена теплота пож Qп (кДж/м2с) показує, яка к-сть тепла виділяється в одиницю часу з одиниці площі пож: Qп = vмQн.Коефіцієнт хімічного недопалу обирається в залежності від кількості повітря, необхідного для повного спалювання одиниці маси горючого.Інтенсивністю газообміну Iг (кг/м2с) називається кількість повітря, що притікає в одиницю часу до одиниці площі пожежі. Розрізняють потрібну Iгпотр. і фактичну Iгф інтенсивність газообміну. Потрібна – показує яка кількість повітря повинна подаватися в одиницю часу до одиниці площі пожежі для забезпечення повного спалювання матеріалу. Фактична інтенсивність газообміну відбиває фактичну доставку повітря до пож. Інтенсивність або густина задимлення z хар-є погіршення видимості і ступінь токсичності атмосферного повітря у зоні задимлення. Він визначається по товщині шару диму, крізь який вже не видно світла еталонної лампи, або по к-сті твердих частинок, яка міститься в одиниці об’єму. Вимірюється z у г/м3. Під динамікою пож розуміють зміну основних параметрів пож у часі і просторі. Як основні, при вивченні динаміки пож викор такі її параметри як площа пож, її тем-ра і інтенсивність задимлення.
71.
Розрахунок теплоти згоряння суміші
речовин за теплотами згоряння
компонентів.Якщо
ми маємо суміш горючих речовин Рг,
, то при горінні в повітрі, реагуючи з
киснем, вона дасть суміш продуктів
горіння Пг
і
тепло Нг:Рг
+ О2
= Пг
-
Нг
.Наслідок другого закону термохімії в
цьому випадку записується наступним
чином:Нг
= (Нутв)п.г.
- (Нутв)р.г.
- (Нутв)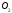 ,
але (Нутв)
,
але (Нутв)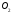 =
0, звідки Нг
= (Нутв)п.г.
- (Нутв)р.г,
або просто Нг
= (Нутв)п.г.
- (Нутв)р.г,
у формулі:Нг
- теплота реакції горіння (або, якщо
поміняти знак на протилежний, тепловий
ефект реакції);(Нутв)п.г.
- сума теплот утворення продуктів
реакції;(Нутв)р.г
- сума теплот утворення вихідних
горючих речовин.Приклад.
Горить ацетон. Треба визначити нижчу
теплоту згоряння.Починати треба з
рівняння хімічної реакції. СН3СОСН3
+ 4О2
= 3СО2
+ 3Н2О
+ Q,
Нутв(ац)
= - 248,45 кДж/моль;Нутв(СО2)газ
= - 393,78 кДж/моль;Нутв(Н2О)газ
= - 241,80 кДж/моль;Нутв(О2)
= 0,Нг
(ац)
= 3(-393,78)
+ 3(-241,80)
– (-248,45) =-1181,3 - 725,4 + 248,5 = -1906,7 + 248,5
== -1658,2 кДж/моль.
=
0, звідки Нг
= (Нутв)п.г.
- (Нутв)р.г,
або просто Нг
= (Нутв)п.г.
- (Нутв)р.г,
у формулі:Нг
- теплота реакції горіння (або, якщо
поміняти знак на протилежний, тепловий
ефект реакції);(Нутв)п.г.
- сума теплот утворення продуктів
реакції;(Нутв)р.г
- сума теплот утворення вихідних
горючих речовин.Приклад.
Горить ацетон. Треба визначити нижчу
теплоту згоряння.Починати треба з
рівняння хімічної реакції. СН3СОСН3
+ 4О2
= 3СО2
+ 3Н2О
+ Q,
Нутв(ац)
= - 248,45 кДж/моль;Нутв(СО2)газ
= - 393,78 кДж/моль;Нутв(Н2О)газ
= - 241,80 кДж/моль;Нутв(О2)
= 0,Нг
(ац)
= 3(-393,78)
+ 3(-241,80)
– (-248,45) =-1181,3 - 725,4 + 248,5 = -1906,7 + 248,5
== -1658,2 кДж/моль.
72. Розрахунок тиску насиченої пари суміші речовин.Тиск в зоні горіння і в зоні продуктів горіння в 10 і більше разів перевищує початковий. Цей тиск передається і вихідним речовинам. Безпосередньо перед зоною горіння він майже такий, як і у зоні горіння. А далі по вихідній суміші поступово (по кривій) знижується до початкового.
Температура. У зоні горіння вона найвища. Область А - А1. За зоною горіння, в продуктах горіння, внаслідок тепловіддачі в оточуюче середовище, вона поступово знижується (А - Аn). На передній поверхні зони горіння вона дорівнює температурі самоспалахування, а далі повільно, дуже повільно, знижується. Перед фронтом полум’я вихідна суміш нагріта, і чим ближче до фронту - тим більше. По-перше, в ізохорному процесі (процесі при постійному об’ємі) підвищення температури однозначно супроводжується підвищенням тиску. По-друге, тепло передається через теплопровідність, тобто Броунівським рухом. По-третє, має місце випромінювання тепла. І, останнє, у вихідну суміш дифундує якась частина нагрітих продуктів реакції горіння, яка несе із собою фізичне тепло, має якійсь тепловміст.
74. Розрахунок теплоти згоряння матеріалів за формулою Д.І. Менделєєва.Формула Д. І. Менделєєва :Qв = 339,4С +1257Н - 108,9(0+N-S) кДж/кг.В цій формулі C, H, O, N, S - масова відсоткова кількість в суміші відповідно вуглецю (карбону), водню (гідрогену), кисню (оксигену), азоту (нітрогену), сірки (сульфуру). Формула для визначення нижчої теплоти згоряння відрізняється тим, що враховує теплоту випаровування води: Qн = 339,4С +1257Н - 108,9(0+N-S) - 25(9Н + W) кДж/кг.Нижча теплота згоряння найбільш енерговмісних речовин: водню 142,5 тисячі кДж/кг;метану 55,6 тисячі кДж/кг; вуглецю 32,75 тисячі кДж/кг.Для метанолу СН3ОН вона мас значення 23,8 тис. кДж/кг, а для мурашиної кислоти НСООН - всього 5,7 тис. кДж/кг.
75.
Випаровування рідин. Насичена пара.
Визначення тиску насиченої пари
індивідуальної
рідини за номограмою, за рівнянням
Клаузіуса-Клапейрона, за таблицями.Причина
випаровування - Броунівський рух.
Випаровування - процес ендотермічний.
Швидкість випаровування залежить від
умов навколишнього середовища, насамперед
від температури, і від природи рідини:
її температури кипіння, а точніше, тиску
насиченої пари даної рідини при даній
температурі. У закритій посудині
вільного масообміну немає. Виникають
умови для зворотного процесу - конденсації.
В певний момент кількість молекул, що
перейшла з рідини у газову фазу, буде
дорівнювати кількості молекул, що
повернулися з газової фази у рідку.
Такий стан співіснування рідини і пари
називається динамічною
рівновагою,
а пара такого стану називається
насиченою
парою.
Тиском насиченої пари називають тиск
пари, що знаходиться у стані динамічної
рівноваги з рідиною при даній температурі.
Його ще називають пружністю насиченої
пари. Цей тиск не залежить від кількості
рідини, розмірів її поверхні, форми
посудини; а залежить лише від природи
рідини і температури. Для даної рідини,
при даній температурі тиск насиченої
пари величина - постійна. Чим більша
температура - тим більше тиск насиченої
пари даної рідини.Маючи відповідні
таблиці, можна користуватися рівнянням
Антуана:lgP = A -
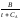 ,P - тиск насиченої пари, мм рт ст.;t
- температура,0С;А,
В та СА
- константи, що залежать від природи
речовини.
,P - тиск насиченої пари, мм рт ст.;t
- температура,0С;А,
В та СА
- константи, що залежать від природи
речовини.
76.
Особливості розвитку пожеж класів В
та С на відкритих просторахПож
класів В та С на відкритих просторах
– це в-основному пож. у місцях видобутку
нафти та газу або пож при зберіг і
транспортуванні нафтопродуктів.Газовими
вважають фонтани із вмістом горючого
газу не менше 95% за масою, нафтовими
– із вмістом не менше 50% нафти і
газонафтовими – решту, тобто коли нафти
менше 50% але більше 5%.За потужністю,
газові і газонафтові фонтани розподіляють
на слабкі (з дебітом газу до 2 млн. м3
на добу), середні (від 2 до 5 млн. м3
на добу) і потужні (більше 5 млн. м3
на добу).Верхня частина факелу ширша
за нижню. Знизу, біля самого зрізу, за
рахунок заданого початкового напряму
газового струменю і за рахунок того,
що свіже повітря ще холодне, факел буде
мати діаметр навіть трохи менший за
діаметр труби.Температура максимальною
буде на поверхні стехіометричних
концентрацій. В обидва боки від цієї
поверхні вона поступово знижується,
але лишається досить високою, порядку
1300 - 1350оС.
Зона високих температур приблизно
співпадає з зоною між ВКМПП та НКМПП.
Біля зрізу труби вона має нульовий
розмір, а з висотою поступово збільшується,
так само як збільшуються відстань між
поверхнями ВКМПП та НКМПП і діаметр
факелу. На певній відстані від зрізу
труби перетин поверхні НКМПП починає
зменшуватися.Відстань від точки початку
горіння до точки, у якій сфера високих
температур перекриває осьову лінію,
називається зоною спалахування.Висота
зони догоряння разом з висотою зони
спалаху-вання визначають висоту факелу:
Нф
= Нз.сп.
+ Нз.дог..Нижче
зони спалахування розтало-вана зона
відриву полум’я.Найбільш часто
користуються формулами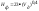 та
та
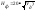 ,
деНф
- висота факелу полум’я,
м;Vд
- дебіт свердловини у млн м3/добу;
З висотою пов’язаний діаметр факелу
у найширшій його частині. Приблизно
його можна вирахувати по формулі: Dф
= (0,1 – 0,15)Нф
, тобто максимальний діаметр факелу
складає 1/6 – 1/10 частину його висоти.
,
деНф
- висота факелу полум’я,
м;Vд
- дебіт свердловини у млн м3/добу;
З висотою пов’язаний діаметр факелу
у найширшій його частині. Приблизно
його можна вирахувати по формулі: Dф
= (0,1 – 0,15)Нф
, тобто максимальний діаметр факелу
складає 1/6 – 1/10 частину його висоти.
77. Калориметрична, теоретична і дійсна температура горіння.
Дійсна - це та температура, що існує в зоні пожежі реально.Калориметрична температура – умовна.
Калориметричною є температура, до якої нагріваються продукти повного згоряння при умовах:1. Все тепло, що виділяється, витрачається на нагрів продуктів згоряння. Втрати тепла дорівнюють нулю. 2. Початкова температура повітря і горючої речовини дорівнює нулю (за Цельсієм).3. Кількість повітря дорівнює теоретично необхідній ( = 1).4. Відбувається повне згоряння.Температура внутрішньої пожежі - це середня температура диму в приміщенні, у якому пожежа відбувається.Температура зовнішньої пожежі - температура полум ' я.Теоретична температура-це температура яка враховує ендотермічні реакції дисоціаціїТепло, що іде на нагрів продуктів згоряння до калориметричної температури, дорівнює нижчій теплоті згоряння qг = Qн, або Qн = qг, тобто теплоті, що виділяється.
