
- •37.Стандартні показники пожежо- та вибухонебезпечності.Пожежна небезпека - це можливість виникнення або швидкого розвитку пожежі, яка криється в речовині, стані або процесі.
- •51.Нормальна, масова і видима швидкість поширення полум’я при кінетичному горінні газових сумішей.
- •78. Розрахунок концентрації пари рідини в повітрі. Нкмпп та вкмпп.
- •79. Особливості розвитку пожеж класу а на відкритих просторах.
- •123. Перша з них - це негорючі речовини і матеріали, тобто не здатні горіти у повітрі.
78. Розрахунок концентрації пари рідини в повітрі. Нкмпп та вкмпп.
Концентрацію
насиченої пари рідини визначають для
того, щоб порівняти її з НКМПП та ВКМПП.
За апроксимаційними формулами
розраховують для даної рідини (або
суміші) НКМПП i ВКМПП. Потім знаходять
тиск насиченої пари даної рідини або
суміші, який відповідає НКМПП та ВКМПП.
Далі визначають реальний тиск насиченої
пари i порівнюють його з тиском для
НКМПП та ВКМППЯкщо дійсна концентрація
знаходиться між НКМПП та ВКМПП, то суміш
вибухонебезпечна. Якщо ж вона нижча
НКМПП, то дана рідина або суміш безпечні:
спалаху або вибуху не буде.Граничнодопустиму
вибухонебезпечну концентрацію приймають
"із запасом":ГДВК = НКМПП
Кб,
де Кб
- коефіцієнт безпеки, менший 1.Для
виробничих приміщень Кб
0,1.Для приміщень, в яких передбачається
проведення вогневих робіт, Кб
= 0,05.За апроксимаційними формулами
визначають концентраційні межі поширення
полум’я. Потім знаходять нижнє і верхнє
значення пружностей парів, які
відповідають цим концентраціям, за
формулою:Р =
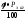 , де
- нижнє або верхнє
значення концентрації
(об. %), тобто НКМПП або ВКМПП;Рзаг-
загальний тиск, у звичайному випадку
760 мм рт ст., або 101,325 кПа.А далі за
таблицями пружності насиченої пари
визначають температуру, при якій ця
пружність досягається. Інший шлях
розрахунку температурних меж поширення
полум’я. За емпіричною формулою: tмп
= кtкип
- l ,tмп
- нижня або верхня межа поширення
полум’я;tкип
- температура кипіння рідини при
101,325кПа;к та l - константи, експериментально
знайдені для багатьох речовин, окремо
для нижньої і верхньої межі.Один з
найпоширеніших методів розрахунку
температури спалаху - використання
нижньої температурної межі поширення
полум’я, за формулою: tсп
= 1,14 (НТМПП + 2).Формула Елея: tcп
= tкип
- 18
, де
- нижнє або верхнє
значення концентрації
(об. %), тобто НКМПП або ВКМПП;Рзаг-
загальний тиск, у звичайному випадку
760 мм рт ст., або 101,325 кПа.А далі за
таблицями пружності насиченої пари
визначають температуру, при якій ця
пружність досягається. Інший шлях
розрахунку температурних меж поширення
полум’я. За емпіричною формулою: tмп
= кtкип
- l ,tмп
- нижня або верхня межа поширення
полум’я;tкип
- температура кипіння рідини при
101,325кПа;к та l - константи, експериментально
знайдені для багатьох речовин, окремо
для нижньої і верхньої межі.Один з
найпоширеніших методів розрахунку
температури спалаху - використання
нижньої температурної межі поширення
полум’я, за формулою: tсп
= 1,14 (НТМПП + 2).Формула Елея: tcп
= tкип
- 18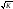 ,
,
tкип - температура кипіння, 0С;К - коефіцієнт горючості речовини.Коефіцієнт горючості розраховують за простою сумою. К=4nC+4nS+nH-2nO-2nCl-3nF-5nBr ,nC, nS, nH, nO, nCl, nF, nBr - кількість атомів вуглецю
79. Особливості розвитку пожеж класу а на відкритих просторах.
До цих пож відносяться пож на складах деревини, лісові, торф’яні, степові і пожежі злакових полів. Їх спільною рисою є залежність від погодних умов, насамперед від вологості, температури, наявності та сили вітру і від рельєфу місцевості. У жарку суху погоду вірогідність виникнення таких пожеж значно вища ніж у мокру погоду чи при низьких температурах.Середня швидкість поширення полум’я по складах деревини коливається у широких межах: від 0,1 до 10 м/хв і більше. Приведена масова швидкість вигоряння може досягати десятків кілограмів з 1 квадратного метру за хвилинуЛісові пожежі виникають переважно у суху та жарку погоду і вдень. Вночі і температура нижча і вологість більша. Розрізняють низову та верхову лісову пожежу. Швидкість поширення полум’я низової пожежі відносно невисока, до 70 – 80 м/хв. Висота полум’я не перевищує 2 – 2,5 м. Верхові пожежі – більш небезпечні. У суху погоду швидкість верхової пожеж досягає 350 – 400 м/хв. Торф’яні пожежі спостерігаються найчастіше у місцях розробки торф’яних полів. Швидкість поширення торф’яної пожежі досягає 20 – 25 м/хв. У суху жарку погоду, хоч і рідко, торф’яна пожежа може виникнути і у природничих умовах.Особливостями структури торф’яних полів є пориста структура, висока порожнистість. Під верхнім шаром можуть створюватися великі порожнини; свого роду вовчі ями, але з тліючими розпеченими стінками і сподом. Степові пожежі і пожежі злакових культур поширюються по дуже подрібненому матеріалу – це тонкостінні трубки стебел. Горять вони з великою кількістю іскор і пожежа поширюється зі швидкістю до 700 м/хв.
81. Зміна основних параметрів пожежі у приміщенні в часі.У розвитку внутрішніх пожеж виділяють декілька етапів або фаз.Ця перша фаза пожежі – загоряння.Друга фаза, прогрів. Третя фаза – бурхливий зріст усіх параметрів і початок об’ємного горіння. Температура у приміщенні зростає до 250 – 300оС. При температурі 200 – 300оС тріскається і розвалюється віконне скло. IV етап пожежі. Інтенсифікація газообміну. Підйом температури до 500 – 600оС.Пожежа поступово захоплює усю площу, температура піднімається до 800 – 900оС. Стабілізація пожежі (V фаза) наступає на 20-25-ій хвилині і продовжується, якщо пожежу не загасити, 20 – 30 хвилин, до вигоряння основної частини пожежного навантаження.VI фаза – зниження інтенсивності пожежі. VII фаза – догоряння, яке виглядає як тління із поступовим зниженням виділення тепла і температури.
82. Явище каталізу. Позитивний і негативний, гомогенний і гетерогенних каталіз. Механізм дії каталізаторів.Каталіз - виборче прискорення одного з можливих термодинамічно дозволених напрямків хімічної реакції під дією каталізатора (ів), який багаторазово вступає в проміжне хімічна взаємодія з учасниками реакції і відновлює свій хімічний склад після кожного циклу проміжних хімічних взаємодій. [1] Основні принципи каталізуКаталізатор змінює механізм реакції на енергетично більш вигідний, тобто знижує енергію активації. Каталізатор утворює з молекулою одного з реагентів проміжне з'єднання, в якому ослаблені хімічні зв'язки. Це полегшує його реакцію з другим реагентом. Важливо зазначити, що каталізатори прискорюють оборотні реакції, як в прямому, так і в зворотному напрямках.2. Гомогенний каталізПрикладом гомогенного каталізу є розкладання пероксиду водню в присутності іонів йоду. Реакція протікає у дві стадії:H 2 О 2 + I → H 2 О + IO, H 2 О 2 + IO → H 2 О + О 2 + IПри гомогенному каталізі дію каталізатора пов'язано з тим, що він вступає у взаємодію з реагують речовинами з утворенням проміжних сполук, це призводить до зниження енергії активації.2.2. Гетерогенний каталізПри гетерогенному каталізі прискорення процесу зазвичай відбувається на поверхні твердого тіла - каталізатора, тому активність каталізатора залежить від величини і властивостей його поверхні. На практиці каталізатор зазвичай наносять на твердий пористий носій.Механізм гетерогенного каталізу складніше, ніж у гомогенного. Механізм гетерогенного каталізу включає п'ять стадій, причому всі вони оборотні.1.Дифузія реагуючих речовин до поверхні твердої речовини2. Фізична адсорбція на активних центрах поверхні твердого речовини реагують молекул і потім хемосорбция їх3. Хімічна реакція між реагують молекулами4.Десорбція продуктів з поверхні каталізатора5.Дифузія продукту з поверхні каталізатора в загальний потікПрикладом гетерогенного каталізу є окислення SO 2 в SO 3 на каталізаторі V 2 O 5 при виробництві сірчаної кислоти (контактний метод).
83.
Температурні межі поширення полум’я
по поверхні рідин. Способи їх
розрахункуТемпературні
межи поширення полум'я - це температури
рідини, при яких її насичена пара
утворює в окиснювальному середовищі
концентрації, що дорівнюють нижній або
верхній концентраційним межам поширення
полум'я.Для створення безумовної
пожежобезпечності технологічного
процесу, пов’язаного із застосуванням
рідин, процес ведуть при температурах,
на 100
нижчих від НТМПП, або на 150
вищих від ВТМПП.За апроксимаційними
формулами визначають концентраційні
межі поширення полум’я. Потім знаходять
нижнє і верхнє значення пружностей
парів, які відповідають цим концентраціям,
за формулою:Р =
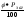 , де
- нижнє або верхнє значення концентрації
(об. %), тобто НКМПП або ВКМПП;Рзаг-
загальний тиск, у звичайному випадку
760 мм рт ст., або 101,325 кПа.А далі за
таблицями пружності насиченої пари
визначають температуру, при якій ця
пружність досягається. Інший шлях
розрахунку температурних меж поширення
полум’я. За емпіричною формулою tмп
= кtкип
- l ,tмп
- нижня або верхня межа поширення
полум’я;tкип
- температура кипіння рідини при
101,325кПа;к та l - константи, експериментально
знайдені для багатьох речовин, окремо
для нижньої і верхньої межі.
, де
- нижнє або верхнє значення концентрації
(об. %), тобто НКМПП або ВКМПП;Рзаг-
загальний тиск, у звичайному випадку
760 мм рт ст., або 101,325 кПа.А далі за
таблицями пружності насиченої пари
визначають температуру, при якій ця
пружність досягається. Інший шлях
розрахунку температурних меж поширення
полум’я. За емпіричною формулою tмп
= кtкип
- l ,tмп
- нижня або верхня межа поширення
полум’я;tкип
- температура кипіння рідини при
101,325кПа;к та l - константи, експериментально
знайдені для багатьох речовин, окремо
для нижньої і верхньої межі.
Один
з найпоширеніших методів розрахунку
температури спалаху - використання
нижньої температурної межі поширення
полум’я, за формулою: tсп
= 1,14 (НТМПП + 2).Формула Елея:tcп
= tкип
- 18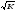
,
84. Виникнення пожежі викликає перерозподіл газових потоків. Різниця густини нагрітого газу (г) і густини зовнішнього повітря (пов) приводить до того, що стовп повітря має масу більшу ніж стовп нагрітих газів тих же розмірів. Різницю тиску стовпів зовнішнього повітря і нагрітих газів можна підрахувати з рівняння: Р = Нпов - Нг = Н(пов - г), деР - напір; Н - висота стовпа.У верхній частині приміщення тиск вищий, ніж тиск у нижній: Рв Рн., причому Рн плавно переходить у Рв.Площина, для якої тиск дорівнює тиску назовні називається нейтральною зоною
hн
=
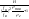 ; hв
=
; hв
=
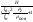 .fв
та fн
– площини верхніх та нижніх отворів.
Коефіцієнт
надлишку повітря - це відношення
фактичної секундної масової витрати
повітря до теоретично необхідної
секундної масової витрати повітря:
=
.fв
та fн
– площини верхніх та нижніх отворів.
Коефіцієнт
надлишку повітря - це відношення
фактичної секундної масової витрати
повітря до теоретично необхідної
секундної масової витрати повітря:
=
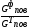 .Теоретично необхідна секундна масова
витрата повітря:Gтпов
= vмFпVоповпов,
деvм
- приведена масова швидкість вигоряння,
кг/с;Vопов
–об’єм
повітря, теоретично необхідний для
повного згоряння 1 кг горючої речовини,
м3/кг.Фактична
секундна масова витрата повітря:Gфпов
= vFпрпов,
де -
коефіцієнт витрати повітря крізь
отвір;v - швидкість потоку у нижньому
отворі, м/с;Fпр-
площа нижнього отвору (площа пройми),
м.
.Теоретично необхідна секундна масова
витрата повітря:Gтпов
= vмFпVоповпов,
деvм
- приведена масова швидкість вигоряння,
кг/с;Vопов
–об’єм
повітря, теоретично необхідний для
повного згоряння 1 кг горючої речовини,
м3/кг.Фактична
секундна масова витрата повітря:Gфпов
= vFпрпов,
де -
коефіцієнт витрати повітря крізь
отвір;v - швидкість потоку у нижньому
отворі, м/с;Fпр-
площа нижнього отвору (площа пройми),
м.
86. Поширення горіння по поверхні рідини. Фактори, від яких залежить швидкість поширення полум’я.Тепло від зони горіння поширюється конвекцією, теплопровідністю i тепловипромінюванням. Основну роль за сучасними уявленнями грає тепловипромінювання.Таким чином, швидкість поширення полум'я по поверхні рідини визначається швидкістю прогріву поверхні рідини під дією в-основному променевого потоку. Залежить ця швидкість від природи рідини i від початкової температури її поверхні і досягає досить великих значень. Від кількох мм/с для дуже холодних високо киплячих рідин, таких як мазут, до 3-4 м/с для теплих високолетючих, таких як діетиловий етер чи пентан.
90.Гасіння пожежі досягається зниженням до критичного значення концентрації горючої речовини, концентрації окисника або потужності джерела запалювання. Для зниження цих параметрів до критичного значення застосовують вогнегасні засоби, які охолоджують зону горіння; розводять інертним газом реагуючі речовини; ізолюють реагуючі речовини від зони горіння або хімічно гальмують реакцію горіння. Як охолоджуючий засіб в основному застосовуються вода і водні розчини речовин, які покращують змочувальну здатність, морозостійкість і інші потрібні показники води, як інертні гази – карбон діоксид, азот, аргон.
92. Після спалахування i поширення полум'я на всю поверхню, встановлюється дифузійний режим вигоряння. Цей режим характеризують масовою i лінійною швидкостями.
Масовою швидкістю вигоряння (m) називається маса рідини, що вигоряє в одиницю часу з одиниці поверхні. Отже, ця швидкість вимірюється у кг/м2•с.Лінійною швидкістю вигоряння рідини (l) називається товщина її шару, який вигоряє в одиницю часу. Розмірність цієї швидкості - м/с .Масова і лінійна швидкість пов’язані між собою через питому густину: m = l • .
Швидкість вигоряння залежить від природи рідини і від умов спалювання: від початкової температури, діаметру резервуару або посудини, рівня рідини відносно краю резервуару, швидкості вітру.. При горінні суміші рідин в першу чергу згоряють легколетючі фракції.При горінні нафтопродуктів температура на поверхні поступово збільшується, бо спочатку вигоряють легколетючі фракції і випаровується вода, а потім вже горять важкіші фракції. Так, для дизпалива температура на поверхні поступово росте з 503 до 513 0К, а для мазуту з 473 до 613 0К.Діаметр резервуару. Для тракторного гасу (“керосина”) при збільшенні діаметру резервуару від 1 мм до приблизно 100 мм (10 см) швидкість падає. Чим більше діаметр резервуару, тим краще умови дифузії, тим більше число Re, яке відображає ступінь турбулізації. При D 1000 мм - 1300 мм (1 - 1,3 м) встановлюється розвинений турбулентний режим (Re 10000). Величина теплового потоку від полум’я стабілізується і швидкість вигоряння далі вже не міняється.Рівень рідини відносно верхнього краю.Горить тільки там, де пари горючої рідини змішуються з повітрям; над резервуаром і, іноді, у верхній його частині.Тому із зниженням рівня рідини, тобто із збільшенням відстані від поверхні рідини до верхньої кромки, швидкість вигоряння падає, може впасти навіть до нуля. Але це теоретично, бо, наприклад, для резервуару діаметром 5 м глибина затухання повинна складати 11 , а при діаметрі 11 м глибина затухання - 35 м.Вплив швидкості вітру.
95 . Перетворення більшості твердих речовин в продукти горiння в кінцевий фазі протікає в газовій зоні в дифузійному режимі.При горiннi твердих речовин змішуються повітря з продуктами термiчного пiролiзу речовини або продуктами її плавлення i випаровування.Тверді речовини вимагають для горiння більшої підготовки ніж рідини, а, тим паче, гази.
Горіння газів i рідин протікає обов'язково в гомогенному середовищі, горiння ж твердих речовин, в залежності від будови, може відбуватись за гомогенним, гомогенно-гетерогенним або тільки за гетерогенним механізмом. Основними її компонентами є геміцелюлози, целюлоза та лігнін.
Геміцелюлози - це суміш низькомолекулярних сахаридів (моносахаридів): пентозанів С5Н8О5, гексозанів С6Н10О6 і їх похідних: п’яти- та шестикарбонних карбонових кислот, лактонів і інших.Целюлоза - це високомолекулярний полісахарид загальної формули (С6Н10О5)m. Молекулярна маса целюлози складає більше 1500000.Лігнін - у хімічному відношенні найменш вивчений клас сполук. До складу лігніну входять здебільшого ароматичні молекули. Молекулярна маса лігнінів досягає кількох тисяч.В середньому суха деревина складається з 25% геміцелюлоз, 50% целюлози та 25% лігнінів.За елементним складом вона містить біля 50% вуглецю, 6% водню і 44% кисню. Деревина - матеріал пористий. .Горіння твердих речовин, не здатних переходити в газоподібні продукти розкладу або випаровування, теж розглядається як тління. Лiмiтуючою стадією такого процесу є дифузія кисню до розпеченої поверхні крізь шар газоподібних продуктів горiння.
98. Відміна металів у тому, що при горiннi утворюються не газоподібні СО2, Н2О i т.п., а оксиди металів. Серед останніх є легкоплавкі i навіть легкокиплячi а є дуже висококиплячi. Особливості їх взаємодії з розпеченою поверхнею металу дають особливості горiння - енергійно горить метал чи ні, утворюються при горiннi димоподiбнi продукти чи ні.По температурі кипіння метали розподіляють на летючі і нелетючі. Летючі закипають при температурах, не вищих 1500 0С. Якщо температура кипіння металу, нижча від температури плавлення його оксиду, то виникає ситуація, коли під кіркою твердого оксиду знаходиться рідкий метал, який починає інтенсивно випаровуватися. Пари металу легко виходять назовні, згоряють у повітрі і утворюють дрібні частинки твердого оксиду - дим. Найбільша частина парів металу згоряє біля самої поверхні, там, де пари металу стикаються з повітрям. Нелетючі метали мають температури кипіння за 2300 - 2500 0С, температури плавлення їх оксидів на кілька сот градусів нижчі. Наприклад, алюміній плавиться при 659 0С, а кипить при 2406 0С; оксид алюмінію (Аl2O3) плавиться при 2145 0С, а кипить при 3527 0С. Що буде при, припустимо, 2300 0С? Алюміній вже розплавився, але ще не закипів, до кипіння ще не вистачає 106 0С. Оксид теж вже розплавився. Отже, і алюміній і його оксид знаходяться у рідкому стані. А рідини дуже щільно зчеплені між собою, енергійного горіння не буде. Такі метали енергійно горять лише у стані дрібного пилу; диму при горінні такі метали не дають.Є ще третій тип металів, ті, в яких оксид металу добре розчиняється в рідкому металі; при застиганні суміші метал і оксид не розшаровуються. а утворюють так званий твердий розчин. Метал, вигоряючи, утворює порожнини, крізь які легко дифундує повітря. Диму при горінні таких металів (наприклад титану) немає.
99. В-основному це вода і водні розчини.
Застосуванню води, як засобу гасіння пожеж, сприяють її властивості і її поширеність. Основним достоїнством, основною перевагою води є велике значення теплоти її випаровування – більше 2200 кДж/кг (2236). Випаровуючись, кожен кг води забирає від зони горіння або від охолоджуваного матеріалу більше 2200 кДж тепла. Крім того, і просто нагріваючись до певної температури, вода забирає помітну кількість тепла. Теплоємність води складає 4,18 (точніше 4,187) кДж/кг•град.; це означає, що кожен кг води при нагріві тільки на 1оС забирає більше 4 кДж теплоти.
Крім охолоджуючого ефекту, вода впливає і як ізолюючий засіб. 1 кг рідкої води займає об’єм 1 л, а 1 кг водяної пари – 1700 л.В річній, озерній, джерельній, артезіанській воді вміст натрій хлориду у більшості випадків не перевищує 0,5%. У морській воді її до 3,0 – 3,5%Переваги.Має велику теплоту випаровування і відносно велику теплоємність, в результаті чого відводить тепло скоріше і з більшою ефективністю ніж будь-який інший засіб.Широко розповсюджена і має невелику вартість.При транспортуванні не вимагає якихось запобіжних заходів захисту: випадкові виливи води ні до яких негативних наслідків не приводять. У вигляді струменю може подаватися на досить великі відстані, не вимагаючи обов’язкового наближен-ня персоналу до зони горіння.Має задовільну проникаючу здатність у місця, які важкодоступні для інших засобів, наприклад для порошків.Не отруйна і у більшості випадків хімічно нейтральна.Дає змогу за допомогою насосів великого тиску передавати на значні відстані енергію для руйнування певних конструкцій з метою забезпечення доступу до осередку горіння.Змочування водою.
Недоліки води, як гасячого засобу.- Вода не гасить пожежі рідких легколетючих сполук, температура кипіння яких нижча за 80 -–90оС.- Усе-таки існують речовини, які з водою реагують або, змішуючись, виділяють велику кількість тепла .- Вода має досить високу температуру застигання - 0оС, а пожежі треба гасити і зимою.- При застиганні, вода, на відміну від органічних рідин, суттєво збільшує об’єм, на 9%. - Збитки, які потужний струмінь води завдає будівлям, приміщенням, цінному майну і т.п., можуть досягати великих розмірів.
- Деревина, папір, тканина і деякі інші матеріали адсорбують і утримують велику кількість води, в результаті чого стають дуже важкими.
- Жирні поверхні, поверхні пилу гуми, пилу бурого вугілля і деякі інші погано змочуються водою і погано пропускають її всередину.
Повністю забороняється використовувати воду для гасіння:
- легких металів, внаслідок небезпеки утворення гримучого газу (суміші водню з киснем);
- карбідів металів, внаслідок небезпеки утворення ацетилену;
- металоорганічних сполук, внаслідок утворення горючих вуглеводнів;
100. Якщо теплозйом, розсіювання тепла з якихось причин буде меншим, ніж виділення тепла реакції, надлишок теплоти буде залишатися в системі і розігрівати її, тобто в системі почне підвищуватися температура. Якщо в ході такого самонагрівання буде досягнуто температуру самоспалахування, то самонагрів приведе до появи полум’я, до горіння.Температурою самонагрівання називається найнижча температура речовини (матеріалу, суміші), при якій виникає її самонагрівання.Речовини, які мають температуру самонагрівання, нижчу за 500С, умовно виділені в окрему групу - групу пірофорних речовин.Процес виникнення горіння в результаті самонагрівання називається самозайманням Отже, самозайманням називається займання в результаті самоініційованих екзотермічних процесів.В залежності від причини виділення тепла в початковій фазі самонагрівання речовин, розрізняють теплове, мікробіологічне та хімічне самозаймання. Самонагрівання - це процес, що починається при відносно низькій температурі і протікає з виділенням тепла, кількість якого перевищує кількість тепла, що відводиться. Самонагрівання веде до поступового збільшення температури в системі від температури самонагрівання до температури самоспалахування. Температурою самонагрівання називається найнижча температура речовини, матеріалу, суміші, при якій починається їх самонагрівання.
102.
Ізомерами називаються речовини, які мають однаковий якісний і кількісний склад, але відрізняються хімічною будовою і відповідно мають різні хімічні властивості.Ізомерних одна одній речовин може бути не дві, а більше: три , чотири, десять, двадцять; особливо, коли у молекулі багато атомів, та ще й атомів різних елементів. Чим більша маса органічної речовини, чим більше атомів у її молекулі - тим більше ізомерів вона має.
103. Самонагрівання - це процес, що починається при відносно низькій температурі і протікає з виділенням тепла, кількість якого перевищує кількість тепла, що відводиться. Самонагрівання веде до поступового збільшення температури в системі від температури самонагрівання до температури самоспалахування. Температурою самонагрівання називається найнижча температура речовини, матеріалу, суміші, при якій починається їх самонагрівання. . Самонагрівання - це процес, що починається при відносно низькій температурі і протікає з виділенням тепла, кількість якого перевищує кількість тепла, що відводиться. Самонагрівання веде до поступового збільшення температури в системі від температури самонагрівання до температури самоспалахування. Температурою самонагрівання називається найнижча температура речовини, матеріалу, суміші, при якій починається їх самонагрівання.
104. Тепло від зони горіння поширюється конвекцією, теплопровідністю i тепловипромінюванням. Основну роль за сучасними уявленнями грає тепловипромінювання.Таким чином, швидкість поширення полум'я по поверхні рідини визначається швидкістю прогріву поверхні рідини під дією в-основному променевого потоку. Залежить ця швидкість від природи рідини i від початкової температури її поверхні і досягає досить великих значень. Від кількох мм/с для дуже холодних високо киплячих рідин, таких як мазут, до 3-4 м/с для теплих високолетючих, таких як діетиловий етер чи пентан
105. При класифікації органічних сполук обрано два підходи: за карбоновим кістяком і за функціональними групами.
Найпростіші сполуки кожного ряду - це сполуки класу вуглеводнів, де до складу входять тільки карбон та гідроген. До класу вуглеводнів можуть входити речовини будь-якого ряду, за винятком, зрозуміло, гетероциклічних. Ряд - це сукупність сполук, що мають однакову будову вуглецевого кістяка і, отже, володіють набором певних спільних властивостей. Клас - це сукупність сполук, що мають одну і ту ж функціональну групу і, отже, також володіють набором певних спільних властивостей.Сполуки одного класу і одного ряду відрізняються між собою на групу СnH2n. Такі сполуки мають подібні хімічні властивості, але по фізичним, біологічним і деяким іншим відрізняються. Називають такі сполуки гомологами.Ряд сполук, що відносяться до одного класу і одного ряду називається гомологічним рядом.Усі гомологи мають спільну загальну формулу і відрізняються один від одного на певну кількість груп СН2.
Скажімо, метан СН4 і бутан С4Н10 , який можна записати як СН3 - (СН2 - СН2 - СН2) - Н, відрізняються на 3 групи СН2.
Те саме з оцтовою і масляною кислотами: СН3 - СООН і С3Н7 - СООН, або СН3 - (СН2)2 - СООН. Загальна формула метану і бутану, як і усіх насичених вуглеводнів СnH2n+2 , в метану n = 1, а в бутану n = 4. Загальна формула карбонових кислот СnH2n+1COOH, в оцтової кислоти n = 1, а в масляної - n = 3.З класифікацією пов’язана і номенклатура, тобто правила найменування органічних речовин, принципи їх найменування. В наш час найчастіше вживають три номенклатури.Історично, перша з них - це емпірична. Раціональна номенклатура - речовини називали за першим членом гомологічного ряду. Метилетилен СН3 - СН = СН2 , етилетилен С2Н5 - СН = СН2 , метилацетилен СН3 - С = СН і т.д. Система викликала багато плутанини, бо для трохи складніших сполук вимагала користуватися різними неоднозначними приставками: ізо- , втор.- , трет.- , нео- і масою інших.
Систематична номенклатура, запропонована ще у 1892 р. і доповнена на конгресі хіміків у 1957 р.; так звана Женевсько-Льєжська.
У відповідності з цією номенклатурою у кожній сполуці слід шукати найдовший карбоновий ланцюг і нумерувати його, починаючи з того кінця, де є розгалуження або замісники.
Коренем назви треба обирати назву вуглеводню з відповідною цьому найдовшому ланцюгу кількістю атомів карбону. Решта груп, у тому числі карбоновмісні, розглядаються як замісники біля атому карбону з відповідним номером.
106. Тепловим називається самозаймання, яке викликане самонагріванням, що спричинене зовнішнім нагрівом речовини (матеріалу, суміші) вище температури самонагрівання.До теплового самозаймання мають нахил багато речовин і матеріалів, особливо це стосується пірофорів.До найбільш поширених відносяться масла й жири, кам’яне вугілля, сульфіди заліза, білий фосфор, фосфін, порох деяких металів, деякі органічні речовини, як прості, так і складні.Свіжі мінеральні масла до самозаймання не здатні. Відпрацьовані мінеральні масла за пожежонебезпечністю стають подібними до рослинних масел та тваринних жирів.Рослинні масла і тваринні жири є естерами гліцерину і жирних кислот: сумішшю моногліцеридів, дигліцеридів і тригліцеридів. Спиртова частина їх усіх однакова – гліцерин:Масла ж, що складаються переважно з гліцеридів ненасичених кислот, становлять небезпеку. Для самозаймання жирів та масел необхідна наявність чотирьох факторів.1. Вміст в маслі або жирі значної кількості ненасичених гліцеридів.2. Велика поверхня окиснення масел та жирів при малій тепловіддачі.3. Просочування маслом або жиром якого-небудь горючого матеріалу.4. Певна ущільненість цього матеріалу.Гліцериди ненасичених кислот мають подвійні зв’язки. Тригліцерид ліноленової кислоти С3Н5(ОСОС17Н29)3 має їх аж 9 в одній молекулі, по три на кожний кислотний залишок. Подвійний зв’язок - зв’язок нестійкий. Реакції полімеризації і окислення йдуть вже при відносно низьких температурах. Кількість ненасичених зв’язків у маслі чи жирі характеризують йодним числом.Йодне число - кількість грамів йоду, що приєднується до 100 г жиру (поглинається ста г жиру) в певних умовах.Чим більше йодне число - тим більше масло схильне до самозаймання.Другий фактор, необхідний для реалізації самозаймання. Розвинена поверхня. Вона дає багато центрів реакції. Чим більша поверхня, тим більше кисню реагує з нею одночасно. Наявність третього фактору - заміна інертного матеріалу на горючий, який до того ж як правило має набагато нижчу теплоємність, ніж негорючий, створює кращі умови для накопичення тепла і збільшує ризик виникнення самозаймання.Що стосується останнього фактору, то найсприятливіші умови створюються, коли просочені маслом або жиром матеріали складають в купи, штабелі і т.п.
108 Флегматизуючі вогнегасячі засоби застосовуються при об’ємному гасінні, тобто тільки при ліквідації пожеж в огородженні; на складі ЛЗР, у приміщенні, в окремому відсіку, в трюмі, в реакторі і т.п.Механізм припинення горіння флегматизаторами, тобто нейтральними газами в-основному базується на законі діючих мас.Чим менша концентрація, тим з меншою швидкістю іде реакція. Зниження концентрації горючої речовини до значення, нижчого НКМПП, або концентрації кисню – до значення, нижчого кисневого індексу, зменшує швидкість поширення полум’я до 0, тобто припиняє горіння. Найбільше поширені діоксид вуглецю, азот і водяна пара. Дуже рідко, у спеціальних закладах, там, де неможливе використання жодного з перерахованих флегматизаторів, використовують аргон. Аргоном можна гасити горіння будь-яких речовин, але це – газ дорогий і не дуже доступний.Вуглекислий газ не можна застосовувати для припинення горіння лужних і лужноземельних металів, гідридів металів, металоорганічних сполук, розпеченого коксу і інших розпечених або тліючих речовин.Азот дорожчий ніж вуглекислий газ, тому у загальному випадку його застосовують там, де не можна застосовувати діоксид вуглецю, наприклад при гасінні розпечених органічних речовин, таких як кокс, ебоніт і подібних.
109. Самонагрівання вугілля спочатку буває загальним: по всій товщі, виключаючи поверхневий шар товщиною приблизно 0,5 м. Температуру 600С називають критичною.Ділянки самонагрівання вугілля зароджуються здебільшого на підкосах штабелю, на глибині в 0,5 м від поверхні і в 0,5 - 1,0 м від нижньої точки. Самозаймання в-основному відбувається з тієї сторони, на яку припадає напір вітру. По схильності до самозаймання вугілля розділяють на дві категорії: А та Б. А - небезпечні, Б - стійкі. До категорії А відносять буре вугілля, кам’яне за винятком марки “Т”, а також суміш різних марок. До Б - антрацити і кам’яне вугілля марки “Т”.При зберіганні вугілля для попередження самозаймання застосовують в-основному два заходи:
1. Обмежують висоту штабелю;2. Ущільнюють вугілля в штабелі.Крім промаслених матеріалів і вугілля, до самонагрівання схильні деякі сульфіди. Найбільш поширені з них сульфіди заліза. Наприклад, пірит (сірчаний колчедан) реагує із сухим киснем:FeS2 + O2 = FeS + SO2 - 222,3 кДж, а ще краще з вологим: FeS2+7,5O2+H2O = Fe2(SO4)3+H2SO4 - 2771 кДж.Fe + H2S = FeS + H2 , але частіше утворення FeS каталізується киснем повітря:
2Н2S + O2 = 2H2O + 2S
Fe + S = FeS
FeS + S = FeS2
Попередження пожежі при роботі із сіркою, сірководнем та його солями зводиться до попередження утворення сульфіду або до окислення сульфіду в присутності води.
111. Горіння проходить через утворення активних частинок – вільних радикалів. Якщо більшість таких частинок вилучити з процесу, він далі розвиватиметься набагато повільніше.Активні частинки за короткий проміжок часу встигають перетворитися у нові сполуки самі і передати імпульс перетворення (вільну валентність) далі Хімічно активний інгібітор звичайно вводиться у зону горіння у кількості 2-3% від об’єму цієї зони, тобто у кількості, у 20-30 разів меншій, ніж потрібна для гасіння такої ж пожежі кількість інертного газу.Найбільш типовими інгібіруючими засобами є вуглеводні, в яких один або декілька атомів гідрогену замінено на галогени, тобто галогеновуглеводні. Чим більше атомів галогену у молекулі, тим більша вогнегасяча здатність сполуки. Дія галогенів нерівноцінна: чим більша атомна маса цього елементу, тим вища його ефективність; так що вона підвищується у ряді: F Cl Br I.
С2Н3Вr3 С2Н3Вr2• + Вr•
Вr• + С2Н5• С2Н5Вr
С2Н3Вr2• + Н• С2Н4Вr2 .
Активні частинки СН3•, Н•, ОН• і інші реагують безпосередньо з молекулами хладону, відриваючи один з атомів галогену, наприклад:
F F F F
СН3• + Br-C-C-Br СН3Вr + •C-C-Br.
F F F F
115. речовини, які схильні самонагріватися на повітрі, - це фосфор білий (жовтий), фосфін, порох деяких металів (цинк, магній, алюміній), карбіди.Білий фосфор, особливо в тонкому шарі, інтенсивно окислюється при звичайній температурі приміщень. Окиснення супроводжується самонагріванням і займанням з утворенням білого диму п’ятиоксиду фосфору:4Р + 5О2 = 2Р2О5 - 3100,6 кДжЗберігати і розрізати фосфор слід під водою.
Типові метали теж легко реагують з киснем. Карбіди металів пожежну небезпеку складають не тільки тому, що, реагуючи з водою, дають ацетилен. Можливі і прямі реакції з киснем:
Li2C2 + 2,5 O2 = Li2O + 2CO2, карбіди найбільш типових металів, починаючи вже з літію (тобто Li, Na, K і т.д.), горять навіть в атмосфері вуглекислого або сірчистого газу.
116. Тверді речовини, подрібнені до часток розміром 100 мікрон i менше, можуть знаходитись в двох станах. Пил, що знаходиться в станi осаду, називається аерогелем (пил-гель), а пил, що висить у повітрі - аерозоль.Аерозоль більш небезпечний ніж аерогель.З властивостей, що характеризують аерозоль, найбільш важливими є дисперсність, хімічна активність, адсорбційна здатність та схильність до електризації.Дисперсність - це ступінь подрібненості часток пилу. Визначається дисперсність, як величина, зворотна найбільш визначному розміру. Якщо маємо кубик - то довжині його ребра, якщо кульку - то діаметру. Таким чином, ступінь дисперсності n = 1/D, або n = 1/a, де а - характерний розмір. Хімічна активність - це здатність пилу вступати в реакції з іншими речовинами, у тому числі в реакції окислення та горіння. Адсорбційна здатність - це здатність до поглинання газів та рідин поверхнею речовини. Із збільшенням ступеню дисперсності збільшується питома поверхня частинок пилу і відповідно відношення Sпит = S/V. Температура самоспалахування пилу залежить від його стану: гель чи золь.Для аерозолю температура самоспалахування вища ніж для відповідного аерогелю на 400 - 500 а то i більше градусівАерогелі здатні до займання і самозаймання. Важливою характеристикою аерогелів є температура тління. Температурою тління називається та найнижча температура, при якій на окремих дільницях з’являється тління.
117. Головною компонентою вогнегасячих композицій на основі вогнегасних порошків є солі металів, здебільшого карбонати та бікарбонати натрію, фосфати натрію та калію, хлорид калію, квасці, оксид кремнію, фосфат амонію і інші.. Оптимальні розміри частинок вогнегасячих порошків – 15-20 мкм. Вогнегасячі порошкові склади частіше за все містять не одну сіль а більше. До складу цих композицій входять також модифікуючі добавки, які забезпечують гідрофобність і текучість композиції, а також знижують схильність до комкування. Вогнегасячі порошкові композиції умовно поділяють на дві групи: порошки загального призначення і спеціальні порошки. Перші призначені для гасіння в-основному пожеж органічних матеріалів: нафти, бензину, гасу, деревини, пластмас і т.п. Спеціальні порошки призначені для припинення горіння металів, металоорга-нічних сполук і т.п. Гасіння порошками при горінні металів вірогідно іде за іншим механізмом. Метали горять на поверхні, або безпосередньо біля неї. Температура горіння металів висока настільки, що розплавляє сіль вогнегасячого порошку і розплавлений шар цієї солі створює на поверхні металу захисну плівку. Механізм інгібірування – основний, але не єдиний механізм дії цих вогнегасних засобів. В залежності від типу порошку, дія за одним з “побічних” механізмів може навіть переважати дію за механізмом інгібірування.
118. Мікробіологічним називається самозаймання в результаті самонагрівання, яке спричинене життєдіяльністю мікроорганізмів в масі речовини (матеріалу, суміші).Особливо здатні до мікробіологічного самозаймання вологі рослинні матеріали: торф, недосушене сіно, старе листя, хлопок, тирса.Крім мікроорганізмів, що “працюють” при температурі 10 - 20 - 40 0С, є й такі, що викликають підвищення її до 60 - 70 0С. При цій температурі вже прискорюються реакції прямого окиснення. Крім того, деякі органічні високомолекулярні сполуки при 60 - 70 0С вже обвуглюються.Обвуглення - це процес, при якому речовина губить невуглецеві складові частини своєї молекули. Наприклад, цукроподібні речовини (вуглеводи) лишаються без молекул води: CH2-CH-CH-CH-CH-C=O = C6 + 6H2O; OH OH OH OH OH H
Сумарна дія обох процесів: самонагрівання за рахунок окиснення рослинних чи інших органічних залишків і адсорбція - піднімають температуру ще вище, до приблизно 2000С. При такій температурі клітковина, що входить до складу рослинних матеріалів, розкладається.
121. Хімічне самозаймання.
Хімічним називається самозаймання в результаті самонагрівання, що виникло під дією хімічної взаємодії речовин.При контакті з водою лужних металів і їх гідридів утворюється гідроксид металу і виділяється водень. Так як реакція екзотермічна, водень займається:2Na + 2H2O=2NaOH + H2
KH + H2O = KOH + H2 Карбіди металів реагують з водою з виділенням в-основному ацетилену; і теж екзотермічно. Карбіди лужних металів при контакті з водою вибухають. Утворюються гідроксиди металів, а вуглець виділяється у вільному стані:2Li2C2 + 2H2O + O2 = 4LiOH + 4C
Силіциди - сполуки металів з кремнієм - при контакті з водою теж утворюють гідроксиди металів. Другим продуктом тут є кремневодень (силан): Mg2Si + 4H2O=2Mg(OH)2 + SiH4Приблизно так само взаємодіє з водою фосфід кальцію, виділяючи фосфін:Ca3P2 + 6H2O=3Ca(OH)2 + 2PH3
Фосфін сам по собі не займається, але разом з ним при реакції утворюється деяка кількість дифосфіну:Са3Р2 + 6Н2О=3Са(ОН)2 + Р2Н4 + Н2 Негашене вапно (СаО) при взаємодії з водою горючих газів не виділяє:СаО + Н2О=Са(ОН)2 Але, якщо води небагато, то СаО розігрівається аж до свічення. До активних відновників належать спирти, цукор, гліцерин і інші. До сильних окисників - стиснений кисень, галогени, нітратна кислота, пероксиди натрію та барію, хромовий ангідрид, перманганат калію, діоксид свинцю, селітри - солі азотної кислоти, хлорати, перхлорати, хлорне вапно і інше. При контакті з відновниками окисники викликають самоспалахування останніх.Гліцерин, перемішаний із сухою марганцівкою самоспалахує за декілька секунд:5CH2OH-CHOH-CH2OH + 14KMnO4 = 7K2CO3 + 8MnCO3 + 6Mn(OH)2 + 14H2O
Стислий кисень особливо чутливий до масла та жиру. Галогени особливо небезпечні при дії сонячного та штучного ультрафіолетового світла. З воднем, метаном, іншими вуглеводнями при опроміненні таким світлом галогени вступають в ланцюгову реакцію заміщення.
Згоряти в атмосфері галогену можуть і інші сполуки, наприклад діетиловий етер:
С2Н5ОС2Н5 + 4F2 = 8HF + 4C + Н2О
