
- •Контрольна робота
- •2. Класифікація глікозидаз, їх промислове значення.
- •3. Ацетіл – КоА та піровиноградна кислота як універсальні конструктивні та енергетичні метаболіти.
- •2. Загальне уявлення про механізм дії ферментів, активний центр ферменту.
- •3. Анаеробний розклад вуглеводів, гліколіз, глікогеноліз, енергетика анаеробного
- •3. Взаємозв`язок між обміном вуглеводів та жирів.
2. Загальне уявлення про механізм дії ферментів, активний центр ферменту.
Механізм дії ферментів може розглядатися з двох позицій: з точки зору зміни енергетики хімічних реакцій і з точки зору подій в активному центрі.
Будь-які хімічні реакції відбуваються, підпорядковуючись двом основним законам термодинаміки: закону збереження енергії та закону ентропії. Згідно з цими законами, загальна енергія хімічної системи та її оточення залишається постійною, при цьому хімічна система прагне до зменшення впорядкованості (збільшення ентропії). Для розуміння енергетики хімічної реакції недостатньо знати енергетичний баланс початкових та кінцевих реагентів, необхідно враховувати зміни енергії в процесі даної хімічної реакції і роль ферментів у динаміці цього процесу. Розглянемо реакцію розкладу вугільної кислоти:
Н2СО3 → Н2О + СО2.
Вугільна кислота є слабкою; реакція її розкладу відбувається за звичайних умов, якщо молекули вугільної кислоти мають енергію, що перевищує певний рівень, який називається енергією активації Еа

Зміни вільної енергії під час розкладання вугільної кислоти
Енергією активації називають додаткову кількість кінетичної енергії, необхідну молекулам речовини для того, щоб вони вступили в реакцію.
Після досягнення цього енергетичного бар’єру в молекулі відбуваються зміни, що викликають перерозподіл хімічних зв’язків і утворення нових сполук. Говорять, що молекули, які володіють Еа, знаходяться у перехідному стані. Різницю енергій між вихідним реагентом Н2СО3 і кінцевими сполуками Н2О і СО2 називають зміною вільної енергії реакції ΔG. Молекули Н2О і СО2 – більш стабільні ніж Н2СО3, тобто вони володіють меншою енергією і за звичайних умов практично не реагують. Виділена в результаті цієї реакції енергія розсіюється у вигляді тепла в оточуючому середовищі.
Чим більше молекул володіє енергією, що перевищує рівень Еа, тим вищою є швидкість хімічної реакції. Підвищити швидкість хімічної реакції можна нагріванням. При цьому збільшується енергія реагуючих молекул. Але для живих організмів високі температури є згубними, тому в клітині для прискорення хімічних реакцій використовуються ферменти. Ферменти забезпечують високу швидкість реакцій за оптимальних умов, що існують у клітині, шляхом зниження рівня Еа. Таким чином, ферменти знижують висоту енергетичного бар’єру, в результаті зростає кількість реакційноздатних молекул, отже, збільшується швидкість реакції.
У механізмі ферментативного каталізу вирішальне значення має утворення нестійких проміжних сполук – ферментсубстратного комплексу ES, що піддається перетворенню в нестабільний перехідний комплекс ЕР, який практично миттєво розпадається на вільний фермент і продукт реакції.
Таким чином, біологічні каталізатори (ферменти) не змінюють вільну енергію субстратів і продуктів і тому не змінюють рівновагу реакції.

Зміна вільної енергії під час хімічної реакції, що каталізується і не каталізується ферментами. Фермент знижує енергію активації Еа, тобто знижує висоту енергетичного бар’єру, в результаті зростає частка реакційноздатних молекул, отже, збільшується швидкість реакції.
Фермент, виконуючи функції каталізатора хімічної реакції, підпорядковується загальним законам каталізу і володіє усіма властивостями, характерними для небіологічних каталізаторів, але має й відмінні властивості, пов’язані з особливостями будови ферментів.
Схожість ферментів з небіологічними каталізаторами полягає в тому, що:
· ферменти каталізують енергетично можливі реакції;
· енергія хімічної системи залишається постійною;
· під час каталізу напрямок реакції не змінюється;
· ферменти не витрачаються в процесі реакції.
Відмінності ферментів від небіологічних каталізаторів у тому, що:
· швидкість ферментативних реакцій вища, ніж реакцій, що каталізуються небілковими каталізаторами;
· ферменти володіють високою специфічністю;
· ферментативна реакція відбувається в клітині, тобто за температури 37 ºС, постійного атмосферного тиску й фізіологічного значення рН;
· швидкість ферментативної реакції може регулюватися.
Етапи ферментативного каталізу
Формування ферментсубстратного комплексу. Той факт, що ферменти володіють високою специфічністю, дозволив у 1890 р. висунути гіпотезу, згідно якої активний центр ферменту є комплементарним до субстрату, тобто відповідає йому як «ключ замку». Після взаємодії субстрату («ключ») з активним центром («замок») відбуваються хімічні перетворення субстрату на продукт. Активний центр при цьому розглядався як стабільна, жорстко детермінована структура.
У 1959 р. був запропонований інший варіант гіпотези «ключ-замок», що пояснює події у активному центрі ферменту. За цією гіпотезою активний центр є гнучкою структурою по відношенню до субстрату. Субстрат, взаємодіючи з активним центром ферменту, викликає зміну його конформації, призводячи до формування ферментсубстратного комплексу, сприятливого для хімічної модифікації субстрату. При цьому молекула субстрату також змінює свою конформацію, що забезпечує вищу ефективність ферментативної реакції. Ця «гіпотеза індукованої відповідності» пізніше отримала експериментальні докази.
Послідовність подій під час ферментативного каталізу. Процес ферментативного каталізу умовно можна розділити на наступні етапи
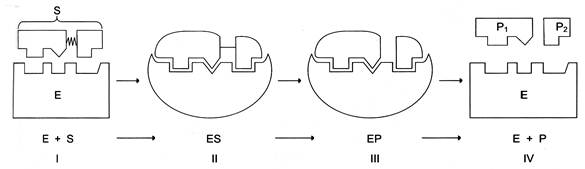
Етапи ферментативного каталізу: І – етап зближення й орієнтації субстрату відносно активного центру ферменту; ІІ – утворення ферментсубстратного комплексу (ES) в результаті індукованої відповідності; ІІІ – деформація субстрату й утворення нестабільного комплексу фермент - продукт (ЕР); IV – розпад комплексу (ЕР) з вивільненням продуктів реакції із активного центру ферменту і звільнення ферменту. Перший, другий і четвертий етапи каталізу є недовготривалими і залежать від концентрації субстрату (для першого етапу) та від констант зв’язування лігандів в активному центрі ферменту (для першого і третього етапів). Зміни енергетики хімічної реакції на цих етапах є незначними.
Третій етап найповільніший; його тривалість залежить від енергії активації хімічної реакції. На цій стадії відбувається розрив зв’язків у молекулі субстрату, утворення нових зв’язків і формування молекули продукту.
Роль активного центру у ферментативному каталізі. В результаті досліджень було показано, що молекула ферменту, як правило, у багато разів більша за молекулу субстрату, що піддається хімічному перетворенню цим ферментом. У контакт із субстратом вступає лише невелика частина молекули ферменту, звичайно від 5 до 10 амінокислотних залишків, що формують активний центр ферменту. Роль інших амінокислотних залишків полягає в забезпеченні правильної конформації молекули ферменту для оптимального перебігу хімічної реакції.
Активний центр на всіх етапах ферментативного каталізу не можна розглядати як пасивну ділянку для зв’язування субстрату. Це комплексна молекулярна «машина», що використовує різноманітні хімічні механізми, що сприяють перетворенню субстрату на продукт.
В активному центрі ферменту субстрати розміщуються таким чином, щоб задіяні в реакції функціональні групи субстратів знаходились безпосередньо близько одна від одної. Цю властивість активного центру називають ефектом зближення й орієнтації реагентів. Таке впорядковане розміщення субстратів викликає зменшення ентропії і, як наслідок, зниження енергії активації (Еа), що визначає каталітичну активність ферментів.
Активний центр ферменту також сприяє дестабілізації міжатомних зв’язків у молекулі субстрату, що полегшує перебіг хімічної реакції і утворення продуктів. Цю властивість активного центру називають ефектом деформації субстрату.
Субстрат взаємодіє з ферментом в певній частині, яка називається активним центром, або активною зоною ферменту.
Під активним центром, або активної зоною, розуміють ту частину молекули ферментного білка, яка з’єднується з субстратом (і кофакторами) і обумовлює ферментативні властивості молекули. Активний центр визначає специфічність і каталітичну активність ферменту і має представляти собою структуру певної міри складності, пристосовану для тісного зближення і взаємодії з молекулою субстрату або її частинами, безпосередньо беруть участь у реакції.
Серед функціональних груп розрізняють входять до складу « каталітично активного »ділянки ферменту і утворюють ділянку, що забезпечує специфічна спорідненість (зв’язування субстрату з ферментом) – так званий контактний, або« якірний »(або адсорбційний ділянка активного центру ферменту).
