
Metod_Medical_chem_1_Med_M-1
.pdf
4. Записують формулу визначення ступеня гідролізу:
|
|
h г = |
K г |
, |
|
де |
|
|
||
|
|
|
|
|||||||
|
|
|
|
|
C солі |
|
|
|
|
|
Ссол – молярна концентрація солі; |
|
|
|
|
||||||
hг – ступінь гідролізу. |
|
|
|
|
|
|
||||
5. Підставляють значення і обчислюють hг: |
|
|
|
|
||||||
hг = |
|
5,65×10−10 |
|
= 7,52×10 |
–5 |
або 7,52×10 |
–3 |
% |
||
|
|
|
|
|
||||||
0,1 |
|
|
|
|
|
|
|
|
||
6. Обчислюють концентрацію йонів Гідрогену за формулою:
[H + ] = 
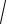 K гCсолі
K гCсолі
7. Підставляють значення і обчислюють [H+]:
[H+] = 
 5,65×10−10 ×10−1 =
5,65×10−10 ×10−1 = 
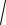 56,5×10−12 =7,52×10–6 моль/дм3.
56,5×10−12 =7,52×10–6 моль/дм3.
8.Підставивши значення [H+], обчислюють рН:
pH = –lg[H +]; pH = –lg7,52 ×10–6 = 6 – lg7,52 = 6 – 0,88 = 5,12
б) Задачі для самостійного розв’язання
1.Із поданого переліку написати в молекулярному та йонному вигляді рівняння гідролізу тих солей, які йому піддаються: калій ціанід, літій фосфат, хром(ІІІ) карбонат, калій нітрат, купрум(ІІ) хлорид, кальцій хлорид, калій сульфід, ферум(ІІ) сульфат, алюміній сульфід, амоній ацетат, ферум(ІІІ) хлорид, калій фосфат, натрій гідрогенфосфат. Вказати рН середовища.
2.Обчислити рН розчину, константу та ступінь гідролізу натрій карбонату в 0,1 М розчині.
Відповідь: рН = 11,7; Кг.= 2,2×10–4 ; hг = 4,7 %.
4. Матеріал для аудиторної роботи
Зміст і методика проведення заняття
4.1. Перелік практичних завдань, які необхідно виконати на практичному занятті:
–реакції з утворенням осаду;
–реакції з утворенням малодисоційованої сполуки;
–зміщення рівноваги в розчині амоніаку;
–умова утворення осаду;
–умови розчинення осадів в результаті хімічної взаємодії;
–вплив природи солі на реакцію середовища;
–вплив температури на ступінь гідролізу;
–вплив розведення на гідроліз солей;
–повний гідроліз.
41

4.2. Інструкції по виконанню практичних завдань
4.2.1. Вплив природи солі на реакцію середовища.
У 4 пробірки налити по 2–3 см3 розчинів Na2CO3, ZnSO4, NaCl і CH3COONH4. Дослідити реакцію середовища вказаних розчинів за допомогою універсального індикаторного папірця, розчинів метилового оранжевого і фенолфталеїну. Результати досліджень представити в таблиці.
|
|
|
|
|
Таблиця |
||
|
Забарвлення індикатора |
|
|
Величина |
|
||
Розчин |
універсальний |
|
|
Реакція |
|||
метиловий |
фенол- |
рН |
|||||
солі |
індикаторний |
середовища |
|||||
оранжевий |
фталеїн |
розчину |
|||||
|
папірець |
|
|||||
|
|
|
|
|
|
||
Na2CO3
ZnSO4
NaCl
CH3COONH4
Чи всі солі гідролізують? Скласти рівняння гідролізу в молекулярній та йонній формі.
4.2.2. Вплив температури на ступінь гідролізу.
У дві пробірки налити по 2–3 см3 розчину натрій ацетату і додати 2–3 краплі фенолфталеїну. Одну із пробірок з розчином нагріти до кипіння. Порівняти забарвлення холодного та гарячого розчинів. Охолодити пробірку під струменем води і спостерігати зміну забарвлення розчину. Пояснити спостереження та написати рівняння реакції.
4.2.3. Вплив розведення на гідроліз солей.
До 1–2 см3 розчину стибій(ІІІ) хлориду долити 2–3 см3 води. Пояснити причину випадання осаду. Написати рівняння реакції, беручи до уваги, що утворюється спочатку основна сіль Sb(OH)2Cl, яка розкладається з утворенням SbOCl, що випадає в осад.
4.2.4. Повний гідроліз.
До 3 см3 розчину алюміній хлориду або сульфату додають 3 см3 розчину натрій карбонату (пробірка № 1). Пробірку закрити корком з газовідвідною трубкою, яку опустити у пробірку з вапняною водою (пробірка № 2). Спостерігати утворення осадів в обох пробірках – аморфного у пробірці № 1 та кристалічного у пробірці № 2. З пробірки № 1 злити розчин над осадом, перенести осад у 2 пробірки та дослідити його на амфотерність, перевіряючи розчинність у кислотах і лугах. Написати всі рівняння реакцій.
5. Підведення підсумків та зарахування роботи
42
Заняття № 8
Тема: Буферні системи, класифікація та механізм дії. Приготування буферних розчинів. Визначення буферної ємності. Роль буферних систем в життєдіяльності організму
1. Актуальність теми
Одною з характерних властивостей внутрішнього середовища живих організмів є постійна концентрація Гідроген-іонів. Так величина рН сироватки крові рівна 7,4, шлункового соку біля одиниці; секрет підшлункової залози має кислотність 7,5 – 8 одиниць рН. Постійність значень рН біологічних рідин в організмі забезпечується дією ряду фізіологічних механізмів, а також буферними системами, основними з яких є білкова, гемоглобінова, фосфатна, карбонатна. Зміна рН біологічних рідин свідчить про проходження патологічних процесів, що може бути діагностичною ознакою деяких захворювань. Тому вивчення складу буферних систем, механізмів їх дії буде сприяти більш глибокому пізнанню біологічних процесів.
2. Навчальні цілі:
–знати суть поняття буферні системи, їх склад і типи та механізм їх дії;
–знати формули для розрахунку величини рН буферних систем;
–знати визначення поняття буферна ємність та вміти проводити розрахунки її величини;
–вміти проводити розрахунки, пов’язані з приготуванням буферних розчинів;
–вміти приготовляти буферні розчини та визначати величину їх рН.
.
3. Матеріали доаудиторної самостійної роботи
3.1. Засвоїти матеріал навчальної програми
Буферні розчини, їх класифікація. Рівняння Гендерсона-Гассельбаха. Механізм буферної дії.
Буферна ємність. Буферні системи крові. Бікарбонатний (гідрогенкарбонатний) буфер, фосфатний буфер. Білкові буферні системи. Поняття про кислотно-основний стан крові.
3.2.Блок інформації
Буферні розчини – це сумішки слабких кислот і їх розчинних солей або слабких основ та їх розчинних солей. рН буферного розчину залежить від Кд. Кислоти або основи та співвідношення концентрацій кислоти та солі і виражається рівнянням Гендерсона-Гассельбаха:
pH = pK − lg |
[кислоти] |
; |
pH = 14 − pK + lg |
[основи] |
; |
[солі] |
[солі] |
||||
|
|
|
43 |
|
|

(для кислотного буфера) (для основного буфера)
Крім величини рН, буферні розчини характеризуються буферною ємністю, що являє собою кількість моль-еквівалентів сильної кислоти або лугу, яка може змінити на одиницю рН 1 дм3 буферного розчину. Буферну ємність розраховують за формулою:
В = C × V1 ×1000 , де V2 × DpH
V1 – об’єм титранта; V2 – об’єм буферного розчину.
Буферна ємність залежить від концентрації компонентів буферної системи, а також від їх співвідношення, причому оптимальним є співвідношення 1:1.
До біологічних буферних систем відносяться:
а) фосфатна – NaH 2PO4 + Na2HPO4;
б) гідрогенкарбона – NaHCO 3 + CO2;
в) білкова – Prt(NH 2)COOH;
г) гемоглобінова – H Hb + KHb,
які допомагають підтримувати величину рН біорідин у певних межах.
3.3. Література
1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія.– Вінниця: НОВА
КНИГА, 2006.– С.161–176.
2. Мороз А.С., Ковальова А.Г. Фізична та колоїдна хімія. – Львів: Світ,
1994.– С. 60–67.
3. Содовничая А.П. і співавтори. Биофизическая химия. – К.:Вища школа,1986. – гл. II
3.4. Матеріали для самоконтролю
а) Дати письмові відповіді на контрольні запитання.
1.Що таке буферна система, які є типи буферних систем? Назвіть приклади найважливіших буферних систем і наведіть їх склад.
2.Поясніть механізм дії фосфатної буферної системи.
3.Виведіть рівняння Гендерсона-Гассельбаха для розрахунку концентрації йонів Н+ та рН на прикладі гідрогенкарбонатного буфера. Від яких факторів залежить величина рН буферних систем?
4.Поясніть вплив розведення та додавання розчинів сильної кислоти або лугу на величину рН буферної системи.
5.Буферні системи крові, їх склад, механізм дії та біологічне значення.
6.Що таке буферна ємність? Від яких факторів вона залежить? Наведіть рівняння для розрахунку буферної ємності за кислотою та лугом.
7.Які буферні системи крові мають найбільшу буферну ємність і чому?
б) Задачі для самоконтролю.
44
1. Алгоритми розв’язування типових задач
Задача 1. Розрахувати об’єми 0,1 М розчинів СН3СООН і СН3СООNа, які необхідно змішати, щоб приготувати 200 см3 буферного розчину з рН = 5,24.
Алгоритм розв’язання |
|
|
|
|
|
|
||||
1. Коротко записати умову задачі. |
|
|
||||||||
Дано: |
|
2. Обчислити [H+] в буферному розчині: |
||||||||
C(CH3COOH)= 0,1 моль/дм3 |
|
[H+] = alg(–5,24) = 5,76 ×10–6 |
|
моль/дм3 |
||||||
C(CH3COONa)=0,1 моль/дм3 |
|
3. Записати формулу для розрахунку [H+]: |
||||||||
V(буферу) = 200 см3 |
|
[H+] = К |
Cк−тиVк−ти |
; |
||||||
рН = 5,24 |
|
|||||||||
|
|
|
|
|||||||
|
|
CсоліVсолі |
|
|
||||||
К(CH3COOH ) |
=1,75×10–5 |
|
|
|
|
|
|
|||
|
|
|
якщо Ск-ти = Ссолі , то |
|
|
|||||
|
|
|
||||||||
V(солі) – ? |
|
|
|
|||||||
|
[H+] = К(Vк-ти/Vсолі) |
|||||||||
V(кислоти) –? |
|
|||||||||
|
|
|
|
|
|
|
||||
4. Підставити значення і розрахувати об’єми, прийнявши, що: |
|
|
||||||||
|
|
|
Vк-ти = х, Vсолі = 200 – х |
|
|
|||||
|
[H+] = K × |
x |
; 5,76×10–6 =1,75×10–5 × |
x |
; |
|||||
|
|
|
|
|||||||
|
200 - x |
200 - x |
||||||||
200 – х = 3,038 · х; х = 200 : 4,038 = 50 см3 СН3СООН 200 – х = 200 – 50 = 150 см3 СН3СООNа
4.У випадку основного буферного розчину знаходять [H+] (як вказано вище), потім за йонним добутком води концентрацію [OH– ]:
[OH– ] = 10–14 / [H+] .
Позначивши через х об’єм основи, а через (V – x) об’єм солі, та знаючи константу дисоціації основи Кд, підставляємо їх у формулу для розрахунку
[OH– ] у цьому буфері: |
|
|
|
|
|||
[OH– ] = К× |
CоснVосн |
; |
якщо |
Сосн = Ссолі, то |
|||
|
|
||||||
|
CсоліVсолі |
|
|
|
|
||
[OH– ] = К× |
Vосн |
= K × |
|
x |
. |
||
V |
|
|
|||||
|
|
|
|
V - x |
|||
|
|
солі |
|
|
буф |
||
Звідси знаходимо об’єми основи і солі, необхідні для приготування основного буфера.
Задача 2. Розрахувати рН буферного розчину, одержаного при змішуванні 40
см3 |
0,1 М розчину |
Н СО та |
60 см3 0,1 |
М розчину NaHCO . |
|||
|
|
|
2 |
3 |
|
|
3 |
Константа йонізації Н2СО3 |
дорівнює 4,4×10–7 . |
|
|
||||
Алгоритм розв’язання. |
|
|
|
|
|
||
Коротко записати умову задачі. |
|
|
|
|
|||
Дано: |
|
1. |
Записати |
формулу |
для |
розрахунку |
|
С (Н2СО3) = 0,1 моль/дм3 |
|
концентрації [H+] у кислотному буфері: |
|||||
С(NaHCO )= 0,1 моль/дм3 |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
45 |
|
|
|

V (Н2СО3) = 40 см3 |
3 |
[H+] = К× |
Cк−тиVк−ти |
|
||||
V (NaHCO3) = 60 см |
CсоліVсолі |
|||||||
|
|
|
||||||
К1(Н2СО3 |
) = 4,4×10–7 |
|
|
|
||||
|
та підставити значення: |
|||||||
рН (буф. розчину) – ? |
||||||||
|
0,1×40 |
|
|
|||||
|
|
|
[H+] = 4,4×10–7 × |
= 2,93×10–7 моль/дм3 |
||||
|
|
|
|
|||||
|
|
|
0,1×60 |
|
|
|||
|
|
2. |
Провести розрахунок рН: |
|||||
рН = –lg[H +] = –lg(2,93 ×10–7 ) = –(lg2,93 + lg10 –7 ) = –(0,466 – 7) = 6,5
3.Для розв’язування такого типу задач можна використовувати рівняння Гендерсона-Гассельбаха для кислотного буфера:
рН = рК – lg Cк−тиVк−ти ; CсоліVсолі
якщо буфер основний, то:
рН = 14 – рК + lg CоснVосн .
CсоліVсолі
Задача 3. Розрахувати буферну ємність крові за кислотою і за лугом, якщо до 100 см3 крові для зміни рН:
1)від 7,36 до 7,00 потрібно додати 36 см3 0,05 М розчину хлоридної кислоти;
2)від 7,36 до 9,36 потрібно додати 14 см3 0,1 М розчину NaOH.
Алгоритм розв’язання |
|
|
|||
1. Коротко записати умову задачі: |
|
|
|||
Дано: 1) V(крові) = 100 см3 |
|
2) V(крові) = 100 см3 |
|||
|
V(HCl) = 36 см3 |
|
V(NaOH) = 14 см3 |
||
|
С (HCl) = 0,05 моль/дм3 |
|
С (NaOH) = 0,1 моль/дм3 |
||
|
М |
|
М |
||
|
DрН = 7,36 – 7,00 = 0,36 |
|
|
DрН = 9,36 – 7,36 = 2 |
|
|
Вк – ? |
|
Вл – ? |
||
2. |
Записати формули для розрахунку буферної ємності за кислотою і лугом: |
|||||||||||||
|
|
|
|
|
V |
|
C |
к−ти |
|
|
VлугуC лугу |
|||
|
|
|
Bк = |
к−ти |
|
; |
Bл = |
|
|
|
|
|||
|
|
|
|
|
DpH × Vбуф |
|||||||||
|
|
|
|
|
DpH × Vбуф |
|
||||||||
3. |
Підставивши значення, провести розрахунок: |
|
14 × 0,1 |
|
|
|||||||||
|
Bк |
= |
36 × 0,05 |
= 5×10–2 |
моль/дм3; |
Bл = |
= 7×10–3 моль/дм3 |
|||||||
|
|
|
||||||||||||
|
|
0,36 ×100 |
|
|
|
|
|
|
|
2 ×100 |
|
|
||
б) Задачі для самостійного розв’ язання
1.Розрахувати об’єми 0,2 М розчину NaH2PO4 та 0,1 М розчину Na2HPO4, необхідні для приготування 200 см3 буферного розчину, рН якого 7,38. Відповідь: 50 см3 і 150 см3.
2.Знайти рН буферного розчину, який виготовлено із 150 см3 0,02 М розчину
NH4OH та 200 см3 0,015 М NH4Cl.
46

Відповідь: рН=9,26.
3.Знайти буферну ємність плазми крові за кислотою і за лугом, якщо до 100 см3 плазми для зміни рН:
1)від 7,4 до 3,4 треба додати 10 см3 0,2 М розчину HCl;
2)від 7,4 до 9,4 треба додати 0,8 см3 0,1 М розчину NaOH.
Відповідь: Вк = 5 ммоль/дм3; Вл = 0,4 ммоль/дм3.
4. Матеріал для аудиторної роботи
4.1. Перелік практичних завдань, які необхідно виконати на практичному занятті:
–приготування 50 (100) см3 буферного розчину із заданою величиною рН;
–дослідження впливу розведення і додавання невеликих кількостей кислоти або лугу на значення рН буферного розчину;
–визначення буферної ємності сироватки крові.
4.2.Методики виконання практичних завдань
4.2.1. Приготувати 50 або 100 см3 буферного розчину, рН якого рівний – 3,9;
4,28; 6,4; 7,4; 8,7.
Для виконання даного завдання необхідно:
а) використовуючи дані таблиці, визначити оптимальний компонентний склад буферної суміші вказаного рН.
|
|
|
|
Таблиця |
|
Назва буферного |
Слабкий |
Сіль |
Константа йоні-зації |
Межі рН |
|
розчину |
електроліт |
кислоти (основи) |
|
||
|
|
|
|||
Ацетатний |
CH3COOH |
CH3COONa |
1,8×10–5 |
3,7-5,6 |
|
Карбонатний |
H2CO3 |
NaHCO3 |
4,3×10–7 |
5,5-7,4 |
|
Фосфатний |
NaH2PO4 |
Na2HPO4 |
6,3×10–8 |
6,2-8,2 |
|
Амонійний |
NH4OH |
NH4Cl |
1,8×10–5 |
8,4-10,3 |
|
a) перевести величину рН буферного розчину в концентрацію йонів водню, наприклад, рН = 4,28:
[H+]= alg(–pH) = alg(–4,28) = 5,25·10 –5 (моль/дм3).
б) використовуючи рівняння [H+] = К Cк−тиVк−ти ; розрахувати об’єми
CсоліVсолі
кислоти (х), солі (50 – х), необхідних для приготування, наприклад, 50 см3 буферного розчину. Згідно даних таблиці, для рН = 4,28 оптимальною буде ацетатна буферна суміш, тому для розрахунку використовуємо Кд(СН3СООН)= 1,8·10-5. Величину об’єму кислоти (х) розраховуємо за формулою:
+ |
x |
|
|
50 ×[H + ] |
|
50 × 5,25 ×10−5 |
|
[H ] = K × |
|
; |
x = |
|
= |
|
= 37,2 |
50 - x |
K д + [H + ] |
(1,8 + 5,25)×10−5 |
|||||
х = 37,2 см3 СН3СООН; 50 – 37,2 = 12,8 см3 CH3COONa
в) шляхом змішування вирахуваних об’ємів розчинів кислоти і солі виго47

товити буферний розчин.
г) перевірити рН виготовленого розчину за допомогою універсального індикатора або рН-метра.
4.2.2.Дослідження впливу розведення і додавання невеликих кількостей кислоти або лугу на значення рН буферного розчину.
а) у пробірку відміряють 1 см3 виготовленого буферного розчину і додають 9 см3 дистильованої води. Вимірюють рН до і після розведення буферного розчину за допомогою універсального індикатора
б) у дві пробірки відміряють по 10 см3 виготовленого буферного розчину. В першу додають 0,5 см3 0,1 М розчину HCl, в другу 0,5 см3 0,1 М розчину NaOH. Визначають рН одержаних розчинів. Зробити відповідні висновки
4.2.3. Визначення буферної ємності.
а). визначення буферної ємності сироватки крові за кислотою.
Уколбочку для титрування вносять 15 см3 сироватки крові і визначають величину рН. В другу таку ж колбочку відміряють 15 см3 контрольного розчину з відомим значенням рН.
Уобидві колбочки вносять по краплі відповідного індикатора, інтервал переходу якого захоплював би величину рН досліджуваного буферного розчину.
Титрують із бюретки досліджувану сироватку 0,1 М розчином НСl до одержання однакового забарвлення індикатора з контрольним розчином.
Розрахунок буферної ємності за кислотою проводять за формулою:
Bк = Vк−ти×Cк−ти ,
∆pH Vбуф
де Vк-ти і Cк-ти – об’єм і молярність розчину кислоти; Vбуф – об’єм буферного розчину;
DрН – різниця між значенням рН сироватки та контрольного розчину.
б) визначення буферної ємності сироватки крові за лугом.
Визначення проводять аналогічно, як у вище описаній методиці, але титрування проводять 0,1 М розчином калій гідроксиду.
Розрахунок буферної ємності за лугом проводять за формулою:
|
Bл = |
VлугуC лугу |
, |
|
∆pH × V |
||
|
|
буф |
|
де Vлугу і Cлугу – об’єм і молярність розчину лугу; |
|||
Vбуф – |
об’єм буферного розчину; |
|
|
DрН – |
різниця між значенням рН сироватки та контрольного розчину. |
||
5. Підведення підсумків та зарахування роботи
48
Заняття № 9
Тема: Кислотно-основне титрування. Вибір індикатора при титруванні сильних та слабких кислот лугом. Визначення кислотності шлункового соку
1. Актуальність теми
Титриметричний аналіз – один з методів кількісного аналізу, який завдяки простій методиці виконання, доступності необхідного лабораторного обладнання та точності одержуваних результатів – знайшов широке застосування в різних галузях хімії, біології і медицини. Без знання складу різних біологічних рідин живих організмів неможливі розуміння процесів, які в них відбуваються, а точні дані про їх склад дає можливість провести обґрунтовану діагностику та лікування. Тому оволодіння методикою титриметричного визначення має практичне значення для лікаря широкого профілю.
2. Навчальні цілі:
– знати теоретичні основи методу кислотно-основного титрування;
– знати методики проведення розрахунків у титрометричному аналізі;
– знати методики проведення стандартизації титрованих розчинів;
– вміти проводити вибір індикатора в методі нейтралізації;
– вміти проводити визначення кислотності шлункового соку.
3. Матеріали доаудиторної самостійної роботи
3.1. Засвоїти матеріал навчальної програми
Основи титриметричного аналізу. Методи титриметричного аналізу. Метод кислотно-основного титрування. Індикатори та їх вибір при різних
видах кислотно-основного тирування. Методи визначення точки еквівалентності та розрахунок вмісту досліджуваної речовини у препараті або в розчині.
3.2. Блок інформації
Титриметричний (об'ємний) аналіз – частина кількісного аналізу. Цей метод, на відміну від інших методів кількісного аналізу, дозволяє проводити кількісні визначення відносно швидко, не вимагаючи складної апаратури.
До методів нейтралізації відносять всі титриметричні методи аналізу, які грунтуються на реакції нейтралізації.
Основною реакцією в процесі нейтралізації є взаємодія йонів Н+ (Н3О+– гідроксонію) з йонами ОН– :
Н3О+ + ОН– → 2Н2О,
або спрощено
Н+ + ОН– → Н2О.
Якщо у реакції нейтралізації бкруть участь слабкі кислоти або основи чи солі, що здатні до гідролізу, процеси виявляються набагато складнішими. Так,
49
при взаємодії слабкої кислоти СН3СООН з сильною основою гідроксильні йони при нейтралізації кислоти можуть взаємодіяти як з молекулами оцтової кислоти, так і з йонами Н3О+:
CH3COOH + H2O → CH3COO– + H3O+
CH3COOH + OH– → CH3COO– + H2O
Н3О+ + ОН– → 2Н2О Точку кінця титрування (точку еквівалентності) в методі нейтралізації
визначають за допомогою кислотно-основних індикаторів. В якості яких найчастіше використовують наступні органічні барвники: метиловий оранжевий (інтервал переходу 3,1–4,1), фенолфталеїн (інтервал переходу 8,0– 10,0), лакмус (інтервал переходу 5,0–8,0).
Для правильного підбору індикатора в методі нейтралізації недостатньо знати лише інтервал переходу забарвлення індикатора, необхідні також дані про зміну рН розчину в процесі титрування. Цю залежність показує крива титрування.
Методи нейтралізації широко використовують у клінічних лабораторіях при визначенні кислотності шлункового соку, соку підшлункової залози, сечі, жіночого молока та інших біологічних рідин.
У санітарно-гігієнічних дослідженнях методи нейтралізації застосовують для визначення кислотності різноманітних харчових продуктів, при аналізі питної та стічної води, повітря.
3.3. Література
1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія.– Вінниця: НОВА
КНИГА, 2006.– С.313–336.
2. Алексеев В.Н. Количественный анализ.– Л.:Химия, 1980. 3. Глинка Н.Л. Общая химия.– Л.:Химия, 1985.
3.4. Матеріали для самоконтролю
а) Дати письмові відповіді на контрольні запитання.
1.В чому полягає процес титрування?
2.Які розчини називають титрованими?
3.Що називається точкою еквівалентності, точкою нейтральності? В яких випадках вони співпадають, а в яких ні?
4.Які реакції лежать в основі методів об’ємного аналізу? Вимоги, які ставляться до них.
5.На якому законі ґрунтуються обчислення в об’ємному аналізі?
6.Що таке кислотно-основні індикатори згідно теорії Оствальда?
7.Що називається інтервалом переходу забарвлення індикатора?
8.Що таке криві титрування і як за їх допомогою проводять вибір індикатора?
9.Які речовини можна визначити за допомогою методів нейтралізації (алкаліметрія, ацидиметрія)?
50
