
6. Етапи синтезу дочірніх ланцюгів молекул днк
Умовно механізм синтезу ДНК у Е. соli може бути розділений на три етапи: ініціацію –- початок; елонгацію –- подовження; і термінацію – завершення (припинення) синтезу. Етап І – ініціація біосинтезу ДНК –- є початком синтезу дочірніх нуклеотидних ланцюгів; у ініціації бере участь мінімум вісім різних ферментів і білків. Перша фаза - ферментативний біосинтез на матриці ДНК затравки олігорибонуклеотиду (праймера) з вільною гідроксильною групою біля С-3’ рибози (рис. 8.4.). При ініціації до ланцюгів ДНК послідовно приєднуються ДНК- зв’язуючі та ДНК розкручуючі –- білки, а потім комплекси ДНК-полімераз і ДНК –- залежна РНК –- полімераза (праймаза). Довжина цих праймерних ланцюгів складає в середньому від 10 до 200 нуклеотидів. Ініціація виступає єдиною стадією реплікації ДНК, яка дуже тонко і точно регулюється.
Етап ІІ – елонгація синтезу ДНК – включає стадію реплікації обох материнських ланцюгів ДНК та стадію зв’язування один з одним фрагментів, утворених ланцюгів ДНК. Елонгація синтезу ДНК відбувається за різними механізмами на лідируючому та відстаючому ланцюгах. Синтез лідируючого ланцюга починається з синтезу праймера (за участю праймази) з точки початку реплікації, потім до праймера приєднуються дезоксирибонуклеотиди під дією ДНК-полімерази III; далі синтез протікає безперервно, утворюючи ланцюг ДНК від РНК – праймера згідно кроку вилки реплікації.
С

Фрагменти кожен раз синтезуються роздільно, починаючи із синтезу праймера, який може переноситися з готового фрагмента, за допомогою одного з білкових чинників реплікації, в точку старту біосинтезу наступного фрагмента.
Після формування фрагментів Оказакі ДНК –полімераза І за рахунок своєї 5’-3’ – екзонуклеазної активності видаляє РНК – праймери і за рахунок 5’-3’- полімеразної активності заміщує їх фрагментами ДНК.
Етап ІІІ – термінація синтезу ДНК – наступає, коли вичерпана ДНК-матриця і трансферазні реакції припиняються. Точність реплікації ДНК надзвичайно висока, можлива одна помилка на 1010 трансферазних реакцій, проте подібна помилка, звичайно, легко виправляється за рахунок процесів репарації.
Елонгація завершується відокремленням олігорибонуклеотидних праймерів, об’єднанням окремих фрагментів ДНК за допомогою ДНК-лігаз і формуванням дочірнього ланцюга ДНК. Не можна виключити, однак, можливості зв’язаного і узгодженого механізму синтезу лідируючого і відстаючого ланцюгів ДНК за участю полімераз і всього комплексу праймасом. Етапи реплікації ДНК подані на рис.8.3.
Таким чином, у результаті дії комплексу реплікативних білків, зчитування інформації з двох материнських ланцюгів ДНК з антипаралельною спрямованістю (5’-3’ та 3’-5’, відповідно) супроводжується утворенням двох дочірніх ланцюгів з відповідними антипаралельними напрямками фосфодіефірних зв’язків (3’-5’ та 5’-3’ відповідно). Взаємодія комплементарних одного материнського та одного дочірного ланцюгів призводить до формування двох молекул ДНК, згідно напівконсервативного механізму реплікації.
8.1.4. Послідовність етапів та ферменти реплікації ДНК в еукаріотів. Реплікація ДНК у еукаріот, по суті аналогічна реплікації ДНК у прокаріот, має ряд особливостей. Наприклад, замість однієї точки реплікації в ДНК еукаріот є наявні специфічні точки „початку”, так звані автономно реплікуючі послідовності, (приблизно 300 нуклеотидних пар); у клітинах дріжджів таких елементів близько 400. Крім цього, швидкість руху вилки реплікації, у еукаріот (приблизно 50 нуклеотидів за секунду) майже в 10 разів менша, ніж у Е. соli.
Для реплікації ДНК геному людини із однієї-єдиної точки з подібною швидкістю потрібно було б більше 500 годин; натомість реплікація геному людини проходить в обох напрямах і одночасно із безлічі точок, залучаючи від 30 000 до 330 000 пар основ. Реплікація продовжується до тих пір, поки не будуть синтезовані дві дочірні молекули ДНК, в кожній з яких міститься один материнський ланцюг. Таким чином, множинність точок „початку” реплікації ДНК, найімовірніше, є загальним правилом для всіх клітин еукаріотів.
У реплікації ДНК еукаріот беруть участь такі типи полімераз ДНК - полімераз – α, β, γ, δ, і ε. ДНК-полімераза α складається з 4 субодиниць і є ідентичною за структурою та властивостями у всіх клітинах ссавців, причому одна з субодиниць має праймазну активність. Субодиниця ДНК-полімерази α (М. м. 180 000 Да) каталізує реакцію полімеризації, переважно синтез відстаючого ланцюга дезоксирибонуклеїнової кислоти. ДНК-полімераза δ складається з 2 субодиниць і переважно каталізує синтез лідируючого ланцюга ДНК. Основними ферментами,що відіграють основну роль у реплікації ДНК в еукаріотів є ДНК - полімерази α і δ, що проявляють 5’,3’ – полімеразну активність. Полімерази β та ε беруть участь у репарації ядерної ДНК, а γ-полімераза відповідає за реплікацію мітохондріальної ДНК.
Відкрита також ДНК-полімераза ε, яка у ряді випадків замінює δ-фермент, зокрема при репарації ДНК (виправлення порушень ДНК, спричиних помилками реплікації або ушкоджувальними агентами). У клітинах еукаріот відкрито два білкові фактори реплікації, які позначаються RFА і RFC. Фактор реплікації А виконує функцію білка – зв’язування одноланцюгової ДНК, фактор С-функцію стабілізатора всього реплікаційного комплексу.
Уміст ДНК – полімерази α зростає під час S – фази клітинного циклу, коли відбувається активний синтез ДНК. Активність ДНК – полімераз α, δ та ε специфічно блокується афідиколіном – дитерпеноїдом з грибів, що діє як потужний антипухлинний антибіотик.
Для реплікації ДНК необхідні материнська дволанцюгова ДНК, чотири дезоксирибонуклеозидтрифосфати (дАТФ, дГДФ, дТТФ, дЦТФ), іони Мg2+, Zn2+, ферменти і білкові фактори.

m(дАТФ + дТТФ) + (дГТФ + дЦТФ ) → ДНК + (m+n)Н4Р2О7
П
Рис.8.5. Загальний механізм синтезу ДНК

Далі вільний 3’- гідроксил знову приєднаного нуклеотиду атакує α-фосфатну групу наступного нуклеозидтрифосфату, і таким чином продовжується процес полімеризації, який йде у напрямі 5’ – 3’, антипаралельно матриці, що закінчується 5’-фосфатом (рис.8.5).
Р
Рис. 8.6. Схема синтезу ДНК з участю
ДНК-полімерази

8.1.5. Молекулярні механізми реплікації ДНК. Основні принципи реплікації формулюються так: 1) комплементарність; 2) антипаралельність; 3) однонаправленість; 4) потреба у праймері (затравці; 5) перервність; 6) напівконсервативність. Усі ферменти та білки процесу реплікації ДНК утворюють комплекс – реплісому.
1. Спіралізація та суперспіралізація подвійної спіралі ДНК. Топоізомерази. Реплікації материнської ДНК повинно передувати її розплетення з утворенням реплікативної вилки, яка складається з двох розплетених матричних ланцюгів.
Розплетення та відокремлення двох ланцюгів ДНК, що передує синтезу дочірніх ланцюгів, реалізується при дії спеціальних ферментів:
- топоізомераз (у прокаріот називаються ДНК-гірази), які забезпечують зміну кількості супервитків у кільцевих замкнутих молекулах ДНК в прокаріотів (зокрема E. coli) двоспіральні молекули ДНК є кільцевими, зачіпленими, не мають вільних кінців, їх не можливо розділити без розриву одного з ланцюгів. Топоізомерази і ДНК – гіраза прокаріотів здійснюють у зачіплених нитках ДНК розриви полінуклеотидних ланцюгів, що створює передумови для їх розкручування. Крім цього, топоізомерази видаляють позитивні витки і вносять від’ємні супервитки, сприяючи тим розщепленню спіралі ДНК у ділянці реплікативної вилки.
У хроматиновому апараті еукаріотів топоізомерази вносять розриви в довгі лінійні ДНК хромосом, що забезпечує їх підготовку до реплікації.
- хелікази (helix – спіраль, англ.) – виконують функцію розкручування (розплітання) коротких ділянок подвійної спіралі ДНК, утворюючи реплікативні вилки, що відбувається за рахунок енергії гідролізу 2 молекул АТФ.
- білків, що зв’язують однониткові ДНК (ДНК-зв’язуючі білки, SSB – білки – single strand binding рroteins, англ.), протидіючи їх повторному об’єднанню (ренатурації).
Одноланцюгові ділянки ДНК, що утворилися на певний час, служать як матриця при реплікації та стабілізуються за допомогою особливих білків, які зв’язуються з одноланцюговою ДНК і перешкоджають зворотній комплементарній взаємодії ланцюгів ДНК. У зв’язку з цим їх іноді називають білками, що дестабілізують подвійну спіраль.
Утворення реплікативної вилки в кільцевих дволанцюгових молекулах ДНК E. Coli призводить до формування тета – структур (нагадують грецьку літеру „тета”), яка пересувається в процесі синтезу дочірніх ланцюгів ДНК (рис.8.7).

У ДНК еукаріотів у складі ядерного хроматину утворюється одночасно багато (від сотень до декількох тисяч) реплікативних вилок. Одночасна реплікація ДНК в багатьох точках виявляється утворенням упродовж хромосоми „реплікативних бульбашок”. Ділянки геному, де формуються реплікативні вилки, мають назву „точок ori” (origin–початок, англ.). У клітинах еукаріотів синтез ДНК починається одночасно у багатьох ділянках ДНК, які мають специфічну нуклеотидну послідовність і називають ориджинами реплікації. Кожна нитка ДНК стає матрицею, і від кожного ориджина в протилежних напрямках рухаються реплікативні вилки. Процес є напівконсервативним, так як після завершення реплікації кожна дочірна молекула ДНК містить одну материнську нитку і одну заново синтезовану.
ДНК – лігази виконують важливу функцію з’єднання двох ланцюгів ДНК або замикання двох кінців одного ланцюга ДНК у процесі реплікації або репарації, які каталізують за рахунок енергії АТФ утворення фосфодіефірного зв’язку між 3’-ОН-групою дезоксирибози одного ланцюга та 5’-фосфатною групою іншого ланцюга ДНК.
Нарешті, відомі спеціальні ферменти, що „редагують” ДНК, тобто здійснюють вирізання і видалення помилково включених нуклеотидів або пошкодження ДНК, спричинені фізичними або хімічними чинниками (рентгенівське випромінювання, УФ-промені, хімічний мутагенез тощо).
2. Значення антипаралельності ланцюгів ДНК. Фрагменти Оказакі. Під час реплікації ДНК процес проходить у обидвох ланцюгах одночасно, хоча вони мають різне спрямування (5' →3' і 3' → 5'); нарощування дочірніх ланцюгів також відбувається у протилежних напрямах. Елонгація кожного дочірного ланцюга може здійснюватися тільки у напрямі 5’ → 3’, що зумовлено тим, що ДНК – полімерази можуть синтезувати полірибонуклеотидні ланцюги лише в напрямку 5’ – 3’.
Ц
Рис. 8.8. Схема синтезу дочірніх
ланцюгів ДНК

Таким чином, синтез двох дочірніх ланцюгів ДНК здійснюється за різними механізмами.
Розрізняють:
- лідируючий (leading – англ.) ланцюг, який утворюється з фрагментів Оказакі (рис.8.9.). Як показано, синтез лідируючого ланцюга ДНК йде завжди у напрямі 5’ → 3’, відповідно до напряму руху реплікаційної вилки. Зберігаючи правило синтезу дочірніх молекул ДНК 5’ → 3’, синтез на другому ланцюзі материнської ДНК йде в напрямі, протилежному руху реплікативної вилки. Залежно від типу клітин фрагменти Оказакі мають різні розміри від декількох сотень до декількох тисяч нуклеотидів (150-200 в еукаріот і 1000-2000 у бактерій);
-

Головний фермент, що каталізує реплікацію обох ланцюгів у прокаріотів, ДНК - полімераза ІІІ, а в еукаріотів – ДНК - полімераза α. Інші ДНК - полімерази відіграють допоміжну роль у реплікації.
Одержано докази, що утворення кожного фрагменту Оказакі вимагає наявності короткого „затравочного” праймера – короткої ділянки РНК, комплементарної матричному ланцюгу ДНК, синтез якого каталізує праймаза.
Потім за участю ДНК-полімерази III синтезуються довгі ділянки ДНК. РНК-затравки далі вирізаються за участю ДНК-полімерази I, а вільні їх місця (проломи) заміщаються (добудовуються) комплементарними дезоксирибонуклеотидами під дією тієї ж ДНК-полімерази I. Зшивання, роз’єднаних ділянок відстаючого ланцюга здійснюється за допомогою ДНК-лігаз. Подібний механізм човникового синтезу ДНК легко пояснює фактичні дані про нагромадження коротких фрагментів ДНК у Е. соli під час реплікації ДНК.
8.1.5.1. Синтез ДНК на матриці РНК. Визначним досягненням біохімії нуклеїнових кислот є відкриття у складі онковірусів (вірус Раушера і саркоми Рауса) ферменту зворотної транскриптази, або ревертази (РНК-залежна ДНК-полімераза), що каталізує біосинтез молекули ДНК на матриці РНК.
Припускають, що синтез ДНК на матриці РНК проходить у три етапи.
На I етапі фермент ревертаза синтезує на матриці вірусної РНК комплементарний ланцюг ДНК, що призводить до формування гібридної молекули.
Другий етап - руйнування вихідної вірусної РНК із комплексу гібридної молекули під дією РНКази.
На III етапі на матриці ланцюга ДНК комплементарно синтезуються нові ланцюги ДНК. Ревертазну активність мають і ДНК-полімерази: наприклад, фермент з Е. соli здатний каталізувати синтез ДНК на матриці рРНК.
Відкриття зворотної транскриптази має велике значення не тільки для з’ясування закономірностей процесу малігнізації, але і для всієї науки про живе, оскільки вказує на можливість передачі спадкової інформації від РНК на ДНК.
У даний час можна доповнити основну схему передачі генетичної інформації в живій клітині і представити її в такому вигляді:

На схемі стрілки навколо ДНК і РНК вказують на можливість молекул копіювати самих себе у живих системах за участю відповідних ферментів.
8.1.6. Транскрипція РНК. Потік генетичної інформації називається експресією генів. Він включає процес транскрипції (transcription – переписування, англ.) біосинтез мРНК (як і інших типів клітинних РНК) на молекулі ДНК, і процес трансляції – біосинтез білка на мРНК. Тобто генетична інформація ДНК реалізується шляхом програмованого синтезу білків з участю мРНК. Ці білки визначають фенотипічні ознаки живих організмів. Підраховано, що близько 90 - 95 % ДНК Е. соli експресується в мРНК, хоч велика частина останньої не кодує синтезу білка; невелика частина ДНК кодує синтез рРНК і тРНК.
Транскрипція, не дивлячись на уявну схожість з реплікацією, відрізняється низкою особливостей: не вимагає синтезу праймера, використовує не всю молекулу ДНК, а тільки її окремі короткі сегменти (окремі гени або групи генів) і, нарешті, вимагає наявності лише одного з ланцюгів ДНК як матриці, яка повністю зберігається.
Сучасні уявлення про механізм синтезу РНК y клітинах в значній мірі належать відкриттю в 1960 р. у двох лабораторіях США (Дж. Хервиц і С. Вейс) особливого фермента - РНК-полімерази, що каталізує синтез РНК із вільних нуклеозидтрифосфатів. Фермент вимагає наявності іонів Мg2+ або Мn2+ і одночасної присутності всіх 4 типів рибонуклеозидтрифосфатів (АТФ, ГТФ, ЦТФ і УТФ). Особливою властивістю ферменту є те, що для включення нуклеотидів в РНК необхідна обов’язкова присутність ДНК-матриці.
При вивченні механізму синтезу РНК за участю РНК-полімерази, названої також ДНК - залежною РНК - полімеразою (транскриптазою), було встановлено, що молекула ДНК, необхідна для реакції утворення полірибонуклеотиду, повністю визначає послідовність рибонуклеотидів у заново синтезованій молекулі РНК.
Послідовність включення рибонуклеотидів у полірибонуклеотидний ланцюг у процесі транскрипції програмується послідовністю нуклеотидів у матричній ДНК. Розрізняють кодуючий ланцюг ДНК, з якого зчитується генетична інформація та некодуючий ланцюг. Для деяких генів кодуючим може бути один з ланцюгів, для інших генів – другий ланцюг.
Іншими словами, на матриці ДНК комплементарно синтезується полірибонуклеотид, що є копією первинної структури ДНК, з тією тільки різницею, що замість тимідилового нуклеотиду ДНК в РНК включається уридиловий нуклеотид. Реакція синтезу РНК в загальному вигляді може бути представлена таким чином:

У молекулі РНК окремі мононуклеотиди, як і в ДНК, зв’язані між собою 3’-5’-фосфодіефирними містками. Крім цього, сам механізм дії ферменту РНК-полімерази багато в чому співпадає з механізмами ДНК-полімерази:
- синтез також йде у напрямі 5’ → 3’;
- ланцюг РНК має полярність, протилежну ланцюгу ДНК.
8.1.6.1. РНК-полімерази транскрипції у прокаріотів. У прокаріотів на відміну від еукаріотів єдиним ферментом, що каталізує всі три класи РНК (матричні, транспортні та рибосомні) є РНК-полімераза (ДНК – залежна РНК – полімераза). Це олігомерний фермент, що складається з двох однакових α - субодиниць (М. м. 36 000 Да), двох різних β (β1 і β2) - субодиниць (М. м. 151 000 і 155 000 Да, відповідно), ω-субодиниці (М.м. 11 000 Да) і σ-субодиниці; загальна М.м. ферменту приблизно 500 кДа.
Вважають, що функція σ - субодиниці (σ – фактор) – розпізнавання певної ділянки на матриці ДНК, названого промотором, до якого приєднується РНК-полімераза. В результаті утворюється так званий відкритий комплекс ферменту з ДНК: двохланцюгова структура ДНК розкривається. Далі на одній з ниток ДНК, як на матриці, синтезується мРНК; синтез закінчується в певній точці в кінці гена або переривається під дією особливих білків. Іншим субодиницям ферменту приписують функцію ініціації біосинтезу РНК (α-субодиницям) і основну каталітичну функцію (зв’язування субстратів і елонгація синтезу) – β - субодиницям.
Крім цього, відкрито ряд білків, що беруть участь у механізмі синтезу РНК в клітині. Зокрема, досліджується природа репресорних білків і білка-термінатора (ρ-чинника). Останній має здатність зворотно зв’язуватися з термінуючими ділянками ДНК (так звані стоп-сигнали транскрипції) і виключати при цьому дію РНК - полімерази. За відсутності цього білка утворюються виключно довгі ланцюги РНК.
Напрямок синтезу полірибонуклеотидного ланцюга 5’ – 3’. Подібно до ДНК полімеразних реакцій, РНК – полімеразна реакція здійснюється шляхом нуклеофільної атаки 3’-ОН – групи кінцевої рибози полірибонуклеотидного ланцюга на α-фосфат нуклеозидтрифосфату, що вступає в реакцію подовження ланцюга (рис. 8.10.). Каталітичний сайт, що утворює 3’-5’- фосфодіефірні зв’язки між рибонуклеозидмонофосфатами, локалізований на β – субодиниці РНК – полімерази.

Узагальнений процес транскрипції РНК представлений на рис. 8.11.

Етапи транскрипції РНК у прокаріотів: а) зв’язування РНК-полімерази з ДНК-матрицею; б) ініціація синтезу полірибонуклеотидного ланцюга; в) елонгація (подовження) синтезу РНК; г) термінація, тобто закінчення синтезу РНК („первинного РНК-транскрипту”).
8.1.6.2. РНК-полімерази та механізми транскрипції в еукаріотів. В еукаріот відкриті три різні РНК-полімерази (I, II і III) з великою молекулярною масою (від 500 000 до 600 000 Да), кожна з яких наділена специфічною функцією. РНК-полімераза I (А), міститься в ядерці, відповідає за синтез прерибосомного РНК-транскрипту, попередника 5S-, 8S-, 18S-, і 28S - рРНК; фермент зв’язується з різними промоторними ділянками.
РНК-полімераза II (В) каталізує утворення гетерогенної ядерної РНК (гяРНК) – попередника мРНК; міститься в нуклеоплазмі. Фермент може розпізнавати безліч промоторних ділянок, більшість з яких мають специфічні ключові послідовності, що є місцями (сайтами) зв’язування білкових чинників транскрипції. При дії РНК – полімерази ІІ у еукаріотів утворюється моноцистронна РНК, яка є матрицею для синтезу в рибосомах одного поліпептидного ланцюга – на відміну від поліцистронної РНК прокаріотів.
РНК-полімераза III (С) каталізує переважно синтез транспортних РНК (тРНК), а також 5S рРНК та низки інших низькомолекулярних РНК із специфічною функцією, міститься в нуклеоплазмі.
а) Сигнали транскрипції. В еукаріот роботу РНК-полімерази забезпечує система сигналів транскрипції, яка містить певні послідовності ДНК у складі промотора та безліч регуляторних білків, об’єднаних разом з ферментом в єдиний комплекс транскрипції. Зокрема, відкриті чинники транскрипції типу Ј, активні тільки у вигляді ідентичних димерів (Ј1Ј1 або Ј2Ј2) або різних димерів (Ј1Ј2). Ці чинники кодуються окремими генами і самі запускають роботу ряду генів, які регулюють поділ клітин.
Сигналом ініціації транскрипції в генах ссавців є гомологічна блоку Прибнова (ТАТААТ) послідовність ТАТААААГА, розміщена на відстані – 32 нуклеотидів від точки початку синтезу полірибонуклеотиду. З цією послідовністю взаємодіє РНК – полімераза ІІ.
б) Промотори транскрипції. Спочатку РНК – полімераза розпізнає промоторну ділянку (специфічна ділянках геному) ДНК. Зв’язування РНК – полімерази з ДНК – матрицею відбувається в – промоторах, що реалізується за участю σ-субодиниці РНК – полімерази. Це зумовлює локальне розходження ланцюгів подвійної спіралі ДНК.
Промоторні ділянки ДНК – послідовності, що складаються приблизно з 40 нуклеотидів. Важливе значення для ініціації транскрипції мають короткі (6 – нуклеотидні) послідовності у складі різних промоторів (рис. 8.12).
1. «3’5’-послідовність» послідовність TTGACA, що локалізована на 35 нуклеотидів „вліво” в напрямку 5’- кінця від точки ініціації (”0 - точки”) і є ділянкою взаємодії з σ-субодиницею РНК – полімерази;
2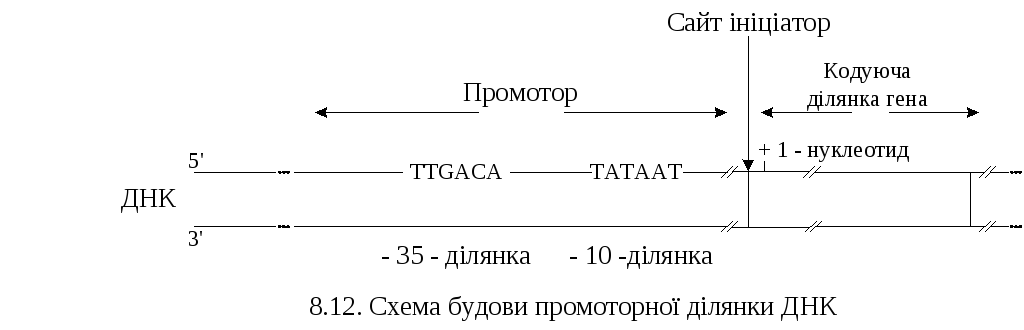 .
« – 10-послідовність», або ”блок
Прибнова” (”Pribnow
box”)
– послідовність ТАТААТ, локалізована
на 10 нуклеотидів ”вліво” від точки
ініціації. На цій ділянці відбувається
розплетення двох ланцюгів ДНК і кодуючий
ланцюг стає доступним для каталітичних
сайтів РНК – полімерази.
.
« – 10-послідовність», або ”блок
Прибнова” (”Pribnow
box”)
– послідовність ТАТААТ, локалізована
на 10 нуклеотидів ”вліво” від точки
ініціації. На цій ділянці відбувається
розплетення двох ланцюгів ДНК і кодуючий
ланцюг стає доступним для каталітичних
сайтів РНК – полімерази.
в) Ініціація транскрипції. Безпосередньо ініціація синтезу РНК починається з включення в ланцюг першого (5’ – кінцевого) нуклеотиду, яким у всіх мРНК (про- і еукаріот)є пуриновий нуклеозидтрифосфат (Пур - 5’- ФФФ).
РНК – полімераза розміщує перший нуклеозидтрифосфат (ГТФ або АТФ) комплементарно до матриці і послідовно приєднує нуклеотиди фосфодіефірним зв’язком до вільної 3’ – ОН групи рибози. Таким чином, ланцюг РНК синтезується в напрямку 5’-3’.
Ефективність дії промоторів залежить від нуклеотидних послідовностей, що розміщені між ”-35” та ”-10”- блоками; активність промоторів значно зменшується за умов мутацій у них.
Взаємодія РНК – полімерази з ДНК – матрицею блокується протипухлинним антибіотиком актиноміцином D, який розміщується в щілинах між сусідніми парами азотистих основ, переважно між Г – Ц – парами (процес інтеркаляції), має здатність зв’язуватися водневими зв’язками з ДНК по залишках гуаніну, це зумовлює локальну деформацію матриці ДНК, гальмуючи дію РНК – полімерази. Актиноміцин D гальмує синтез всіх типів РНК як прокаріотів, так і еукаріотів. Він знайшов широке застосування при вивченні процесів, залежних від транскрипції ДНК. Аналогічним чином діє рубоміцин.
Антибіотики рифаміцин та рифампіцин блокують зв’язування перших нуклеозидтрифосфатів з активними центрами β – субодиниці РНК – полімерази,їх широко використовують як протимікробні засоби.
Стрептолідигін також зв’язується з β – субодиницею, але інгібує процес елонгації РНК. α – Аманітин, отруйна речовина, міститься в блідій поганці, є сильним інгібітором РНК – полімерази ІІ еукаріотів, пригнічує синтез мРНК.
г) Елонгація транскрипції. Нарощування (елонгація) молекули РНК проходить у результаті приєднання чергового рибонуклеотиду, комплементарного тому дезоксирибонуклеотиду ДНК, який у даний момент знаходиться в ділянці активного центру РНК – полімерази. У процесі елонгації відбувається розплітання ділянок подвійної спіралі ДНК, які передують РНК – полімеразі, і утворення 3’-5’- фосфодіефірних зв’язків у полірибонуклеотидному ланцюгу.
С интез
РНК відбувається у напрямку 5’-3’
антипаралельно матричному ланцюгу ДНК.
Утворюються комплементарні пари у
процесі транскрипції Г – Ц і А – У, тобто
замість тимінових залишків ДНК у РНК
включається залишок урацилу. Азотисті
основи А, Г, Т, Ц ланцюга ДНК кодують
включення в ланцюг РНК, відповідно, У,
Ц, А, Г (рис. 8.13).
интез
РНК відбувається у напрямку 5’-3’
антипаралельно матричному ланцюгу ДНК.
Утворюються комплементарні пари у
процесі транскрипції Г – Ц і А – У, тобто
замість тимінових залишків ДНК у РНК
включається залишок урацилу. Азотисті
основи А, Г, Т, Ц ланцюга ДНК кодують
включення в ланцюг РНК, відповідно, У,
Ц, А, Г (рис. 8.13).
РНК – полімераза на відміну від ДНК – полімерази не здатна виправляти помилки. У результаті елонгації утворюється ДНК – РНК – гібрид, що містить кодуючий ланцюг ДНК та РНК - транскрипт.
У процесі елонгації відбувається
розплітання ділянок двоспіральної ДНК,
які передують РНК – полімеразі, й
утворення фосфодіефірних звя'зків у
полірибонуклеотидному ланцюгу (рис.8.14).
Вибір наступного нуклеозидмонофосфату
(НМФ) в ланцюгу РНК, що синтезується,
визначається будовою комплементарного
дНМФ у кодуючому ланцюгу ДНК так, що
азотисті основи А, Г, Т, Ц ланцюга ДНК
кодують включення у ланцюг РНК ,
відповідно, основ У, Ц, А, Г.
процесі елонгації відбувається
розплітання ділянок двоспіральної ДНК,
які передують РНК – полімеразі, й
утворення фосфодіефірних звя'зків у
полірибонуклеотидному ланцюгу (рис.8.14).
Вибір наступного нуклеозидмонофосфату
(НМФ) в ланцюгу РНК, що синтезується,
визначається будовою комплементарного
дНМФ у кодуючому ланцюгу ДНК так, що
азотисті основи А, Г, Т, Ц ланцюга ДНК
кодують включення у ланцюг РНК ,
відповідно, основ У, Ц, А, Г.
е) Термінація транскрипції відбувається:
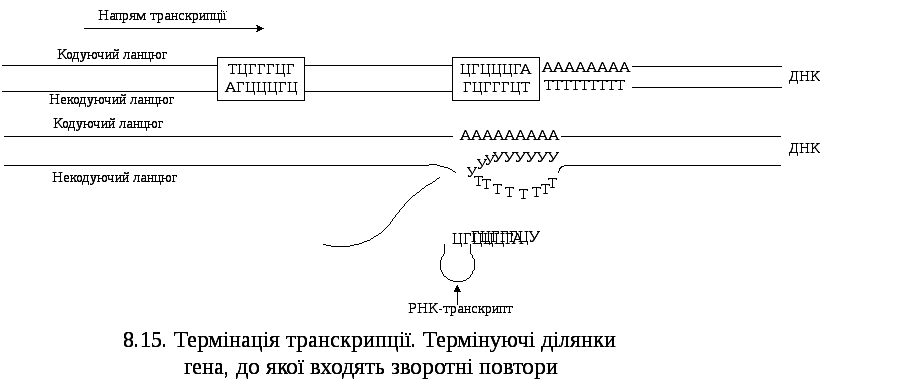
- якщо РНК – полімераза доходить до термінуючих ділянок ДНК (стоп - сигналу). Специфічними для термінуючих ділянок є наявність зворотних повторів (”паліндромів”, ”бігти назад” – грец.), тобто нуклеотидних послідовностей, що читаються однаково у прямому і зворотному напрямках, та наступних полі – АТ – пар. Ділянка РНК, що зчитується з такої паліндромної послідовності, має будову ”шпильки” з наступною (кінцевою) УУУ...- послідовністю. Утворення РНК з такою структурою є передумовою дисоціації ДНК – РНК – гібриду. Транскрипція термінуючої ділянки призводить до утворення РНК – транскрипту, у складі якого містяться комплементарні послідовності АГЦЦЦГЦ та УЦГГГЦГ, що утворюють шпилькоподібні структури;
- внаслідок допоміжної дії специфічного білка – термінатора, так званого ρ – (ро) – фактора, взаємодія якого з полімеразним комплексом призводить до дисоціації комплексу ”ДНК – фермент – РНК” і вивільнення первинного транскрипту (рис.8.15)
8.1.7. Процесинг–посттранскрипційна модифікація новосинтезованих мРНК. У клітинах прокаріот молекули мРНК синтезуються відразу в ”зрілому” вигляді, тобто готовими до виконанання свої функцій. На противагу цьому, в клітинах еукаріот утворюється первинний транскрипт (гяРНК, або пре – РНК), яка перетворюється у функціонально повноцінну молекулу в результаті посттранскрипційної модифікації – процесингу (дозрівання).
Біосинтез мРНК у еукаріот суттєво відрізняється не лише за механізмом регуляції транскрипції, але і багатоступеневим формуванням активної молекули. До відкриття феномену сплайсингу (від англ. splicing – дозрівання) мРНК було відомо, що багато мРНК еукаріот синтезуються у вигляді гігантських високомолекулярних попередників (пре-мРНК), які вже в ядрі піддаються посттранскрипційному процесингу.
Припускають, що процесинг включає видалення довгих 5’- і 3’-кінцевих ділянок, які нібито виконують регуляторні функції. Як виявилося, ген еукаріот є мозаїчною структурою, містить поряд з тими, які кодують (екзони) також ті, що некодують (інтрони) послідовності. Термін „інтрони” означає вставні, нетранслюючі послідовності нуклеотидів у ДНК еукаріот. Цей термін можна застосувати і до вставних, нуклеотидних послідовностей первинного РНК-транскрипту.
Фермент РНК-полімераза каталізує транскрипцію як екзонів (eхit – вихід, англ.), оскільки продукти транскрипції-ділянки мРНК виходять із ядра в цитоплазму і виконують функцію матриці в синтезі білка, так й інтронів з утворенням гетерогенної ядерної РНК (гяРНК), названої також первинним транскриптом. З відкриттям інтрон-екзонної будови генів, характерної для клітин еукаріотів, почався новий етап досліджень на шляху реалізації генетичної інформації.
Транскрипція гена, що складається з кодуючих і некодуючих нуклеотидних послідовностей, які чергуються, забезпечувала повне його копіювання і призводила до синтезу РНК-попередника. Тому було висловлене припущення про існування між транскрипцією і трансляцією ще однієї важливої ланки – утворення придатної для трансляції „зрілої” молекули мРНК. Цей етап отримав назву процесингу, або дозрівання мРНК.
Вважають, що процесинг мРНК включає три основні моменти:
1) кепування – хімічна модифікація 5’-кінцевої послідовності мРНК;
2) сплайсинг – видалення некодуючих інтронних послідовностей із мРНК і зшивання екзонів, що утворюються;
3) поліаденілування – хімічна модифікація 3’– кінцевої послідовності мРНК (рис. 8.16.).

Рис.8.16. Дозрівання пре-мРНК у еукаріот
У здійсненні кожного з вказаних процесів специфічну участь бере ряд білків і нуклеїнових кислот, хоч конкретні молекулярні механізми цих перетворень ще не повністю розкриті. Всі три вказані процеси мають важливе значення у формуванні зрілої молекули мРНК.
Майже у всіх клітинах еукаріотів, синтезовані на структурних генах, первинні транскрипти піддаються процесингу, перш, ніж виконують свої функції в синтезі білка. У багатьох випадках процесинг має місце головним чином в ядрі, хоч цей процес продовжується і після транспортування молекул РНК із ядра в цитоплазму: наприклад, термінальні реакції поліаденилювання і метилювання залишків нуклеозидів.
Хімічний сенс кепування зводиться до приєднання залишку 7-метилгуанозину за допомогою трифосфатної групи до 5’-кінця молекули транскрипту, метилювання 2’-ОН-групи першого і другого нуклеотидів на 5’- кінці мРНК.
За рахунок приєднання до З’- кінця первинного транскрипту 100 – 200 залишків аденілової кислоти і фрагментів ААУАА до 3’-кінця мРНК утворюється ”поліаденіловий хвіст” (полі-А). Цей процес включає ряд стадій та участь ендонуклеази і поліаденілатполімерази.
Встановлено, що 5’-кеп, з’єднується із специфічним білком, бере участь у зв’язуванні мРНК з рибосомою, сприяючи ініціації синтезу білка. Допускають, що основне призначення 5’-кепу і полі-А –це захист мРНК від ферментативного розщеплення.
З

Сплайсинг вимагає наявності комплексу білків і особливої групи клітинних РНК, названих малими ядерними РНК (мяРНК). Виділено і охарактеризовано 5 груп мяРНК, які містять багато уридину і відповідно позначають U1, U2, U4, U5 і U6, розмірами від 100 до 200 нуклеотидів.
Комплекси мяРНК і білків, названі малими ядерними нуклеопротеїнами, об’єднуються в єдину систему-сплайсосому, що координує весь процес сплайсингу. Припускають, що мяРНК з’єднується з обома кінцями інтрона, сприяє формуванню специфічної конформації, необхідної для розпізнавання її ферментами, які беруть участь у процесі, зближенню двох екзонів, видаленню інтронів і об’єднанню кодуючих екзонів. Четвертий клас інтронів відкритий у ряді тРНК. Сплайсинг цієї групи інтронів вимагає доставки енергії і присутності ендонуклеаз та лігаз, що каталізують відповідно розрив фосфодіефирних зв’язків із 5’- і З’-кінців інтрону і з’єднують два екзони.
Виявлені приклади неоднозначного протікання сплайсингу для ряду генів. Результат альтернативного сплайсингу – поява декількох продуктів при експресії одного гена. Так, одержані докази, що експресія одного і цього ж гена тропоміозину дозволяє отримати сім ізоформних білків, специфічних для різних груп м’язів (гладких і посмугованих або для фібробластів та міобластів).
У послідовностях геному, що не підлягають транскрипції, перед екзон-інтронами відкриті специфічні ділянки, названі промоторами, а також енхансерами (підвищують рівень транскрипції) і ділянки, що послаблюють рівень транскрипції. При взаємодії з білками вони виконують функції регуляторних сигналів при транскрипції. Цей спосіб регуляції широко використовується клітинами еукаріот як в процесах диференціювання, так і при індукції репресії.
Важливе значення має відкриття рибозимів, тобто молекул РНК, які виступають як каталізатор. Мабуть, це єдині з відомих макромолекул, які наділені як інформаційною, так і каталітичною функцією. Виявилось, що деякі РНК здійснюють посттранскрипційний процесинг, каталізують самосплайсинг, тобто беруть участь у розрізанні та видаленні інтронів. Рибозими беруть участь у двох типах реакцій: у гідролізі фосфодіефірного зв’язку і в реакціях трансестерифікації.
8.1.8. Транспортні РНК. Транспортні РНК у клітині виконують адапторну функцію при трансляції інформації мРНК в первинну структуру білка. У молекулі транспортної (тРНК) міститься 8 – 10 % мінорних азотистих основ у складі нуклеотидів. На долю тРНК припадає близько 10-15 % від загальної кількості клітинної РНК.
Молекули тРНК як у еукаріот, так і в прокаріот синтезуються у вигляді великих попередників, що часто містять послідовності нуклеотидів більше однієї тРНК, які потім піддаються процесингу за участю специфічних рибонуклеаз.
Гени деяких тРНК містять поблизу ділянки ДНК, відповідальної за синтез антикодонової петлі, інтронні послідовності (приблизно 18 нуклеотидів). Ці ділянки також підлягають транскрипції, тому процесинг тРНК включає, крім видалення 18-членного рибонуклеотидного інтрону, також необхідний сплайсинг антикодонової петлі.
Подальша модифікація включає приєднання триплету ЦЦА і утворення акцепторної ділянки (на З’-кінці молекули), до якої приєднується амінокислота. Є дані, що метилювання попередників тРНК в еукаріот здійснюється в ядрі, тоді як ферментативні процеси видалення інтронів і приєднання триплету ЦЦА відбуваються у цитоплазмі. У структурі тРНК виділяють такі частини:
1. Акцепторний кінець. Складається з чотирьох нуклеотидів, три з яких у всіх типах тРНК мають однакову послідовність - ЦЦА. Гідроксил 3'-ОН аденозину вільний, до нього приєднуються амінокислоти, звідси й назва цієї ділянки - акцепторна. Приєднану амінокислоту тРНК переносить до рибосом, де проходить біосинтез білків.
2. Антикодонова петля, яка утворена сіма нуклеотидами, містить специфічний для кожної тРНК триплет нуклеотидів, що називається антикодоном. Антикодон тРНК комплементарний кодону мРНК. Кодон-антикодонова взаємодія визначає порядок розміщення амінокислот у поліпептидному ланцюзі при його синтезі в рибосомах.
3. Псевдоуридилова петля складається із семи нуклеотидів, містить залишок псевдоуридилової кислоти (ТС-петля). Допускають, що ця петля приймає участь у зв’язуванні тРНК з рибосомою.
4. Дигідроуридилова петля (D-петля) складається з 8-12 нуклеотидних залишків. Вважають, що ця петля необхідна для зв’язування з аміноацил-тРНК-синтетазою, яка приймає участь у розпізнаванні амінокислотою своєї тРНК.
Крім акцепторних і антикодонових петель, тРНК містить специфічні ділянки розпізнавання для ферментів – аміноацил-тРНК-синтетаз, а також ділянки для зв’язування з великими субодиницями рибосом.
В
Рис.8.18. Вторинна (справа) і
третинна (зліва) структура тРНК
Третинна структура РНКхарактеризується великою укомплектованістю в просторі і може бути розміщена у вигляді одного ланцюга, компактного стержня або у вигляді клубка. Всі три структури можуть переходити одна в одну в залежності від концентрації солей, рН, температури та інших факторів (рис.8.18.).
З’ясовано, що при інкубації 14С – амінокислоти з розчинною фракцією цитоплазми в присутності АТФ і подальшим додаванням трихлорацетатної кислоти в осаді білка, що утворився, мітка не виявлялася. Ці дані дозволили зробити висновок, що мічена амінокислота не включається в молекулу білка. Мітка виявилася ковалентно зв’язаною з РНК, що міститься в безбілковому фільтраті.
Подальші дослідження показали, що РНК, до якої приєднується мічена амінокислота, має невелику молекулярну масу і зосереджена в розчинній фракції, тому її спочатку назвали розчинною, а пізніше адапторною, або транспортною, РНК (тРНК).
У даний час відкрито більше 60 різних тРНК. Для кожної амінокислоти в клітині є принаймні одна специфічна тРНК. (Для ряду амінокислот відкрито більше, ніж одну: зокрема, для серину, лейцину і аргініну-6 різних тРНК, для аланіну, треоніну і гліцину - по 4 різних тРНК.
Молекулярна маса більшості тРНК коливається від 24 000 до 29 000 Да. Вони містять від 75 до 85 нуклеотидів, зокрема 8 і більш з них є модифікованими основами. Амінокислоти приєднуються до вільної 3’-ОН-групи кінцевого мононуклеотиду, представленого у всіх тРНК АМФ (аденілова кислота), шляхом утворення ефірного зв’язку. Майже всі тРНК мають не тільки подібні функції, але і дуже подібну тривимірну структуру.Встановлена первинна структура майже всіх 60 відкритих тРНК.
Знання послідовності нуклеотидів і, отже, складу тРНК дало в руки дослідників багато цінних відомостей про біологічну роль окремих компонентів тРНК. Загальною для тРНК виявилася також нативна тривимірна структура, встановлена методом рентгенокристалографічного аналізу і названа спочатку конформацією листка конюшини; насправді ця конформація має перевернуту L-подібну форму (рис. 8.19.).

Рис.8. 19. Структура тРНК
Визначення тРНК цим методом дозволило виявити ряд відмінних особливостей структури. У молекулі тРНК відкриті спіралізовані ділянки, незвичайні водневі зв’язки і гідрофобні взаємодії в неспіралізованих ділянках.
Показано, що тРНК має псевдоуридилову петлю, утворену з нуклеотидів, що містять псевдоуридин (ТψС), і дигідроуридилову петлю. Обидві петлі беруть участь в утворенні кута букви L. На З’-ОН-кінці розташовується однакова для всіх тРНК послідовність триплету ЦЦА-ОН, до якої приєднується за допомогою ефірного зв’язку специфічна амінокислота. Зв’язування в основному відбувається через З’-ОН-групу кінцевого аденілового нуклеотиду, хоч отримані докази можливості попереднього приєднання амінокислоти і через її 2’-ОН-групу.
Роль окремих ділянок тРНК недостатньо розкрита. Зокрема, псевдоуридилова петля, мабуть, забезпечує зв’язування аміноацил-тРНК з рибосомою, а дигідроуридилова петля, найімовірніше, необхідна як сайт (місце) для розпізнавання специфічним ферментом – аміноацил-тРНК-синтетазою. Є, крім того, додаткова петля, склад якої змінюється у різних типів молекул тРНК; її призначення невідоме. Істотним, з повністю розкритою функцією є антикодонова петля, що містить триплет, названий антикодоном, і розташована на протилежному боці від того кінця, до якого приєднується амінокислота.
Антикодонова петля складається з 7 нуклеотидів: три займають центральне положення і формують власний високоспецифічний антикодон, по два нуклеотиди розташовані по обидва боки від нього, включаючи модифікований пурин з одного боку і дві піримідинових основи-з іншого боку. Антикодон є специфічним і комплементарним до відповідного кодону мРНК, причому обидва вони антипаралельні в своїй комплементарності.
Аналіз нуклеотидної послідовності різних тРНК показав, що вони містять однаковий 5’-кінцевий нуклеотид- ГМФ - з вільною 5’-фосфатною групою. Адапторная функція молекул тРНК полягає у зв’язуванні кожної молекули тРНК зі своєю специфічною амінокислотою. Проте, оскільки між нуклеїновою кислотою і специфічною функціональною групою амінокислот немає відповідності та спорідненості, цю функцію розпізнавання повинна виконувати білкова молекула ферменту. Взаємодія між аміноацил-тРНК-синтетазою і тРНК прийнято позначати як „вторинний генетичний код”, підкреслюючи тим самим його ключову роль у забезпеченні точності синтезу білка, причому правила кодування є, найімовірніше, складнішими, ніж правила „первинного” генетичного коду.
8.1.8.1. Активація амінокислот. Необхідною умовою синтезу білка є наявність в системі не вільних, а так званих активованих амінокислот. Активація вільних амінокислот здійснюється за допомогою специфічних ферментів - аміноацил-тРНК-синтетаз - у присутності АТФ. Цей процес протікає в дві стадії: на першій стадії біосинтезу білка, який відбувається в цитозолі клітини, 20 різних амінокислот приєднуються ефірним зв’язком до відповідної тРНК. Ці процеси каталізуються 20 різними аміноацил-тРНК синтетазами. Загальний вигляд реакції можна виразити рівнянням:

Н

На цій останній стадії аміноацильний залишок зв’язується з вільною 2’- або 3’- гідроксильною групою кінцевого залишку А у молекулі тРНК.
Обидві стадії каталізуються одним і тим же ферментом. На I стадії амінокислота вступає в реакцію з АТФ, при цьому звільняється пірофосфат і утворюється проміжний продукт, який на II стадії реагує з відповідною З’-ОН-тРНК, внаслідок чого утворюється аміноацил-тРНК (аа-тРНК) і звільняється АМФ. Аміноацил-тРНК має необхідний запас енергії і наступну будову:
Aмінокислота приєднується до вільного кінцевого З’-ОН-гідроксилу (або 2’-ОН) АМФ, який разом з двома залишками ЦМФ утворює кінцевий триплет ЦЦА, що є однаковим для всіх тРНК.
8.1.8.2. Аміноацил – тРНК – синтетази. Експериментально доведено існування в будь-яких клітинах живих організмів специфічних ферментів, що каталізують активування амінокислот і взаємодію останніх з певними тРНК. Всі ці ферменти виділені в чистому вигляді з Е. соli, для деяких з них встановлена трьохмірна структура.
Вони виявилися чутливими до реагентів на SН-групи і вимагають присутності іонів Мg2+. Ферменти мають абсолютну специфічність дії, оскільки вони розпізнають тільки одну яку-небудь L-амінокислоту або одну тРНК. Для амінокислот, для яких відкриті дві і більш тРНК, відповідна аміноацил-тРНК-синтетаза каталізує аміноацилювання всіх цих тРНК. Ця обставина надзвичайна важлива, оскільки надалі в білковому синтезі „розпізнавання” аміноацил-тРНК засноване не на природі амінокислоти, а на хімічній природі а н т и к о д о н у тРНК.
Вважається, що в молекулі кожної аміноацил-тРНК-синтетази є щонайменше 3 центри зв’язування: для амінокислоти, тРНК і АТФ; ферменти дуже чутливі також до аналогів амінокислот, які інгібують активування відповідних амінокислот. Деякі ферменти складаються з одного поліпептидного ланцюга, інші - з два або чотирьох гомологічних або гетерогенних субодиниць.
Аміноацил-тРНК-синтетази останнім часом почали ділити на 2 класи відповідно до відмінностей у їх первинній і третинній структурах, а також залежно від механізму реакції, яку каталізує. Перший клас включає ферменти, що каталізують синтез аміноацил-тРНК наступних амінокислот: Арг, Вал, Глн, Глу, Іле, Лей, Мет, Тир, Трп, Цис; другий клас включає ферменти, що каталізують синтез аміноацил-тРНК наступних амінокислот - Ала, Асп, Гіс, Глі, Ліз, Про, Сер, Тре, Фен.
Виявилось, що ферменти 1-го класу забезпечують перенесення аміноацильної групи спочатку до другої 2’-ОН-групи термінального залишку аденілової кислоти, потім переміщення її до З’-ОН-групи (шляхом реакції трансестерифікації), тоді як ферменти 2-го класу каталізують перенесення аміноацильної групи безпосередньо до З’-ОН-групи кінцевого аденілового нуклеотиду.
Аміноацил-тРНК-синтетази в активному центрі містять гістидин, імідазольне кільце якого бере участь у зв’язуванні АТФ за допомогою іонів Мg2+. Найбільшу спорідненість ці ферменти мають до молекул специфічних тРНК. Аміноацил-тРНК-синтетази дуже специфічні як до тРНК, так і до відповідної амінокислоти.
