
- •Бийский технологический институт (филиал)
- •Фотоколориметрия
- •Содержание
- •1 Теоретическая часть
- •1. 1 Теоретические основы фотоколориметрического метрического метода анализа
- •1. 2 Основной закон светопоглощения
- •1. 3 Основные приемы фотометрического анализа
- •1. 4 Назначение колориметра фотоэлектрического концентрационного кфк-2
- •2 Экспериментальная часть
- •2. 1 Лабораторная работа № 1 «Определение содержания ионов никеля в растворе его соли» (6 часов)
- •2. 1. 1 Краткая характеристика метода
- •2. 1. 2 Приборы, посуда, реактивы:
- •2. 1. 3 Выполнение работы
- •2. 1. 4 Проведение испытания
- •2. 1. 5 Обработка результатов
- •2. 2. 4 Проведение испытания
- •2. 2. 5 Обработка результатов
- •2. 2. 6 Содержание отчета
- •3 Вопросы для защиты работы
- •3. 1 Вопросы для защиты работы № 1
- •3. 2 Вопросы для защиты работы № 2
- •4 Техника безопасности
- •Литература
- •Бийский технологический институт (филиал)
- •Фотоколориметрия
1 Теоретическая часть
1. 1 Теоретические основы фотоколориметрического метрического метода анализа
Фотоколориметрический метод анализа является разновидностью молекулярно – абсорбционного метода анализа.
Молекулярно – абсорбционные методы основаны на измерении поглощения молекулами (или ионами) веществ электромагнитного излучения оптического диапазона.
В зависимости от области оптического диапазона, способа измерений, ширины полосы измеряемого излучения различают следующие молекулярно-абсорбционные методы: колориметрию – сравнение окраски анализируемого и стандартного раствора вещества визуальным способом;фотоколориметрию– измерение интенсивности светового потока, прошедшего через раствор вещества (или вещества в твердой или газовой фазе) фотоэлектрическим способом;спектрофотометрию– измерение интенсивности монохроматического (определенной длины волны) светового потока, прошедшего через раствор вещества, фотоэлектрическими способами. В зависимости от длины волны различаютспектрофотометрию вультрафиолетовой (УФ), видимой (В) и инфракрасной (ИК) области спектра.
Фотометрическому определению подвергают вещества, которые обладают функциональными группами, поглощающими в той или иной области спектра. Если же вещества не имеют хромофорных групп, то в этом случае проводят химическую реакцию, в результате которой получают окрашенный продукт, подвергающийся фотометрическому определению. Такие реакции называют фотометрическими. Если продукт реакции растворим в воде, фотометрируют водные растворы. В случае хорошей растворимости в воде (и для целей очистки от примесей) применяют экстракционно-фотометрический анализ. Определяемое вещество или его комплекс экстрагируют подходящим органическим растворителем и затем полученный раствор фотометрируют.
Суть фотоколориметрии заключается в том, что любое вещество способно поглощать электромагнитное излучение определенной длины волны в одной из областей спектра. Растворы веществ, поглощающих в одном из участков видимой области спектра, окрашены. Длина волны поглощаемого цвета у различных веществ отличается и зависит от их структуры. Это создает дополнительные возможности для их обнаружения.
Второй важной характеристикой растворов цветных веществ является количество поглощённого светового излучения, которое зависит от количества вещества в растворе. Если, например, каждая молекула вещества поглощает квант света, очевидно, количество поглощенных квантов зависит от количества молекул. Поглощенное световое излучение оценивают относительной величиной – поглощением А (оптической плотностью), представляющем собой логарифм отношения интенсивностей световых потоков входящего (Io) в кювету с раствором вещества и выходящего (Ib) из нее. Употребляют и другую величину – пропускание, или фактор пропускания (T):
![]()
![]() ;
(1)
;
(1)
![]() (2)
(2)
1. 2 Основной закон светопоглощения
П. Бугер (1729г.) и И. Ламберт (1760 г.) установили взаимосвязь поглощения с толщиной слоя раствора. А. Бер (1852 г.) выявил зависимость поглощения от концентрации вещества. Указанные зависимости легли в основу закона светопоглощения, названного законом Бугера – Ламберта – Бера: «Интенсивность поглощения света растворами вещества пропорциональна их концентрации и толщине поглощающего слоя». Или «Растворы одного и того же окрашенного вещества при одинаковой концентрации вещества и толщине слоя раствора поглощают равное количество световой энергии (светопоглощение таких растворов одинаковое)». Математическое выражение этого закона следующее:
Ib = Iо ·10 –ε с l, (3)
где ε– коэффициент поглощения, л.моль-1 .см-1;
l– толщина слоя раствора, см;
c– концентрация вещества, моль/л.
Удобнее выражать этот закон в таком виде:
А =ε . b. С
Молярный коэффициент поглощения (ε) – представляет собой оптическую плотность раствора с концентрацией вещества 1 моль/л при толщине слоя 1см.
Закон Бугера – Ламберта – Бера справедлив только для строго монохроматического излучения. При графическом выражении зависимость поглощения от концентрации (при прочих постоянных условиях) имеет вид прямой линии, выходящей из начала осей координат (рисунок 1a). В случае отклонений прямолинейная зависимость искажается. Поэтому одной из причин отклонения от линейной зависимости оптической плотности растворов от концентрации является недостаточная монохроматичность светового потока.
Другой причиной отклонения от закона Бугера – Ламберта – Бера является изменение состояния поглощающего веществав растворе.
b
a
c
Рисунок 1– Отклонения от закона Бугера –Ламберта–Бера
Некоторые окрашенные вещества при разбавлении или действия посторонних веществ разрушаются с образованием бесцветных продуктов взаимодействия. При этом может образовываться осадок и раствор обесцвечивается.
Вследствие этого наблюдается нарушение линейной зависимости между Aи С в положительную (рисунок 1b) или в отрицательную (рисунок 1с) сторону. Фотометрическое определение компонентов следует проводить при условиях, обеспечивающих полноту образования поглощающего (окрашенного) соединения в растворе, отсутствие (или минимизация) отклонения от основного закона светопоглощения, способствует наибольшей точности и чувствительности анализа.
Для измерения светопоглощения исследуемого раствора выбирают длину волны светового потока, соответствующую максимуму поглощения.
Д
A
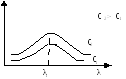
Рисунок 2 – Зависимость оптической плотности от длины волны
Работа в области максимума поглощения обеспечивает наибольшую чувствительность и точность определения.
