
- •Введение
- •1. Расчет материального баланса ХТП
- •1.1. Расчет приходной части баланса
- •1.1.1. Расчет состава и расхода потока
- •1.1.2. Газы и их смеси
- •1.1.3.Способы выражения концентрации растворов
- •1.1.4.Степень превращения и выход продуктов
- •1.2. Расчет по уравнению химической реакции
- •1.4. Расчет расходной части баланса
- •1.5. Сводная таблица материального баланса
- •1.6. Примеры решения задач
- •1.6.1. Простейшие упражнения
- •1.6.2.Расчет состава равновесной смеси и степени превращения
- •1.6.3. Расчет материального баланса обратимых реакций
- •1.6.6. Расчет материального баланса при одновременном протекании нескольких реакций
- •2. РАСЧЕТ теплового баланса хТП
- •2.1. Основные расчетные соотношения
- •2.2. Примеры решения задач
- •3. Расчет химических реакторов
- •3.1. Основные расчетные соотношения
- •3.2. Примеры решения задач
- •4. Расчеты на персональных компьютерах
- •4.2. Расчет равновесной степени превращения ХА*
- •2. При решении системы уравнений следует ввести начальные условия по искомым компонентам, команду <Given> и получить результаты командой <Find>, введя искомые величины в круглых скобках через запятую.
- •4.3.1. Программа расчета реактора средствами Mathcad
- •Литература
- •Приложения
- •Приложение 1. Термодинамические свойства веществ
- •Приложение 2. Средняя мольная теплоемкость веществ
- •Приложение 3. Соотношения размерностей физических величин
- •Контрольные вопросы
- •Раздел 1
- •Раздел 2
- •Раздел 3
- •Раздел 4
- •Раздел 5
- •Раздел 6
- •Задачи
- •Задание 1
- •Задание 2
- •Задание 3
- •Задание 4
- •Задание 5
- •Задание 6
- •Задание 7
- •Задание 8
- •Задание 9
- •Задание 10
- •Задание 11
- •Задание 12
- •Задание 13
- •Задание 14
57
4.РАСЧЕТЫ НА ПЕРСОНАЛЬНЫХ КОМПЬЮТЕРАХ
Спомощью программы STR, использующей встроенные программы и банк данных, а также стандартных пакетов Excel и Mathcad рассчитывают:
•константу равновесия по термодинамическим данным;
•равновесную степень превращения ХА*;
•теплофизические параметры смеси при заданных условиях ХТП;
•тепловые эффекты реакций;
•материальные и тепловые балансы процессов;
•основные параметры реакторов при различных условиях теплообмена.
Порядок работы
* На диске Е выбрать директорию STR. Запустить программу файлом <1.bat>;
* после запуска программы на экране появится меню системы, каждый пункт которого содержит ряд подпрограмм, соответствующий тому или иному виду расчетных заданий.
4.1.Расчет Кр
Впункте меню <Расчет констант химического равновесия> ввести условия за-
дачи, а именно:
*в режиме <Реакция> записать соответствующее стехиометрическое уравнение
ипосле нажатия клавиши <Enter> ввести данные о потоке и среде в соответствии с условием задачи (рис.4.1, 4.2 Приложения 4);
*получить результат расчета в виде таблицы данных (рис.4.3 Приложения 4);
Задача 1
Получить зависимости Кр=f(T,Р) для процесса окисления сернистого ангидрида
2SO2+О2 2SO3+Q и записать аппроксимацию функцию Кр=f(T) при условиях:
*температурный интервал - 400-600оС с шагом 100 градусов;
*диапазон давлений - 1-9 атм с шагом 2 атм;
*cостав реакционной смеси (мол. доли): SO2-0,5536; О2 - 0,2679, SО3-0,1785.
Решение
УГХТУ, кафедра общей химической технологии

58
Выполнить действия по п.4.1. Получить данные в табл.4.1.
|
|
|
|
Таблица 4.1. |
|
|
Расчет константы равновесия |
|
|
|
|
|
|
|
Т=400 0С |
|
Идеальная Kp=0,27096 106, ат-0,5 |
|
|
|
|
|
|
|
Состав |
мол.% |
|
Р, ат |
Неид. Кр 10-6, ат-0,5 |
|
|
|
|
|
SO2 |
55,36 |
|
1 |
0,27131 |
|
|
|
|
|
O2 |
26,79 |
|
3 |
0,27203 |
|
|
|
|
|
SO3 |
17,86 |
|
5 |
0,27275 |
|
|
|
|
|
|
|
|
7 |
0,27348 |
|
|
|
|
|
|
|
|
9 |
0,27420 |
|
|
|
|
|
Т=500 0С |
|
Идеальная Kp=3097,1, ат-0,5 |
|
|
|
|
|
|
|
Состав |
мол.% |
|
Р, ат |
Неид. Кр, ат-0,5 |
|
|
|
|
|
SO2 |
55,36 |
|
1 |
3099,8 |
|
|
|
|
|
O2 |
26,79 |
|
3 |
3105,0 |
|
|
|
|
|
SO3 |
17,86 |
|
5 |
3110,3 |
|
|
|
|
|
|
|
|
7 |
3115,5 |
|
|
|
|
|
|
|
|
9 |
3120,8 |
|
|
|
|
|
Т=600 0С |
|
Идеальная Kp=101,4, ат-0,5 |
|
|
|
|
|
|
|
Состав |
мол.% |
|
Р, ат |
Неид. Кр, ат-0,5 |
|
|
|
|
|
SO2 |
55,36 |
1 |
101,48 |
|
|
|
|
|
|
O2 |
26,79 |
3 |
101,55 |
|
|
|
|
|
|
SO3 |
17,86 |
5 |
101,71 |
|
|
|
|
|
|
|
|
7 |
101,82 |
|
|
|
|
|
|
|
|
9 |
101,93 |
|
Пример оформления результатов в программе Excel приведен ниже.
4.2. Расчет равновесной степени превращения ХА*
Расчет ХА* провести по уравнению (1.21). Для этого необходимо:
•вызвать программу Excel;
•ввести состав, стехиометрические коэффициенты и Кр, рассчитанную для данных Т и Р;
•ввести в свободную ячейку В24 формулу (1.29) в виде, пригодном для решения;
•выбрать в меню <Сервис> команду <Поиск решения > и указать в качестве целе-
УГХТУ, кафедра общей химической технологии

59
вой функции "Y"(B24) ячейку с формулой для расчета ХА*;
•в режиме <Поиск решения> установить минимальное значение "0". В окно <Изменяя ячейки> ввести номер ячейки с начальным приближением (для ХА* рекомендуется значение 0,5). В окно <Ограничения> ввести пределы изменения
0,01≤ХА*≤ 0,99.
•получить значение ХА*. Выражение для расчета по уравнению (1.21) ввести в
ячейку С10 (см. таблицу).
|
Реакция: 2SO2 + O2 = 2SO3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
А |
|
B |
|
|
|
|
C |
D |
|
|
|
|
|
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Р, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
n SO2= |
|
|
0,45 |
ν SΟ2= |
|
|
2 |
|
|
атм |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
4 |
|
nO2= |
|
|
0,55 |
νO2= |
|
|
|
1 |
|
|
1 |
|
|
|
Т,0С= |
|
|
|
|
500 |
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
5 |
|
n SO3= |
|
|
0 |
ν SO3= |
|
|
2 |
|
|
|
|
|
|
|
|
Кр= |
|
|
55,652 |
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
|
∆ν =2−(1+2) |
|
-1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
|
X |
|
|
|
|
Y=0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
10 |
|
|
|
0,8804 |
|
|
-6,4E-07 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(nSO3 |
|
|
|
|
|
νSO3 |
|
* |
|
|
|
ν |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
nSO2XSO2 ) |
|
SO3 |
|
|
|
|
|
|||||||||||
|
K p |
= ( |
|
|
|
|
P |
|
) |
ν |
|
|
|
|
νSO2 |
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
ν |
|
|
* |
|
|
|
|
|
* |
|
|
|
ν |
|
|
|
|
|
|
νO2 |
|
|
|
|
* |
|
ν |
|
|
|
|
||||||
|
|
|
1 |
+ |
|
|
nSO2XSO2 |
|
nSO2 (1 |
− XSO2 ) |
|
SO2 (nO2 − |
|
|
nSO2XSO2 ) |
|
O2 |
|
|||||||||||||||||||||||
|
|
|
νSO2 |
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
νSO2 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
−1 |
|
|
|
|
(0,0 + |
2 |
0,45 XSO* 2 )2 |
|
|
|
|
|
|||||||||||||
|
|
55,652=( |
|
|
|
|
|
|
) |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
1+ |
−1 |
0,45 XSO2* |
|
0,45(1 |
−XSO2* |
)2(0,55− |
1 |
0,45 XSO2* |
)1 |
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
||
Задача 2
Получить зависимость констант скорости k, константы равновесия Кр и равновесной степени превращения ХА* от Т и для процесса окисления сернистого ангидрида 2SO2+О2 2SO3+Q в температурном диапазоне 400-520оС при давлении 1 ат; со-
став реакционной смеси: nSO2-0,45; nO2 - 0,55, nSO3-0,0. Средствами Excel выполнить
УГХТУ, кафедра общей химической технологии
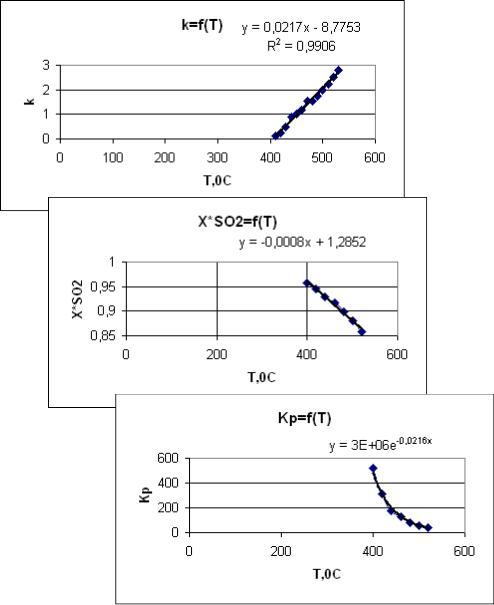
60
графическую обработку данных в координатах Кр ,k, ХА*=f(T) и аппроксимировать зависимости соответствующими уравнениями. При построении графиков выбрать режим <Точечная диаграмма> и флажок <Вывести уравнение>.
Решение
Рассчитать значения Кр и ХА* как показано выше. Из справочника [12] взять значения константы скорости k1. Пример оформления температурной зависимости константы скорости при помощи программы Excel приведен ниже.
T |
k |
410 |
0,12 |
420 |
0,26 |
430 |
0,47 |
440 |
0,89 |
450 |
1,02 |
460 |
1,18 |
470 |
1,53 |
480 |
1,54 |
490 |
1,74 |
500 |
1,97 |
510 |
2,23 |
520 |
2,5 |
530 |
2,81 |
T |
Kp |
XA* |
400 |
520,74 |
0,957 |
420 |
315,71 |
0,945 |
440 |
179,05 |
0,929 |
460 |
126,27 |
0,917 |
480 |
82,89 |
0,899 |
500 |
55,65 |
0,88 |
520 |
38,14 |
0,859 |
4.3. Расчет реактора с испол й
При расчете реакторов основную сложность представляет установление вида кинетического уравнения. На практике, особенно для распространенных каталитических процессов, широко используют эмпирические уравнения.
УГХТУ, кафедра общей химической технологии

61
Так, например, при окислении сернистого ангидрида на ванадиевом катализаторе в интервале температур 300-7000С для определения Кр можно пользоваться двучленным уравнением:
lgKp = |
495 |
− 4,6455 , |
(4.5) |
|
T |
|
|
где 495 и 4,6455 – численные константы.
Равновесную степень превращения ХА* рассчитывают по формуле [12]:
X*A = |
|
|
Kp |
|
|
(4.6) |
|
|
|
|
|
||
Kp + |
100 −0,5nSO2X*A |
|
||||
|
|
|
|
|||
|
P(nO2 −0,5nSO2X*A |
|
|
|
||
Кинетика процесса окисления SO2 на ванадиевых катализаторах наиболее точно описывается уравнением Борескова-Иванова [12]:
r = k |
P |
|
PSO2 |
[1−( |
PSO3 |
|
|
)2 ] |
(4.7) |
|
+ 0,8PSO3 |
KpPSO2 |
|
|
|||||
|
1 O2 PSO2 |
|
PO2 |
|
|||||
где k1- константа скорости реакции.
Расчеты с использованием эмпирических уравнений достаточно трудоемки и выполняют с использованием компьютеров.
Задача 3
Рассчитать РИС-Н и скорость реакции SO2+0,5O2 SO3+Q при следующих условиях: Р - 1 ат; kto= 10 ккал/м2 град ч; температура теплоносителя Tс =150С; расход потока50000 м3/ч; начальная температура Т1=4600С; состав реакционной смеси: nSO2- 0,09; nO2-0,11; nN2-0,8.
1.Политермический режим:
•рассчитать объем реактора Vr и подобрать поверхность трубчатого теплооб-
менника Fto при конечной температуре Т2=7000С;
3.Изотермический режим:
•подобрать поверхность трубчатого теплообменника Fto;
4.Адиабатический режим:
• рассчитать объем реактора Vr и температуру на выходе из реактора Тad;
Решение
УГХТУ, кафедра общей химической технологии
