
- •1. Предмет і мета дисципліни, її місце і роль в навчальному процесі
- •2. Задачі навчальної дисципліни
- •3. Тематичний план та зміст лекційного курсу
- •5. Лабораторні заняття
- •6. Індивідуальні та домашні завдання для самостійної роботи студентів
- •7. Зміст модулів навчальної дисципліни, їх оцінювання в балах, форми і терміни поточного і модульного контролю
- •8. Використання інформаційних технологій або елементів дистанційного навчання
- •9. Критерії контролю успішності навчальної роботи студентів
- •10. Питання для контрольних робіт студентів-заочників
- •11. Питання до екзаменаційних білетів Перший принцип термодинаміки
- •Другий принцип термодинаміки
- •Хімічна рівновага
- •Фазова рівновага і основи фізико-хімічного аналізу
- •Розчини електролітів
- •Електрохімія
- •Хімічна кінетика
- •Поверхневі явища та властивості дисперсних систем
- •12. Список рекомендованої літератури Основна
- •Таблиця відповідності рейтингових балів за національною та європейською шкалами
Електрохімія
Механізм виникнення електродних потенціалів.
Що таке гальвані-потенціал та вольта-потенціал?
Що називають електродом?
Які реакції перебігають в гальванічному елементі на позитивному та негативному електродах (відповідно)?
Класифікація електродів. Наведіть приклади та напишіть для них рівняння Нернста.
Що позначає термін «ЕРС»? Чи може її величина бути від’ємною?
Що позначають терміни «електродний потенціал» та «стандартний електродний потенціал»?
Як класифікують гальванічні елементи?
Які реакції перебігають в електролізері на позитивному та негативному електродах (відповідно)?
Як зміниться потенціал хлорсрібного електрода з підвищенням концентрації хлорид-іонів?
Что уявляють собою електроди І та ІІ рода? Наведіть приклади та напишіть для них рівняння Нернста.
Охарактеризуйте газові електроди, наведіть приклад та запишіть для нього рівняння Нернста.
Охарактеризуйте окисно-відновні електроди, наведіть приклад та запишіть для нього рівняння Нернста.
Нарисуйте та опишіть будову скляного електрода. Запишіть для нього рівняння Нернста.
Чи можна розрахувати рН розчину за результатами вимірювання ЕРС?
Які електроди можуть бути використані, як датчики при рН-метрії? Наведіть приклад та запишіть для нього рівняння Нернста.
Як зміниться потенціал водневого електрода зі збільшенням активності іонів гідроксонію у розчині або тиску водня?
Як зміниться потенціал хінгидронного електрода при зниженні рН?
У яких елементів величина е.р.с не залежить від величин стандартних електродних потенціалів? Наведіть приклад.
Що таке дифузійний потенціал? Внаслідок чого він виникає? Чи можлива його термодинамічна трактовка?
В якому випадку можна виміряти ЕРС за допомогою вольтметра? Відповідь обгрунтуйте.
Як залежить е.р.с гальванічного елемента від температури?
До якого типу відносяться елемент Вестона та елемент Даніеля – Якобі?
Наведіть приклади хімічних кол з переносом та без переносу.
Наведіть приклади концентраційних кол з переносом та без переносу.
Як можна визначити коефіцієнт активності електроліта, вимірюючи ЕРС?
В чому полягає фізичний сенс числа Фарадея? Як розрахувати його числове значення?
Для окисно-відновного елемента Pt| Cr3+, Cr2+ || MnO4-, Mn2+, Н+ | Pt (a(MnO4-) = 0,1 моль/1 кг Н2О; a(Mn2+) = 0,02 моль/1 кг Н2О; a (Cr3+) = 0,01 моль/1 кг Н2О; a (Cr2+) = 0,01 моль/1 кг Н2О; а (Н+) = 0,2 моль/1 кг Н2О) за стандартними електродними потенціалами напишіть рівняння та обчисліть константу рівноваги реакції окиснення –відновлення. Розрахуйте е.р.с елемента при 298 К.
Для реакції, яка перебігає в гальванічному елементі 2Hg + ZnCl2 = Hg2Cl2 + Zn, дано рівняння залежності е.р.с від температури E = 1 + 9,4 · 10-5 · (T - 288). При заданій температурі Т = 303 К розрахуйте е.р.с Е, зміну енергії Гіббса ΔG, зміну ентальпії ΔН, зміну ентропії ΔS в цьому процесі.
Як мають бути складені гальванічні елементи та напівелементи, щоб в них перебігали реакції: а) Н2 + Сl2 = 2HCl; б) 2Hg + ZnCl2 = Hg2Cl2 + Zn; в) MnO4- + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O.
Розрахуйте рН розчину, в якому потенціал хінгідронного електрода дорівнює 0,399 В (н.в.е.).
При 298 К ЕРС гальванічного елемента
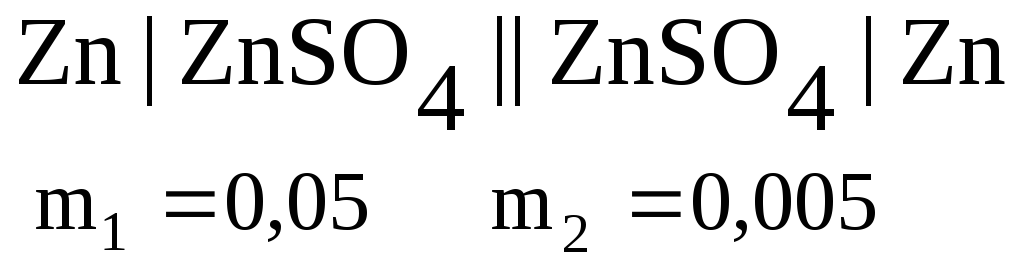 складає 0,0185 В.
Обчислите середній іонний
коефіцієнт активності в концентрованому
розчині, якщо в розбавленому він складає
0,477.
складає 0,0185 В.
Обчислите середній іонний
коефіцієнт активності в концентрованому
розчині, якщо в розбавленому він складає
0,477.По ЕРС (E = 0,286 В) елемента Cd|CdI2| AgI, Ag розрахуйте активність CdI2 в розчині.
Стандартна ЕРС елемента
 при 298 К дорівнює 0,2680 В. Обчислите ЕРС
при наступних умовах
при 298 К дорівнює 0,2680 В. Обчислите ЕРС
при наступних умовах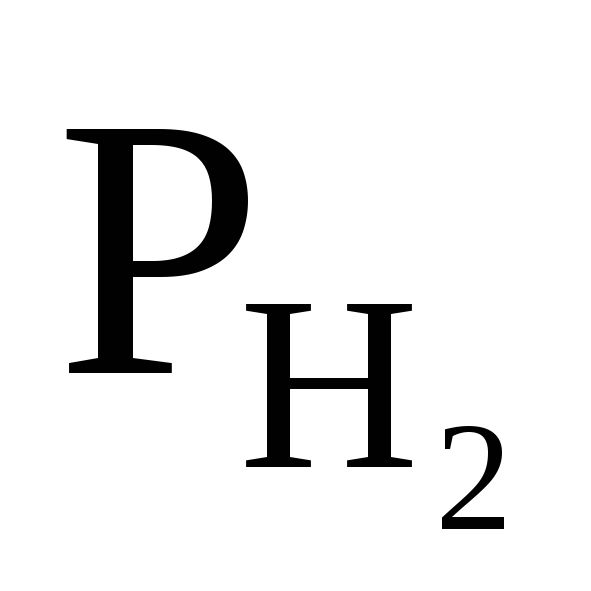 = 0,01 атм.; m
= 0,001 ммоль/1 кг води; γ±
= 0,809.
= 0,01 атм.; m
= 0,001 ммоль/1 кг води; γ±
= 0,809.Обчислите потенціал електрода
 ,
якщо тиск водню 0,9 атм., а активність
іона водню складає 0,05 моль/1 кг води.
,
якщо тиск водню 0,9 атм., а активність
іона водню складає 0,05 моль/1 кг води.По даним про стандартні електродні потенціали встановити, чи можлива в стандартних умовах в водному розчині реакція Ag + Fe3+ = Fe2+ + Ag+. Розрахуйте константу рывноваги реакції.
Для оборотного гальванічного елемента з двоелектронним переходом температурний коефіцієнт ЕРС складає 0,3388 мВ/К. Визначіть, виділяється або поглинається теплота при роботі цього елемента та чому дорівнює ця теплота при температурі 302 К.
