
- •1. Предмет і мета дисципліни, її місце і роль в навчальному процесі
- •2. Задачі навчальної дисципліни
- •3. Тематичний план та зміст лекційного курсу
- •5. Лабораторні заняття
- •6. Індивідуальні та домашні завдання для самостійної роботи студентів
- •7. Зміст модулів навчальної дисципліни, їх оцінювання в балах, форми і терміни поточного і модульного контролю
- •8. Використання інформаційних технологій або елементів дистанційного навчання
- •9. Критерії контролю успішності навчальної роботи студентів
- •10. Питання для контрольних робіт студентів-заочників
- •11. Питання до екзаменаційних білетів Перший принцип термодинаміки
- •Другий принцип термодинаміки
- •Хімічна рівновага
- •Фазова рівновага і основи фізико-хімічного аналізу
- •Розчини електролітів
- •Електрохімія
- •Хімічна кінетика
- •Поверхневі явища та властивості дисперсних систем
- •12. Список рекомендованої літератури Основна
- •Таблиця відповідності рейтингових балів за національною та європейською шкалами
Другий принцип термодинаміки
Наведіть формулювання другого принципа термодинаміки.
Що таке ентропія? Чи можна визначити абсолютні значення ентропії та ентальпії речовини? Поясніть, чому.
Як визначити абсолютну ентропію речовини? Які дані для цього потрібні?
Що є критерієм напрямку хімічної реакції в ізольованій системі?
Як змінюєтся ентропія при довільних кристалізації, конденсації або десублімації в ізольованій системі?
Термодинамічна система складається з 5 частин з ентропіями S1, S2, S3, S4 та S5. Чому дорівнює ентропія системи?
Розрахуйте зміну ентропії О2 при ізотермічному стисненні від р1 = 1,013 · 105 Па до р2 = 4 · 105 Па при 280 К. Газ вважати ідеальним.
Розрахуйте збільшення ентропії при змішуванні 0,5 л СО2 та 0,75 л N2 при 298 К та 1,013 · 105 Па.
Розрахуйте зміну ентропії при кристалізації бензолу при 5,5°С, якщо ΔНпл = 9,95 кДж/моль.
Які існують критерії для визначення спрямованості довільного перебігу та рівноваги фізико-хімічних процесів?
Розрахуйте зміну ентропії при 25оС для реакції
 .
.Складіть вираз, що дозволяє розрахувати абсолютну ентропію 1 моля чистої речовини при температурі Т.
Нарисуйте графік зміни ентропії води від температури в інтервалі від 10оС до 110оС і сталому тиску.
У термодинаміці існує таке співвідношення:
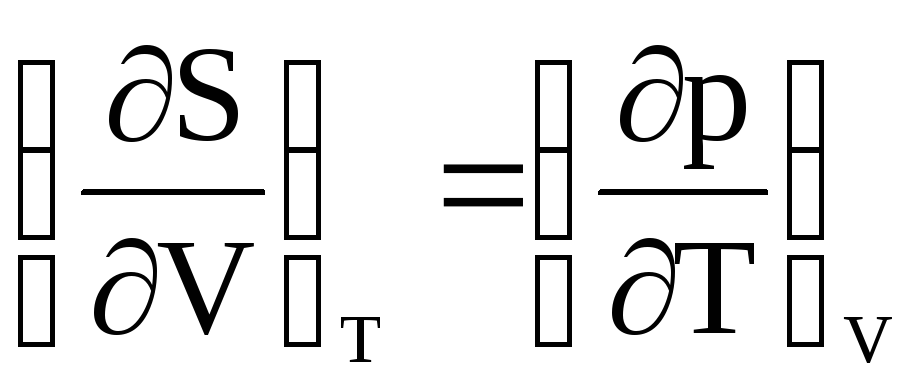 ,
яке називається співвідношенням
Максвела. Використовуючи це рівняння
і рівняння стану ідеального газу
виведіть рівняння для розрахунку зміни
ентропії в ізотермічному процесі
розширення.
,
яке називається співвідношенням
Максвела. Використовуючи це рівняння
і рівняння стану ідеального газу
виведіть рівняння для розрахунку зміни
ентропії в ізотермічному процесі
розширення.Часткова похідна ентропії за температурою визначається рівнянням:
 .
Використовуючи це рівняння виведіть
рівняння для розрахунку зміни ентропії
при ізобарному нагріванні 1 моля газу
від Т1
до Т2.
.
Використовуючи це рівняння виведіть
рівняння для розрахунку зміни ентропії
при ізобарному нагріванні 1 моля газу
від Т1
до Т2.
Використовуючи співвідношення
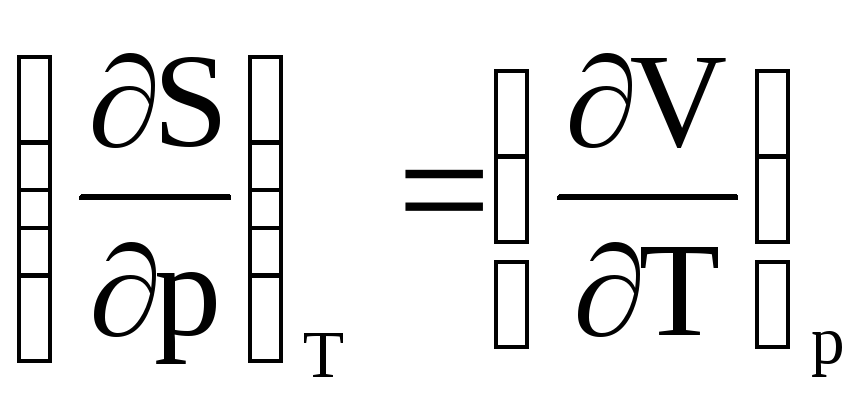 виведіть
рівняння для розрахунку зміни ентропії
при ізотермічному стисненні 1 моля
ідеального газу від р1
до р2.
виведіть
рівняння для розрахунку зміни ентропії
при ізотермічному стисненні 1 моля
ідеального газу від р1
до р2.
При плавленні ентропія зростає на величину
 .
Як при цьому змінюється ентропія
навколишнього середовища, якщо процес
плавлення оборотний?
.
Як при цьому змінюється ентропія
навколишнього середовища, якщо процес
плавлення оборотний?Використовуючи довідкові дані, розрахуйте стандартну зміну ентропії в реакції Н2 + Br2 = 2HBr а) при 25оС, б) при 300оС.
У якому з процесів: ізотермічному, адіабатичному, ізохоричному чи ізобаричному при оборотному їхньому перебігу не відбувається зміни ентропії і чому?
Розрахуйте зміну ентропії 14 г СО при ізобарному нагріванні від Т1 = 298 К до Т2 = 400 К.
Обчисліть зміну ентропії реакції 2С2Н5ОН = (СН3)2СО + 3Н2 + СО при температурі 700 К і тиску 1,013.105 Па.
Для газоподібного формальдегіду Ср як функція температури виражається рівнянням Ср = 18,82 + 58,38 ·10-3 ·Т - 15,61.10-6 · Т2 Дж/моль·К. Знайдіть зміну ентропії 1 моля газоподібного формальдегіду при нагріванні його від 298 К до 1000 К. Знайдіть абсолютну ентропію формальдегіду при 1000К.
Серед перелічених параметрів назвіть інтенсивні: U, H, p, S, T, Cp, V, G, μ.
Якщо прямий процес довільний, то чи може зворотний процес теж бути довільним?
За допомогою співвідношення δW' ≤ TdS – dU – pdV знайдіть термодинамічну функцію, яка є критерієм довільного процесу і рівноваги в умовах сталості V і Т.
Система знаходиться при сталій температурі і об’ємі. Яку термодинамічну функцію необхідно вибрати у якості критерію рівноваги для цієї системи? Які умови рівноваги і довільного перебігу процесу при сталих Т і V?
Знайдіть зміну
 при стисненні 1 моля рідкого бензолу
від р1
= 1,013.105
Па до р2
= 5,065.105
Па при 0оС.
Стисливістю рідини у зазначеному
інтервалі тиску знехтувати. Густина
рідкого бензолу при 0оС
дорівнює 0,879 г/см3.
при стисненні 1 моля рідкого бензолу
від р1
= 1,013.105
Па до р2
= 5,065.105
Па при 0оС.
Стисливістю рідини у зазначеному
інтервалі тиску знехтувати. Густина
рідкого бензолу при 0оС
дорівнює 0,879 г/см3.
Чи може хімічна реакція, що відбувається за сталих р і Т, для якої зміна ентропії менше нуля, бути довільною?
При нагріванні ідеального газу від 100оС до 200оС при сталому тиску зміна енергії Гіббса ΔG склала -26850 Дж (тобто ΔG < 0). Чи означає це, що процес нагрівання є довільним?
Як змінюється енергія Гіббса при сталості р і Т при перебігу самодовільного процесу? Як змінюється енергія Гельмгольца за цих же умов?
В якому випадку зміна енергії Гіббса дорівнює зміні енергії Гельмгольца?
Чи можна і в якому випадку за знаком зміни ентальпії
 у ході хімічної реакції судити о
можливості її перебігу при сталості р
і Т?
у ході хімічної реакції судити о
можливості її перебігу при сталості р
і Т?Розрахуйте
 і
і для хімічної реакції 2As
+ 1,5O2
= As2O3.
Об’ємом твердих речовин знехтувати.
Газ вважати ідеальним.
для хімічної реакції 2As
+ 1,5O2
= As2O3.
Об’ємом твердих речовин знехтувати.
Газ вважати ідеальним.
Докажіть рівність
 .
.
Прийнявши, що речовини, які приймають участь в реакції H2 + Br2 = 2HBr, є ідеальними газами, знайдіть, чому дорівнює різниця
 .
.Чи можлива при 298 К та тиску 1,013 · 105 Па реакція 2NH3 + 7SO3 = 2NO2 + 3H2O + 7SO2?
