18. Рівняння Клапейрона-Менделєєва. Універсальна газова стала. Закон Дальтона
Рівняння
стану ідеального газу (Рівняння Менделєєва
- Клапейрона)
1.
Встановлює залежність між макропараметрами
ідеального газу.
2.
Визначення. Для газу
постійної маси об’єм помножений на
тиск і поділений на температуру є
постійною величиною.
3.
 ,
або
,
або ,
,
 де
де
4.
Рівняння виведено для ідеального газу.
Але його можна використовувати і для
реальних газів та парів. Проте застосовувати
рівняння стану ідеального газу в умовах
низької температури і великого тиску
не можна, бо між молекулами газу прояв
сил взаємодії стає більшим і виникає
необхідність їх врахування.
Виведення
рівняння стану ідеального газу
Відправляємося
від формули залежності тиску ідеального
газу від температури
p=nkT;
 ;
; ;
; ;
; ;
;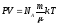 ;R=kNA;
;R=kNA;

Універсальна
газова стала R
1.
Це коефіцієнт пропорційності в рівнянні
стану ідеального газу.
2.
Визначення. Це робота,
яку виконує один моль ідеального газу
під час зміни його температури на 1 К
при постійному тиску.
3.
Це скалярна величина.
4.
R=8,31
5.
[R]=Дж/(моль·К).
Закон
Дальтона
1.
Встановлює, чому дорівнює тиск суміші
газів.
2.
Визначення. Тиск суміші
газів дорівнює сумі їх парціальних
тисків.
3.
p=p1+p2+…+pn
4.Застосовують
для сумішей газів, взятих за умов,
близьких до нормальних.
*
Парціальний тиск - це тиск одного, окремо
взятого від суміші, газу.
1Макросистема(від грецького μάκρος
(макрос)- великий, довгий та σύστημα
- складений) - це велика сукупність
молекул.


 ,
або
,
або ,
,
 де
де
 ;
; ;
; ;
; ;
;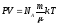 ;R=kNA;
;R=kNA;
