
- •19. Внутрішня енергія. Внутрішня енергія ідеального газу. Ступені вільності молекул. Розподіл енергії молекул по ступенях вільності.
- •20. Теплота і робота. Перший закон термодинаміки.
- •21. Оборотні процеси. Поняття ентропії. Властивості ентропії
- •22. Призначення і принцип дії теплових двигунів. Кругові процеси (цикли). Коефіцієнт корисної дії теплового двигуна.
- •23. Другий закон термодинаміки. Теорема Карно. Цикл Карно. Наслідки теореми Карно.
21. Оборотні процеси. Поняття ентропії. Властивості ентропії
Оборотні процеси
У природі існують оборотні і необоротні процеси. До оборотних процесів відносять механічний рух тіл у вакуумі при відсутності сил опору. Усі інші процеси природи - необоротні.
* Оборотній процес – це процес, при якому можливе повернення системи в початковий стан без будь – яких перетворень у навколишньому середовищі. Наприклад, прямий напрям: камінь кидають вгору з початковою швидкістю v0, під час польоту кінетична енергія каменя Wк переходить в потенціальну Wп.
Зворотній напрям - камінь, піднявшись на висоту h, падає вниз. При падінні потенціальна енергія каменя Wп переходить у кінетичну Wк..
Визначення.Необоротній процес - це процес, при якому неможливе повернення системи в початковий стан без перетворень у навколишньому середовищі.
Необоротній процес може протікати тільки в прямому напрямі.
Наприклад, прямий напрям, камінь кидають униз. Під час падіння потенціальна енергія каменя Wп переходить у його внутрішню енергію U, тобто камінь нагрівається.
Зворотній
напрям - камінь охолонув і від цього
підстрибнув на висоту h.
Такого процесу у природі не існує.
Необоротність теплових процесів пов’язана не з природою молекул, а з їхньою кількістю. Оскільки у теплових процесах бере участь величезна кількість молекул, то вони необоротні. Як приклад розглянемо дві посудини з перегородками в лівій частині яких знаходиться газ (Рис. 21.1). В першій посудині усього три молекули, а в другій 1025. Якщо в посудинах ліквідувати перегородки і спробувати дочекатися доки всі молекули займуть початкове положення. То для посудини з трьома молекулами це цілком можливо. Що до іншої посудини то молекули ніколи не зможуть самостійно зібратися в лівій частині посудини.
Поняття ентропії
1. Поняття ентропії введено в 1865 р Р. Клаузиусом. термодинамічна функція, що характеризує міру невпорядкованості термодинамічної системи, тобто неоднорідність розташування і руху її частинок.
2. Визначення. Ентропія це функція, диференціал якої дорівнює відношенню кількості теплоти отриманого системою (або забраного від системи) в даному процесі, до абсолютної температурі.
3. Це скалярна величина
4.
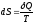
5. [S] = Дж/К
Властивості ентропії
1. Ентропія є екстенсивною величиною (залежить від маси і об'єму системи), тому сумарна ентропія двох систем S=S1+S2,
2. Ентропія є функцією стану системи. Якщо обидва стани рівноважні то зміна ентропії не залежить від способу переходу з кінцевого стану у початковий.
3. У самочинних процесах, які протікають в ізольованій системі, ентропія зростає (ΔS>0). Ця властивість є основою другого закону термодинаміки.
4. Для оборотних процесів зміна ентропії ΔS = 0.
5. Ентропія системи, що виконує необоротний процес, зростає: ΔS> 0
Таким чином:
|
Зміна ентропії |
Процес |
|
ΔS=0 |
Оборотний, може протікати у прямому і в зворотному напрямках. |
|
ΔS>0 |
Необоротний, самостійно протікає тільки в одному напрямку. |
|
ΔS<0 |
Не може протікати самостійно, необхідне підведення енергії ззовні. |
