
- •Міністерство освіти і науки України
- •Кафедра природничо-наукової підготовки
- •Методичні рекомендації до виконання лабораторних робіт
- •I на основі освітньо-кваліфікаційного рівня «молодший спеціаліст»
- •Херсон – 2014
- •Правила техніки безпеки у лабораторії хімії
- •Основні правила
- •Обов’язкові вимоги до техніки безпеки при роботі студентів у хімічній лабораторії.
- •Надання першої медичної допомоги при нещасних випадках.
- •Правила надання першої медичної допомоги
- •Лабораторна робота №1, 2 Тема: Найважливіші класи неорганічних сполук (теоретичні відомості)
- •Властивості кислот
- •Номенклатура солей
- •Класи неорганічних сполук (лабораторна робота)
- •I. Одержання та властивості оксидів
- •II. Одержання та властивості основ
- •III. Отримання та властивості солей
- •Контрольні питання та вправи
- •Лабораторна робота №3
- •Теоретичні відомості
- •Електроліз розчинів та розплавів солей. Корозія суднових конструкцій.
- •Теоретичні положення
- •Електроліз розчинів
- •Хід роботи
- •Лабораторна робота №5 Окисно-відновні реакції
- •Теоретичні відомості Окисно-відновні реакції
- •Класифікація окисно-відновних реакцій (таблиця 2.1)
- •Складання рівнянь окисно-відновних реакцій методом електронного балансу
- •Питання до захисту лабораторної роботи.
- •Лабораторна робота №6 Властивості сполук заліза.
- •Теоретичні відомості
- •Питання до захисту лабораторної роботи.
- •Список використаної літератури
- •Лабораторна робота №7
- •Теоретичні відомості Класифікація методів захисту від корозії
- •Захисні покриття
- •Хід роботи
- •Контрольні питання
- •Лабораторна робота №8 Гідроліз солей Al2(so4)3, Na2s, BaCl2, CuSo4.
- •Теоретичні відомості
- •Класифікація електролітів (таблиця 4.1)
- •Хід роботи
Властивості кислот
З точки зору теорії електролітичної дисоціації загальні властивості кислот обумовлені наявністю катіонів гідрогену.
У розчинах кислот індикатори змінюють своє забарвлення відповідним чином. Наприклад, лакмус стає червоним, метиловий оранжевий – рожевим.
Кислоти взаємодіють з металами, які знаходяться ліворуч гідрогену в ряду стандартних електронних потенціалів, з утворенням солі та відділенням водню:
2Аl
+
3H2SO4
= Аl2(SO4)3
+ 3Н2
![]()
Водень не утворюється при взаємодії металів з нітратною та концентрованою сульфатною кислотами:
3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
Кислоти також реагують з основами та основними оксидами:
H2SO4 + Мg(ОН)2 = МgSO4 + 2Н2O
2HNO3 + СаО = Са(NO3)2 + Н2O
При взаємодії кислот з солями утворюються нові солі та кислоти:
2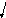
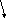 НСl
+
СаСO3
= СаСl2
+
Н2СO3
НСl
+
СаСO3
= СаСl2
+
Н2СO3
СO2 Н2O
H2SO4
+ ВаСl2
= ВаSO4![]() +
2НСl
+
2НСl
Кислоти можна отримати таким чином:
1. Гідратацією кислотних оксидів
Р2O5 + 3Н2O = 2Н3РO4
2. Реакціями обміну солі з кислотою:
Са3(РO4)2 + 3H2SO4 = 3СаSO4 + 2Н3РO4
Амфотерні гідроксиди проявляють як основні, так і кислотні властивості. До них відносять, наприклад, гідроксиди хрому (III), цинку, берилію, алюмінію та інші.
Амфотерні гідроксиди здатні реагувати як з кислотами, так і з лугами. З кислотами вони ведуть себе як основи, а з лугами – як кислоти. Для того, щоб встановити амфотерність гідроксиду, слід провести дві реакції взаємодії його як з кислотою, так і з лугом. Якщо обидві реакції відбуваються, то гідроксид є амфотерним:
Сr(ОН)3 + 3НСl = СrСl3 + 3Н2O
Сr(ОН)3 + 3NaOН = Na3[Cr(OH)6]
Солі це електроліти, при дисоціації яких утворюються катіони металів (чи іони амонію NH4+) та аніони кислотних залишків.
Солі поділяють на середні, кислі та основні.
Середні солі можна розглядати як продукти повного заміщення атомів гідрогену кислоти атомами металу чи в якості продуктів повного заміщення гідроксоаніонів основ кислотними залишками. Наприклад, натрій карбонат, калій сульфат, кальцій ортофосфат. Рівняння дисоціації середніх солей можна представити наступним чином:
K3РO4 = 3К+ + РO43–
NH4Cl = NH4+ + Cl–
Кислі солі становлять собою продукти неповного заміщення атомів гідрогену багатоосновних кислот атомами металів, їх утворюють тільки багатоосновні кислоти. Наприклад, натрій гідрогенкарбонат, кальцій дигідрогенфосфат, калій гідрогенсульфат.
Дисоціацію кислої солі можна представити рівнянням:
NаНСO3 = Nа+ + HCO3–
Са(Н2РO4)2 = Са2+ + 2H2РO4–
В подальшому гідроген-аніон дисоціює незначною мірою.
Основні солі за складом є продуктами неповного заміщення гідроксо-аніонів основ на кислотні залишки. Наприклад, купрум гідроксокарбонат, алюміній дигідроксонітрат, ферум (II) гідроксохлорид. Дисоціація основної солі може бути представлена рівнянням: МgОНСl = МgОН+ + Сl– В подальшому МgОН+ дисоціює незначною мірою.
Номенклатура солей
За сучасною номенклатурою назва солі утворюється із назви катіону (металу чи основного залишку) з зазначенням ступеня окиснення металу, якщо він може бути непостійним і назви аніона (кислотного залишку). Наприклад, СаСO3 – кальцій карбонат, МgСl2 – магній хлорид, Сr2(SO4)3 – хром (IIІ) сульфат.
Назви кислих солей утворюються додаванням до назви катіона назви гідроген-аніона, яка вказує на наявність атомів гідрогену в кислотному залишку, при необхідності – з використанням відповідних числівників, які відповідають кількості атомів гідрогену. Наприклад, NаНSO3 – натрій гідрогенсульфат, Са(Н2РO4)2 – кальцій дигідроген фосфат.
Як уже відмічалось, солі взаємодіють з кислотами і з лугами.
При взаємодії двох розчинних у воді солей утворюються дві нові солі, одна з яких повинна випадати в осад:
Ва(NO3)2
+
К2SO4
= 2KNO3
+
ВаSO4
![]()
Реакція металу з сіллю менш активного металу приводить до утворення іншої солі і витіснення менш активного металу. Вихідна сіль повинна бути розчинною у воді, а метал – знаходитись в ряду стандартних електронних потенціалів ліворуч металу, що витісняється із солі:
Fе + СuSO4 = FеSO4 + Сu
Середні солі можна отримати багатьма способами. Наприклад:
СаО + Н2SO4 = СаSO4 + Н2O
СаО + СO2 = CаСO3
Р2O5 + 6NаОН = 2Nа3РO4 + 3Н2O
Zn(ОН)2 + 2HNO3 = Zn(NO3)2 + 3Н2O
Ва(ОН)2 + К2СO3 = ВаСO3 + 2КОН
Мg
+
2НСl
= МgСl2
+
Н2
![]()
Н2SO4
+
ВаСl2
= ВаSO4
![]() +
2НСl
+
2НСl
Рb(NО3)2 + Na2SO4 = РbSO4 + 2NaNO3
Сu + 2АgNO3 = 2Аg + Сu(NO3)2
2Na + Cl2 = 2NaCl
Кислі солі можна отримати таким чином:
При взаємодії основ з надлишком кислоти:
NaОН + Н3РO4 = NаН2PО4 + Н2O
При взаємодії середньої солі з кислотою:
Na3РO4 + 2Н3РO4 = 3NaН2РO4
Основні солі можна отримати таким чином:
При взаємодії з надлишком основи:
Н2SO4 + 2Сu(ОН)2 = (СuОН)2SO4 + 2Н2O
При взаємодії середньої солі з недостачею лугу:
2СuSO4 + 2NаОН = (СuОН)2SO4 + Nа2SO4
Перетворення кислих і основних солей в середні відбувається:
при дії лугу на кислу сіль: NаНSO3 + NaОН = Na2SO3 +Н2O
Са(Н2РO4)2 + 2Са(ОН)2 = Са3(РO4)2 + 4H2O
при дії кислоти на основну сіль:
(СuОН)2SO4 + Н2SO4 = 2СuSO4 + 2H2O
