
- •Часть III
- •14.1. Нарушения общего объема крови
- •14.2. Нарушения количественного и качественного составов эритроцитов
- •13 — Пойкилоцитоз
- •14.3. Нарушения количественного и качественного составов лейкоцитов
- •14.4. Гемобластозы
- •14.4.1. Общая этиология
- •14.4.2. Общий патогенез
- •14.5. Лейкоз
- •14.6. Нарушения системы гемостаза
- •14.7. Гемофилия
- •Контрольные вопросы и задания
13 — Пойкилоцитоз
ретикулоциты — молодые недозрелые формы эритроцитов. Выявляют путем суправитальной окраски бриллианткрезилголу-бым. В них обнаруживают ярко-синие сеточки, тогда как зрелые эритроциты равномерно окрашены в зеленый цвет;
тельца Жолли — окрашенные в яркий цвет овальные или круглые образования, расположенные на поверхности эритроцита;
кольца Кебота выступают в виде окрашенных в красный цвет образований, напоминающих форму кольца, двойных или тройных петель, овала. Они, как и тельца Жолли, представляют собой остатки ядерной субстанции.
Развитие анемии зависит от многих факторов, поэтому наибольшее значение в ветеринарной медицине придают их систематизации по патогенетическим признакам.
Постгеморрагическая анемия — состояние, связанное со значительной кровопотерей. Кровопотери являются следствием травматического повреждения стенки кровеносного сосуда. Нарушение ее целостности возможно в результате внешнего воздействия или патологических процессов, происходящих непосредственно в стенке сосуда либо в окружающих его тканях.
Кровопотеря может быть результатом излияния крови во внешнюю среду через сосуды поврежденной кожи, слизистых оболочек желудочно-кишечного тракта, дыхательного аппарата, мочеполовых путей. Такое кровотечение называют наружным. Выход крови через травмированные сосуды в полости приводит к внутренним кровотечениям. Скопление крови в брюшной полости носит название гемоперитонеума, в плевральной — гемоторакса, в полости перикарда — гемоперикардиума. Внутренние кровотечения опасны тем, что свертывание крови происходит намного медленнее, чем при наружном кровотечении, поэтому повреждение, даже мелких брыжеечных сосудов может завершиться летальным исходом. Кроме того, затруднена диагностика внутренних кровотечений, что мешает принятию своевременных лечебных мер. Опасность постгеморрагической анемии зависит также от количества и скорости истечения крови.
Острая постгеморрагическая анемия развивается быстро в результате повреждения крупных кровеносных сосудов. Анемию средней тяжести наблюдают при потере 30 % эритроцитов, потеря же 50—60 % крови сопровождается очень тяжелым состоянием животного, несовместимым с жизнью. Чувствительность к потере крови у разных животных неодинакова. Она зависит от видовых и индивидуальных особенностей организма, исходного состояния. Установлено, что наиболее чувствительны к кровопотере свиньи, собаки; наиболее устойчивы лошади, крупный рогатый скот.
Основным, ведущим патогенетическим фактором в развитии острой постгеморрагической анемии является снижение общего объема циркулирующей крови. Развивается гипотензия, сопровождающаяся коллапсом. Падение уровня артериального давления сочетается с эритропенией и кислородным голоданием тканей (гипоксией), к которому наиболее чувствителен головной мозг. По мере падения уровня артериального давления и развития гипоксии вовлекаются срочные механизмы компенсации.
В обычных условиях гомеостаз контролируют баро- и хеморецепторы, заложенные в сосудистых рефлексогенных зонах (дуга аорты, каротидный синус, устье полых вен). Гипотензия, измененный газовый состав крови, воспринимаются рецепторными образованиями. Информация от рецепторов передается сердечно-сосудистым центрам продолговатого мозга и тесно взаимодействующему с ними дыхательному центру. По центробежным нервам импульсы достигают органов-эффекторов. Стимулируется сердечная деятельность, выбрасывается депонированная кровь, сужаются сосуды, развивается компенсаторная одышка. В тяжелых случаях кровопотерь, нередко сопровождающих патологически протекающие роды у коров, одышка сопровождается необычным дыханием — широко открыт рот, свешен язык, дыхательные движения частые, поверхностные.
Наряду с рефлекторными компенсаторными реакциями развивающаяся гиповолемия стимулирует поступление в ток крови межклеточной жидкости, пополняющей ее объем. Гипоксемия и последующая гипоксия повышают образование гемопоэтинов, в том числе эритропоэтина, усиливающего эритропоэз в красном костном мозге. Интенсивное поступление в ток крови эритроцитов постепенно восстанавливает их содержание, нормализует функциональную активность системы красной крови. Процесс восстановления продолжается 2—3 нед.
Хроническая постгеморрагическая анемия — состояние, обусловленное сравнительно небольшими, но длительными кровотечениями. Причинами таких кровопотерь чаще всего бывают язвенные поражения желудка и кишечника у пушных зверей, свиней, собак; попадание инородных тел в преджелудки жвачных и прободение ими стенок рубца, сетки, книжки; развитие новообразований во внутренних органах животных и поражение ими тканей полового аппарата лошадей, собак; паразитоценозы лошадей, крупного рогатого скота. Кроме того, хроническая постгеморрагическая анемия может быть следствием острой кровопотери в условиях дефицита железа или функциональной недостаточности красного костного мозга, когда становится проблематичным быстрое восстановление функционально полноценных клеточных элементов системы красной крови.
Основным патогенетическим фактором, определяющим негативные для организма последствия хронической постгеморрагической анемии, является дефицит железа, который приводит к постепенному развитию гипоксии со всеми вытекающими неблагоприятными для организма последствиями.
Гемолитическая анемия возникает как следствие гемолиза эритроцитов различными агентами биологического, химического, физического происхождения. Разрушение эритроцитов, как правило, происходит в просвете кровеносных сосудов, но может быть и результатом усиленного эритроцитолиза в тканях, особенно селезенки.
Гемолитические агенты биологического происхождения имеют наибольшее значение в генезе рассматриваемой анемии. Прежде всего это большая группа возбудителей кровепаразитарных заболеваний животных — пироплазмоза лошадей, рогатого скота, свиней, собак; бабезиоза рогатого скота, оленей, свиней; нуталлиоза лошадей; анаплазмоза рогатого скота; трипаносомоза лошадей, крупного рогатого скота, верблюдов. Эти заболевания домашних животных объединены тем, что паразитирующие простейшие, попадая различными путями в организм, поселяются и размножаются внутри эритроцитов, разрушают их. Прогрессивно нарастает число гемолизированных клеток. Так, пироплазмоз крупного рогатого скота сопровождается падением числа эритроцитов в тяжелых случаях до 1 млн/мкл, а содержания гемоглобина — до 15— 20 г/л; нуталлиоз лошадей характерен возможным снижением количества эритроцитов до 3 млн/мкл, гемоглобина — до 31 г/л (рис. 19).
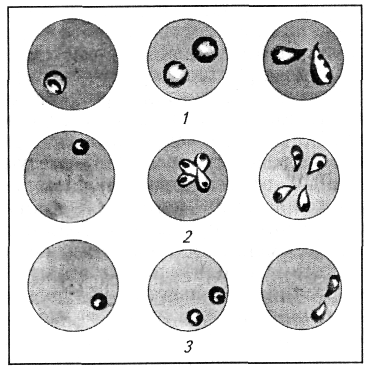
пироплазмоз овец; 2- нутталиоз лошадей; 3- бабезиоз крупного
рогатого скота
Продукты жизнедеятельности паразитов, циркулируя в крови, поражают жизненно важные органы (сердце, почки, печень, селезенка), приводят к нарушению их структуры и функции. Красный костный мозг не в состоянии пополнять дефицит эритроцитов. Развитие анемии сопровождается появлением в крови незрелых форм эритроцитов. Обнаруживаются анизоцитоз, пойкилоцитоз, базофильная зернистость. В крови появляются нормобласты, ретикулоциты. Изменяются количественный и качественный составы клеток белой крови.
Наряду с другими характерным клиническим признаком для всех болезней является гемоглобинурия, т. е. окрашивание мочи в бурый цвет («кровавая моча») за счет гемоглобина, освобождаемого гемолизированными эритроцитами.
Своевременное лечение больных гемоспоридиозами животных приводит к выздоровлению, хотя анемическое состояние и желтушность слизистых оболочек некоторое время еще сохраняются. Самоисцеление редко, чаще заболевшее животное, не получившее врачебной помощи, погибает.
Гемолитическая анемия биологического происхождения может быть обусловлена и ядами, попадающими в организм при укусах жалящими насекомыми (пчелы, осы, гнус), змеями. Особенно чувствительны к змеиному яду лошади. Нередки случаи смерти этих животных от гемолиза, обусловленного укусами ядовитых змей.
Разрушить мембрану эритроцитов способны также экзо- и эндотоксины бактерий (гемолитический стрептококк), вирусы (инфекционная анемия лошадей), переливание несовместимой крови, аутоантитела. Расстройствам функций иммунной системы, способствующим образованию аутоантител или стимуляции Т-киллерных клеток, направленных на уничтожение собственных эритроцитов, придают большое значение в современной гуманной медицине.
Аутоантитела как причина гемолитической анемии у животных только начинают привлекать интерес исследователей. Так, описана гемолитическая анемия с желтушным окрашиванием тканей у жеребят, мулят, ослят, вызванная гемолизинами, полученными с молоком от сенсибилизированных матерей. Гемолизирующие антитела возникали в организме матерей после перенесенного переливания крови, вакцинации прививочным материалом, содержащим эритроцитарные антигены, трансплацентарной изоиммунизации матери эритроцитарными антигенами плода. У молодняка крупного рогатого скота острая гемолитическая анемия проявлялась после вакцинации матерей препаратами, содержащими эритроцитарный антиген. Аналогичные поражения описаны и у свиней.
Гемолитическую болезнь новорожденных (желтуха новорожденных) наблюдают у поросят, телят, жеребят в случае несовместимости крови плода с кровью матери, оплодотворенной гомозиготным производителем в отношении эритроцитарных антигенов. Первые признаки болезни у поросят появляются спустя сутки после приема молозива. Появляется желтушность, ее тяжесть зависит от интенсивности разрушения эритроцитов. Течение острое, большинство заболевших погибает спустя 6—36ч.
У телят заболевание протекает остро и хронически. Острое течение болезни характеризуется тяжелой анемией, желтушностью слизистых оболочек, гемоглобинурией, летальным исходом в первые пять дней желтухи. Хроническое заболевание отличается медленным, относительно легким течением. Гематокрит изначально снижен до 18 %, а спустя 3 нед повышается до 30 %.
У жеребят проявление болезни вариабельно. Острое течение быстро сменяется коматозным состоянием. При более медленном развитии гемолитической анемии отмечаются гемоглобинурия, желтушность слизистых оболочек и склеры, одышка, усиление сердечного толчка, но животные выживают.
Гемолитическая анемия возникает и как следствие воздействия на организм химических токсигенов. К гемолитическим ядам относят соединения фосфора, мышьяка, меди, свинца, нитробензол, бертолетову соль, фенилгидразин, гербициды, инсектициды, другие соединения. Так, экспериментальная гемолитическая анемия у кур, вызванная введением фенилгидразина, сопровождалась использованием костномозгового резерва эритроцитов, активной пролиферацией эритро- и гранулоцитопоэтических клеток. Нормализация гемопоэза в костном мозге наступала уже спустя 7 дней после прекращения действия вредящего фактора. Наибольшее количество макрофагов, участвующих в утилизации разрушающихся эритроцитов, выявлена в печени, селезенке, легких, костном мозге. Признаков экстрамедуллярного кроветворения не обнаружено.
Гемолиз эритроцитов наблюдают при действии на животных физических факторов, таких, как высокая температура, вызывающая ожоговую болезнь, низкая температура (обморожения), повреждения ионизирующей радиацией.
Наследственные аномалии, сопровождающиеся гемолитической анемией, изучены недостаточно. Они описаны при паралитической гемоглобинемии у лошадей, послеродовой и хронической гемоглобинуриях у крупного рогатого скота.
Дизэритропоэтическая анемия возникает как результат преимущественного подавления эритропоэза в красном костном мозге. Апластические или гипопластические дизэритропоэтические анемии могут быть результатом прямого повреждающего действия вредоносного фактора на клетки красного костного мозга и результатом дефицита в организме компонентов (микроэлементы, витамины), необходимых для нормального эритропоэза.
Прямое повреждение стволовым клеткам красного мозга наносит ионизирующая радиация. В зависимости от дозы облучения: наступает либо гипоплазия, либо аплазия кроветворной ткани, сопровождающаяся анемией. Поражение стволовых клеток и клеток—предшественников миелопоэза может быть результатом действия химических (цитостатики, антибиотики, аминазин и др.) и биологических (вирусы) факторов. Наиболее часто у животных наблюдают анемии, возникающие из-за недостатка в рационе микроэлементов, витаминов или нарушения обменных процессов. В первую очередь к ним относят железодефицитные анемии и анемии, развивающиеся вследствие дефицита кобаламина и фолиевой кислоты.
Железодефицитная анемия. Объединяющий признак этой группы анемий — недостаток железа в организме. Дефицит железа вызывают многие факторы. Среди них затруднение всасывания железа в желудочно-кишечном тракте при гастритах, энтеритах, ахилии, язвенной болезни. Некоторые компоненты рациона способствуют образованию нерастворимых соединений железа. Скармливание сырой рыбы определенного вида (минтай, пикша, путассу, сайра) пушным зверям сопровождается попаданием в организм триметиламиноксида, при участии которого образуются нерастворимые соединения железа, не усваиваемые животными. Варка рыбы предупреждает развитие анемии, особенно часто регистрируемой в подобных случаях у норок.
Одной из причин развития дефицитной по железу анемии является его повышенное расходование при хронических кровопотерях, вызванных заболеваниями (язвенная болезнь желудка пушных зверей, свиней; хроническая гематурия крупного рогатого скота), повышенной лактацией, интенсивной мышечной работой.
Основной же причиной железодефицитной анемии у домашних животных является алиментарная недостаточность. Неполноценное кормление взрослых животных, дефицит железа в молозиве и молоке снижают его содержание в клетках красного костного мозга, эритроцитах, плазме крови. Анемию у новорожденных телят, ягнят, жеребят, поросят, щенков пушных зверей наблюдают тогда, когда в организме лактирующих матерей недостаточен уровень железа.
Содержание гемоглобина у больных телят может колебаться от 80 до 40 г/л, тогда как у здоровых оно в пределах 100—115 г/л. Безвыгульное содержание свиноматок лишает их возможности пополнять запасы железа путем поедания глины, других богатых микроэлементами веществ. В подобных условиях поросята-сосуны могут получать с молоком лишь около 1 мг железа в сутки при потребности 7—10 мг, количество гемоглобина у них снижается до 25%, а падение гемоглобина до 2—4 % ведет к летальному исходу.
Не регистрируют железодефицитную анемию там, где свиньям предоставлен выгульно-пастбищный режим.
Недостаточное поступление железа в организм новорожденных ягнят с молоком матерей на фоне интенсивного роста определяет развитие выраженной анемии уже к 2—3-недельному возрасту, когда происходит удвоение массы тела. Изначальный скрытый дефицит железа сменяется анемией микроцитарного, гипохромного характера со снижением числа эритроцитов, гемоглобина в единице объема крови, уменьшением гематокритной величины, увеличением СОЭ, появлением анизоцитов, пойкилоцитов, базофильной зернистости и полихроматофильных эритроцитов.
Весьма чувствительны к недостатку железа щенки пушных зверей клеточного содержания. В крови анемичных норок содержание железа может упасть до 50 мг/100 мл. Гибель щенков от железодефицитной анемии может достигать 20—30 % и более.
Железодефицитная анемия зарегистрирована и у птиц. Установлено, что у кур (300—360-дневный возраст) в период максимальной яйценоскости развивается синдром умеренной гипохромной анемии. С изначальных величин 108 ±1,1 г/л количество гемоглобина падает до 77—79 г/л. Суточные цыплята, полученные из яиц больного анемией родительского стада, также имеют явные признаки малокровия (гемоглобина 70 ± 0,6 г/л). Внешне это проявляется белопухостью, бледно-гребешковостью, низкими массой и сохранностью.
С целью предупреждения и лечения анемических состояний больным животным назначают легкоусвояемые комбинированные препараты железа, кобальта, цинка и марганца, вводимые в рацион или путем парентеральных инъекций.
Витамин В12 (фолиево)-дефицитные анемии развиваются как следствие недостатка в организме антианемического фактора, обеспечивающего нормальный эритропоэз. Антианемический фактор состоит из двух компонентов — внешнего и внутреннего. Внешний (фактор Касла) представляет собой витамин В12 (цианкобаламин). Дефицитная по этому витамину анемия развивается в результате его недостаточного поступления в организм с кормом, нарушенного усвоения или усиленного расходования. Поступая в достаточном количестве, витамин В12 образует комплекс с внутренним антианемическим фактором, синтезируемым париетальными клетками желудка. Это гликопротеин с молекулярной массой 50 000—60 000 Да. Комплексное соединение через слизистую оболочку подвздошной кишки поступает в кровь и депонируется преимущественно в печени. Из печени витамин В]2 поступает в красный костный мозг, в котором он используется для синтеза нуклеиновых кислот эритрокариоцитов.
Одна из коферментных форм витамина В12 — метилкобаламин участвует в образовании тетрагидрофолиевой кислоты, необходимой для синтеза тримединфосфата. Он включается в дезоксирибонуклеиновую кислоту (ДНК) предшественников эритроцитов - эритрокариоцитов. Любая из причин недостаточности тримединфосфата ведет к нарушению процессов эритропоэза. В кровь выбрасываются мегалобласты и мегалоциты как результат патологического, мегалобластического кроветворения. Значительная часть клеток (до 50 %) разрушается в красном костном мозге. У этих клеток укорочена продолжительность жизни, поэтому, несмотря на избыточное насыщение каждого эритроцита гемоглобином, их общее число снижено, развивается мегалобластическая гиперхромная анемия. Цветовой показатель становится больше 1 (1,4-1,8).
В мазках крови наряду с признаками патологической регенерации (мегалоцитоз, мегалобластоз) обнаруживаются дегенеративно измененные эритроциты. Выявляется гиперхромия, пойкилоцитоз, макроцитоз, базофильная пунктация, появляются включения типа колец Кебота, телец Жолли. Снижено число ретикулоцитов, свидетельствующее о подавлении эритробластического кроветворения. Наблюдаются тромбоцитопения и лейкопения.
Дефицит витаминов В12, В6 в организме и развивающаяся анемия у домашних животных часто возникают от алиментарной недостаточности. Особенно чувствительны к гиповитаминозу животные с однокамерным желудком. У жвачных микрофлора преджелудков синтезирует водорастворимые витамины, в их числе В12 и В6. Образование цианкобаламина может быть заторможено отсутствием в рационе достаточного количества кобальта, подавлением активности микрофлоры, нерациональным кормлением, чрезмерным применением антибиотиков. Так, недостаток кобальта в рационе коров приводит к гиперхромной анемии, характеризующейся падением числа эритроцитов с 5,7 ±0,07 до 4,7 ±0,04 Т/л, повышением среднего содержания гемоглобина в одном эритроците с 20,0 ± 0,4 до 24,1 ± 0,6 пг, снижением уровня кобаламина в крови.
Усвоение витамина B12 становится затрудненным или невозможным из-за уменьшения либо полного прекращения выработки внутреннего антианемического фактора, что может быть обусловлено наследственным дефектом, аутоиммунной патологией, хроническими или острыми патологическими процессами в желудке (опухоли, воспаление, язвенные поражения). У телят с тяжелым течением гастроэнтероколита зарегистрированы уменьшение содержания гемоглобина в крови, возрастание цветового показателя и средней концентрации гемоглобина в одном эритроците, падение уровня железа со 170 до 98—108 мкг/100 мл крови.
Причиной анемии может быть и некомпенсированная повышенная потребность в цианкобаламине у беременных животных при смене эмбрионального типа кроветворения у плода на эритробластический.
Депонирование витамина В12 становится затрудненным при прогрессирующем, диффузном поражении печени (гепатит, гепатоз, цирроз). Развитию В12 -дефицитной анемии способствуют дисбактериоз и глистная инвазия, так как паразитирующие организмы вступают в конкурентные отношения с хозяином. Так, при неоаскаридозе у телят установлено снижение содержания гемоглобина и эритроцитов по сравнению с таковым у здоровых.
