
- •Министерство образования и науки Российской Федерации
- •ДВИГАТЕЛЬНЫЕ БЕЛКИ
- •белки актомиозиновой системы подвижности
- •Рис. 7. Схема, показывающая изменение положения головки миозина (S1) относительно тонкой нити в ходе структурных перестроек актомиозинового комплекса, которые приводят к возникновению силы, тянущей хвост миозина.
- •Рис. 8. Химические и механические события во время четырех стадий рабочего цикла поперечных мостиков.
- •БЕЛКИ МИКРОТРУБОЧЕК
- •Рис. 12. Схема перемещения молекулы кинезина вдоль микротрубочки, состоящей из мономеров тубулина α и β. Буквами Т и D обозначены головки кинезина, с которыми связаны соответственно АТФ (АТР) или АДФ (ADP).
- •ЛИТЕРАТУРА:
БЕЛКИ АКТОМИОЗИНОВОЙ СИСТЕМЫ ПОДВИЖНОСТИ
Главными белками этой системы подвижности являются миозин и актин. Молекулярный механизм сокращения мышц основан на взаимодействии миозиновых и актиновых филаментов.
Мышечные волокна построены из продольно расположенных миофибрилл диаметром около 1 мкм, в которых видны чередующиеся темные и светлые диски. Темные диски обладают двойным лучепреломлением и называются А-(анизотропными) дисками; светлые диски, не обладающие двойным лучепреломлением, называются I-(изотропными) дисками (рис. 1). В середине диска I расположена плотная линия Z, которая пронизывает все волокно, как бы удерживая миофибриллы в пучке и одновременно упорядочивая расположение А- и I-дисков многих миофибрилл. Пучок миофибрилл от одной до другой Z-линии называется саркомером. Диски А имеют в середине более светлую полосу – зону Н, пересекаемую более темной М-зоной. В одной миофибрилле может содержаться до 1000-1200 саркомеров. Каждый саркомер включает: 1) сеть поперечных трубочек, ориентированных под углом 90° к продольной оси волокна и соединяющихся с наружной поверхностью клетки; 2) саркоплазматический ретикулум, составляющий 8-10% объема клетки; 3) несколько митохондрий.
Миофибриллярные структуры представляют собой агрегаты, состоящие из толстых филаментов диаметром около 14 нм и из расположенных между ними тонких филаментов диаметром 7-8 нм. Филаменты располагаются таким образом, что тонкие входят своими концами в промежутки между толстыми. Диски I состоят только из
5
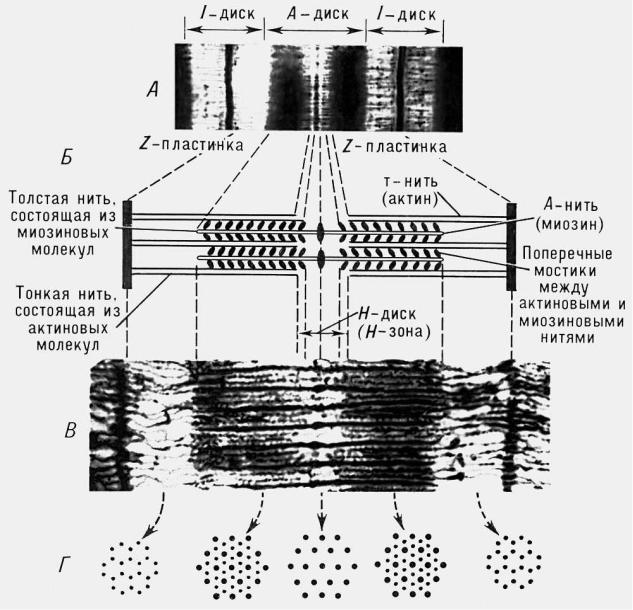
тонких филаментов, а диски А – из филаментов двух типов. Зона Н содержит только толстые филаменты, линия Z скрепляет тонкие филаменты между собой. Между толстыми и тонкими филаментами расположены поперечные мостики толщиной около 3 нм; расстояние между этими мостиками 40 нм.
Рис. 1. Строение саркомера поперечнополосатого мышечного волокна:
А – электронная микрофотография (малое увеличение), на которой четко видна структура саркомера; Б – схема саркомера; В – электронная микрофотография с высокой разрешающей способностью; Г – поперечное сечение саркомера на различных уровнях, видно положение толстых и тонких нитей
в различных участках покоящегося саркомера.
6
МИОЗИН
Толстые филаменты состоят из белка миозина. Молекула миозина (рис. 2) представляет собой гексамер, состоящий из двух идентичных тяжелых цепей (по 200 кДа) и четырех легких цепей (по 20 кДа), общая масса миозина около 500 кДа.
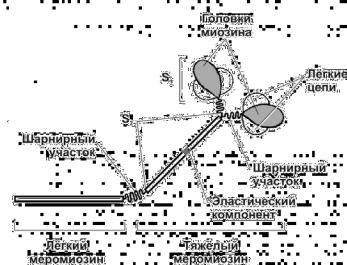
Тяжелые цепи на большем протяжении закручены в двойную спираль и образуют стержневую часть молекулы. На N-конце каждая тяжелая цепь образует глобулярную головку грушевидной формы. Стержневая часть миозина вследствие высокого содержания α- спиралей является прямой и жесткой; изгибаться она может только в двух участках – их часто называют «шарнирными». Один из них, расположенный в стержневой части миозина, дает ей возможность изгибаться в этой области, а другой участок обеспечивает высокую подвижность головок.
Рис. 2. Схема молекулы миозина.
Концевую часть хвостовой нити миозина длиной 100 нм образует легкий меромиозин, который обеспечивает агрегацию молекул миозина. Тяжелый меромиозин имеет связывающие актин участки и обладает
активностью АТФазы; имеет два субфрагмента (S). S1 содержит глобулярные головки миозина, S2 — эластический компонент, допускающий отхождение S1 на расстояние до 55 нм.
7

Молекулы миозина объединяются, образуя толстые филаменты, состоящие примерно из 400 палочковидных молекул, связанных друг с другом таким образом, что пары головок миозиновых молекул ложатся на расстоянии ~43 нм друг от друга; они располагаются по спирали. Миозиновые нити стыкуются «хвост к хвосту», а головки смотрят в разные стороны, в результате образуется «голая зона», не несущая головок (рис. 3). Остов толстого филамента образован стержневыми частями молекул миозина, а головки выступают наружу в виде «поперечных мостиков», регулярно расположенных на поверхности филамента и способных вступать во взаимодействие с актиновыми (тонкими) филаментами (рис. 4).
Рис. 3. Упаковка миозиновых молекул при образовании толстого филамента.
С глобулярными головками связаны главные свойства миозина: АТФазная активность и способность взаимодействовать с актином. Каждая головка миозина несет один активный центр миозиновой АТФазы. АТФазная активность (способность гидролизовать АТФ до АДФ) впервые была обнаружена у миозина В.А. Энгельгардтом и М.Н. Любимовой в 1939 году.
АТФазная активность миозина проявляется только в присутствии определенных катионов. In vitro АТФазная активность сильно активируется ионами Ca2+ (Ca2+-АТФазная активность) и
8
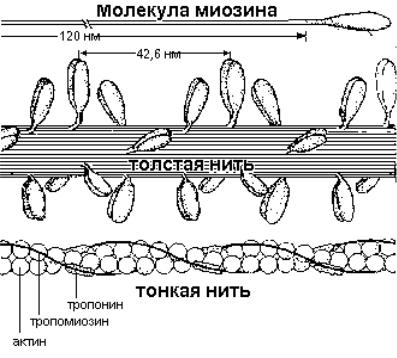
Рис. 4. Схематическое изображение строения толстой и тонкой нити.
очень слабо – ионами Mg2+. Однако Mg2+-АТФазная активность миозина резко возрастает при взаимодействии миозина с актином; это так называемая актинактивируемая Mg2+-АТФазная активность миозина. Только такая активность и имеет место в живой мышце, где в физиологических условиях концентрация Mg2+ высока. В процессе Mg2+-АТФазной реакции миозиновая головка подвергается глобальной конформационной перестройке, сопровождающейся полным изменением доменной структуры.
Таким образом, миозин выполняет три биологически важные функции:
•При физиологических значениях ионной силы и рН молекулы миозина спонтанно образуют волокно.
•Миозин способен катализировать гидролиз АТФ. Эта реакция является непосредственным источником свободной энергии, необходимой для мышечного сокращения.
•Миозин связывает полимеризованную форму актина – основного белкового компонента тонких миофибрилл. Именно это взаимодействие, как будет показано ниже, играет ключевую роль в мышечном сокращении.
АКТИН
Тонкие филаменты состоят из актина, тропомиозина и тропонина. Основным компонентом тонких филаментов является актин – водорастворимый глобулярный белок с молекулярной массой 42 кДа; эта форма актина обозначается как G-актин. В мышечном волокне актин находится в полимеризованной форме, которая обозначается как F-актин. Тонкие филаменты мышцы образованы двунитчатыми актиновыми структурами, связанными между собой нековалентными связями.
Тропомиозин представляет собой палочкообразную молекулу с молекулярной массой 70 кДа, состоящую из двух разных α- спиральных полипептидных цепей, закрученных относительно друг друга. Эта сравнительно жесткая молекула располагается в желобке спиральной цепочки F-актина; ее протяженность соответствует 7 G- актиновым мономерам.
Третий компонент тонких филаментов – тропонин (Тн), молекулярная масса которого около 76 кДа. Он представляет собой сферическую молекулу, состоящую из трех разных субъединиц, получивших название в соответствии с выполняемыми функциями: тропомиозинсвязывающей (Тн-Т), ингибирующей (Тн-I) и кальцийсвязывающей (Тн-С). Каждый компонент тонких филаментов соединяется с двумя другими нековалентными связями.
10
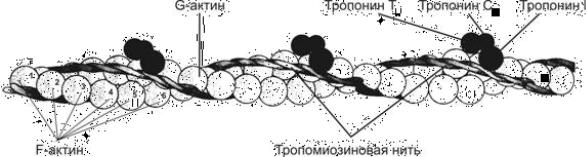
В мышце, где все рассмотренные компоненты собраны вместе в тонком филаменте (рис. 5), тропомиозин блокирует присоединение миозиновой головки к находящемуся рядом F-актиновому мономеру. Са2+, связываясь с Тн-С, значительно изменяет конформацию белка, увеличивая степень взаимодействия между субъединицами тропонина и одновременно ослабляя связь между Тн-I и F-актином. Это приводит к перемещению молекулы тропомиозина по желобку тонкого филамента. Результатом такого движения является открытие миозинсвязывающего центра на поверхности актина.
Актин–тропомиозин–тропонин–миозиновый комплекс характеризуется как Са2+, Мg2+-АТФаза.
Рис. 5. Взаиморасположение тропомиозина, тропонина и актина в тонком филаменте мышцы.
МЕХАНИЗМ СОКРАЩЕНИЯ МЫШЕЧНЫХ ВОЛОКОН
Модель скользящих нитей (предложенная в 1954 году Э.Хаксли) объясняет сокращение мышечных волокон (или укорочение саркомеров) продольным скольжением толстых миозиновых и тонких актиновых филаментов относительно друг друга, при этом сами филаменты не укорачиваются (рис. 6).
11
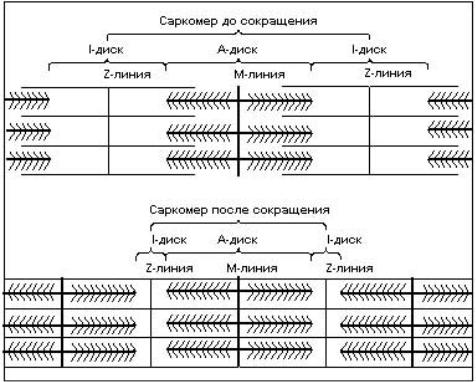
Рис. 6. Саркомер расслабленного (вверху) и сокращенного (внизу) мышечного волокна.
Сокращение мышечных волокон является результатом следующего цикла реакций:
1.В отсутствие АТФ, т. е. в исходном состоянии, головки молекул миозина прочно связаны с актиновыми нитями. При связывании АТФ головки отделяются от актиновых нитей.
2.АТФаза головок миозина гидролизует АТФ на АДФ и неорганический фосфат, но продолжает удерживать оба продукта реакции близко друг от друга. Гидролиз АТФ вызывает аллостерические изменения в миозиновой головке.
3.Теперь головка миозина образует новый мостик с соседней молекулой актина.
4.Актин ускоряет выброс продуктов АТФазной реакции из активного центра миозина. Это приводит к преобразованию аллостерического напряжения и изменению конформации головки
12
миозина, которое действует подобно «удару весла» (модель весельной лодки). Во время этого «гребка» миозиновые головки отклоняются на определенный угол от оси и перемещают миозиновый филамент вдоль актинового филамента по направлению к Z-диску. Цикл повторяется до тех пор, пока имеется АТФ.
Каждый «гребок» 500 миозиновых головок толстого филамента вызывает смещение на 10 нм. Во время сильных сокращений частота «гребков» составляет примерно 5 раз в секунду. При каждом цикле гидролиза АТФ головки миозина взаимодействуют с новыми молекулами актина, за счет чего и происходит взаимное скольжение миозиновых и актиновых филаментов, т. е. сокращение мышечного волокна.
Тянущая сила, вызывающая смещение миозина вдоль нитей актина, возникает за счет структурных изменений в каталитическом центре миозина после гидролиза молекулы АТФ. Миозин напоминает механическое устройство, в котором головка и шейка миозинового мостика играют роль своеобразного рычага, позволяющего увеличить амплитуду смещения миозинового хвоста. Этот рычаг одним из своих концов опирается на актиновую нить, другой конец рычага соединен с хвостом молекулы миозина (рис. 7). После гидролиза АТФ (АТР) и диссоциации неорганического фосфата (Рi) и AДФ (ADP) из каталитического центра в головке миозина происходят структурные перестройки, в результате которых зацепленная за нить актина головка миозина поворачивается на угол 30°–40°, увлекая за собой хвост миозина. Так возникает сила, вызывающая скольжение толстых нитей миозина вдоль нитей актина.
13
