
- •Министерство образования и науки Российской Федерации
- •ДВИГАТЕЛЬНЫЕ БЕЛКИ
- •белки актомиозиновой системы подвижности
- •Рис. 7. Схема, показывающая изменение положения головки миозина (S1) относительно тонкой нити в ходе структурных перестроек актомиозинового комплекса, которые приводят к возникновению силы, тянущей хвост миозина.
- •Рис. 8. Химические и механические события во время четырех стадий рабочего цикла поперечных мостиков.
- •БЕЛКИ МИКРОТРУБОЧЕК
- •Рис. 12. Схема перемещения молекулы кинезина вдоль микротрубочки, состоящей из мономеров тубулина α и β. Буквами Т и D обозначены головки кинезина, с которыми связаны соответственно АТФ (АТР) или АДФ (ADP).
- •ЛИТЕРАТУРА:
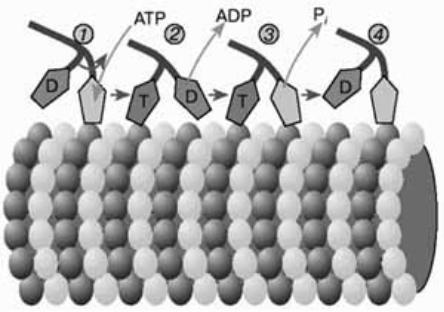
Каждая из двух головок кинезина обладает АТФазной активностью. Связывание и гидролиз молекулы АТФ в активном центре кинезина, а также последующие события, вызванные отсоединением AДФ и неорганического фосфата от активного центра, сопровождаются изменением положений головок относительно тубулиновых мономеров, в результате чего кинезин перемещается вдоль микротрубочки.
Работа головок кинезина хорошо скоординирована: связывание и гидролиз молекулы АТФ одной головкой димерного комплекса способствует освобождению молекулы AДФ из активного центра другой головки. Головки кинезина попеременно связываются с мономерными звеньями микротрубочки. На рис. 12 показана одна из наиболее вероятных схем работы кинезина, которая объясняет, каким образом происходит перемещение кинезина вдоль микротрубочек.
Рис. 12. Схема перемещения молекулы кинезина вдоль микротрубочки, состоящей из мономеров тубулина α и β. Буквами Т и D обозначены головки кинезина, с которыми связаны соответственно АТФ (АТР) или АДФ (ADP).
24
В исходном положении (состояние 1) головка кинезина, не связанная с микротрубочкой, содержит молекулу АДФ. Другая головка, которая в это время контактирует с микротрубочкой, свободна от нуклеотидов. После связывания АТР второй головкой изменяется конформация молекулы кинезина, в результате чего первая головка, содержащая АДФ, смещается вправо (переход 1→2). После отсоединения АДФ свободная головка связывается с микротрубочкой (переход 2→3). Затем происходят гидролиз АТФ и отсоединение фосфата (Рi), в результате чего головка, с которой связана молекула АДФ, отходит от микротрубочки (переход 3→4). В конечном положении (состояние 4) углы наклона головок кинезина относительно микротрубочки такие же, как в исходном состоянии 1, но при этом молекула кинезина оказывается смещенной вдоль микротрубочки на расстояние, соответствующее двум мономерным звеньям тубулина α и тубулина β.
До сих пор не совсем понятно, каким образом молекула кинезина «шагает». Весьма вероятно, что на определенной стадии происходит поворот рычагов относительно хвоста кинезинового димера (см. рис. 12). В этом случае движение кинезинового димера вдоль микротрубочки можно было бы сравнить с движением вальсирующего человека, который перемещается в танцевальном зале, периодически совершая повороты на 180° вокруг ноги, опирающейся на пол. После каждого такого поворота танцор переступает на другую ногу, совершая тем самым поступательное движение в пространстве. Один «шаг» димерного комплекса кинезина приводит к его смещению вдоль микротрубочки на
25
расстояние S = 8 нм. Длина «шага» S в точности соответствует размеру двух мономерных глобул (α- и β-тубулина), из которых построена микротрубочка.
Молекула кинезина обычно совершает не менее 100 «шагов», прежде чем отделиться от микротрубочки. Кинезин движется с поразительно высокой скоростью. За одну секунду он делает приблизительно 100 «шагов», перемещаясь за это время на расстояние 800 нм. Работая в качестве индивидуального молекулярного извозчика, кинезин может совершать перемещения на очень большие расстояния (до 1 мм).
Существует целое семейство кинезинов, обладающих сходными моторными головками, но отличающихся хвостовыми доменами. Так, цитозольные кинезины участвуют в транспорте по микротрубочкам везикул, лизосом и других мембраных органелл. Многие из кинезинов связываются специфически со своими грузами. Некоторые участвуют в переносе только митохондрий, другие – только синаптических пузырьков. Кинезины связываются с мембранами через мембранные белковые комплексы – кинектины. Кинезины веретена деления участвуют в образовании этой структуры и в расхождении хромосом.
В отличие от кинезина, другой молекулярный двигатель – динеин перемещает частицы от (+)-конца к (–)-концу микротрубочек, т. е. от периферии клетки к центросоме.
Динеин – высокомолекулярный белок, состоящий из различных комбинаций α-, β- и γ-тяжелых цепей с молекулярной массой более 400 кДа и набора промежуточных и легких цепей с молекулярной
26
массой от 10 до 80 кДа. Оказалось, что динеин, подобно кинезину, имеет на конце глобулярный домен, содержащий участки для связывания микротрубочек, и длинный α-спиральный участок, способный сворачиваться в суперспираль с α-участками других тяжелых цепей. В результате получается структура, напоминающая структуру кинезина – с глобулярными головками на одном конце и с стержнеобразным доменом на другом. Однако в случае динеина головки существенно большего размера, и молекула динеина при электронной микроскопии представляет собой не стержень, а Y- образную структуру с легкими цепями в основании стебелька (см. рис. 10). В зависимости от количества тяжелых цепей в молекуле динеина различают одно-, двух- и трехголовые динеины. Они отличаются по коэффициенту седиментации (14S и 22S для одно- и двухголового соответственно), АТФазной активности и транслокаторной способности.
Динеин является АТФазой, активность которой стимулируется микротрубочками. Участки связывания и гидролиза АТФ расположены на головках динеиновой молекулы. На каждой головке динеина имеется также по одному сайту связывания с микротрубочками.
Механизм генерации силы при взаимодействии динеина и микротрубочки, по-видимому, очень сходен с таковым при актомиозиновом взаимодействии и включает в себя циклические процессы ассоциации–диссоциации динеина с микротрубочками, сопряженные с процессами связывания, гидролиза АТФ и высвобождения продуктов (рис. 13).
27
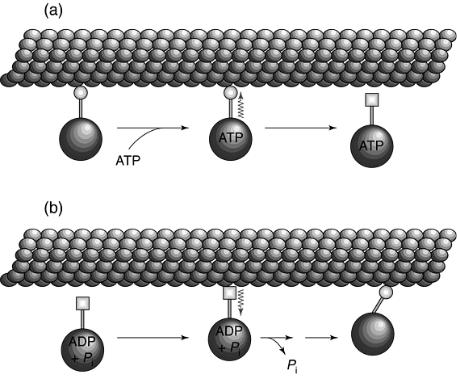
Рис. 13. Взаимодействие молекулы динеина с микротрубочкой на последовательных стадиях цикла образования поперечных мостиков
(некоторые стадии цикла опущены).
В настоящее время выделяют два класса динеинов – аксонемные динеины и цитоплазматические динеины.
Цитоплазматические динеины участвуют в транспорте органелл и митозе. Аксонемные динеины были первоначально обнаружены в аксонемах жгутиков и ресничек, где динеины образуют «ручки», ассоциированные с дублетом микротрубочек, и осуществляют скольжение соседних наружных дублетов микротрубочек, что приводит к биению жгутиков или ресничек.
Осевая структура (аксонема) ресничек и жгутиков состоит исключительно из микротрубочек и связанных с ними белков. В аксонеме микротрубочки организованы в пучок таким образом что девять двойных трубочек расположены по кругу, а в центре находятся находятся две одиночные микротрубочки (рис. 14).
28
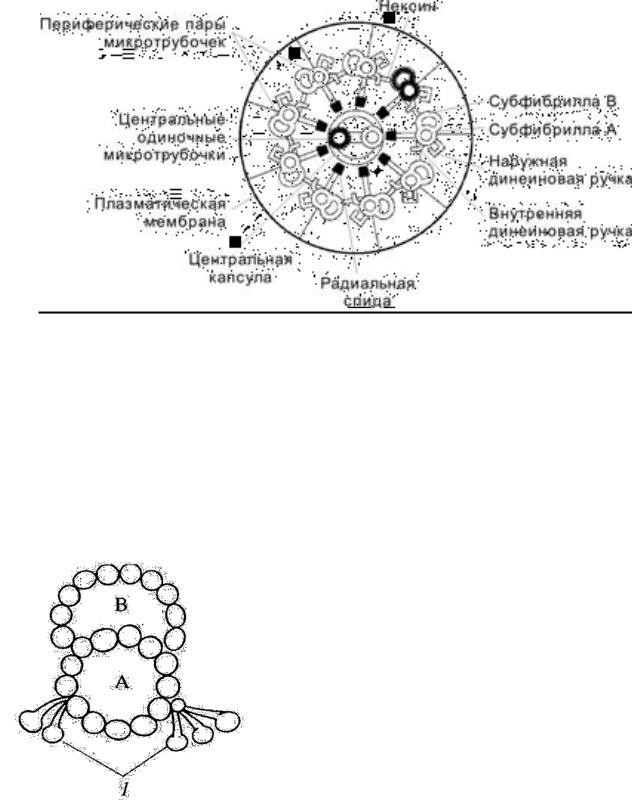
Рис. 14. Строение аксонемы ресничек.
Каждый периферический дублет микротрубочек образован субфибриллой A (полная микротрубочка) и субфибриллой B (неполная микротрубочка), состоящими из протофиламентов. На поперечном срезе видно, что полная микротрубочка каждого дублета
|
построена из 13 субъединиц, а |
||||
|
неполная – только из 10 (рис. 15). |
||||
|
Обладающий |
АТФазной |
активностью |
||
|
белок динеин – компонент тубулин- |
||||
|
динеинового хемомеханического |
пре- |
|||
|
образователя – входит в состав ручек, |
||||
|
связанных с субфибриллой A. |
|
|||
|
Система «9 + 2» характерна для |
||||
Рис. 15. Периферический |
ресничек и |
жгутиков |
почти |
всех |
|
дублет микротрубочек |
|||||
|
|
|
|
||
аксонемы ресничек. |
эукариотических организмов, начиная |
||||
|
|
|
|
|
|
29

от простейших и кончая клетками человека. Микротрубочки тянутся непрерывно по всей длине реснички, которая обычно составляет около 10 мкм, но в некоторых клетках достигает 200 мкм и более.
Динеин ресничек служит биохимическим двигателем, который вызывает скольжение и повороты микротрубочек. Головной домен динеина ресничек взаимодействует с соседними микротрубочками, а гидролиз АТФ создает создает механохимическую силу, которая вызывает движение динеина к (–)-концу микротрубочки. Это приводит к скольжению микротрубочек друг по другу; а так как дублеты микротрубочек сшиты вместе с помощью белка нексина, эта сила превращается в сгибательное усилие (рис. 16).
Рис. 16. Механизм движения реснички.
Для того, чтобы служить структурным каркасом или выполнять двигательные функции, микротрубочки должны быть связаны с другими компонентами клетки. Наиболее важным центром организации микротрубочек служит так называемый клеточный центр, который окружает пару центриолей.
30
