
- •3.Экспериментальная часть
- •3.1. Реактивы, использованные в работе
- •3.2. Приборы физико-химического анализа, использованные в работе
- •3.3. Синтез исходных веществ для проведения нитрования
- •3.3.1. Ацетамидин солянокислый
- •1 Стадия.
- •2 Стадия.
- •3.3.2. 6-Гидрокси-2-метилпиримидин-4(3н)-он
- •3.3.3. 2-Метил-2-метоксиимидазолидин-4,5-дион
- •3.4. Синтез продуктов, образующихся при нитровании 6-гидрокси-2-метилпиримидин-4(3н)-она
- •3.4.1. 6-Гидрокси-2-метил-5-нитропиримидин-4(3н)-он
- •3.4.2. 2-(Динитрометилен)-5,5-динитропиримидин-4,6-(1н,3н,5н)-дион
- •3.4.3. Получение калиевой соли динитрометана из ацетоуксусного эфира
- •3.5. Изучение кинетики нитрования 6-гидрокси-2-метилпиримидин-4(3н)-она и 6-гидрокси-2-метил-5-нитропиримидин-4(3н)-она в серно-азотных кислотных смесях
- •3.6. Изучение кинетики гидролиза 2-(динитрометилен)-5,5-динитропиримидин-4,6-(1н,3н,5н)-диона в различных средах
- •3.7. Изучение поведения 2-(динитрометилен)-5,5-динитропиримидин-4,6-(1н,3н,5н)-диона в серно-азотной кислотной смеси
- •3.8. Получение 1,1-диамино-2,2-динитроэтилена из 2-(динитрометилен)-5,5-динитропиримидин-4,6-(1н,3н,5н)-диона
- •3.9. Нитрование 6-гидрокси-2-метилпиримидин-4(3н)-она серно-азотными нитрующими смесями в различных условиях
3.4.3. Получение калиевой соли динитрометана из ацетоуксусного эфира

В трёхгорлую колбу с мешалкой, обратным холодильником, и термометром заливают 39 мл концентрированной серной кислоты (ρ=1,84 г/см3), охлаждают до 0°С и при этой температуре приливают 6,5 мл концентрированной азотной кислоты (ρ=1,51 г/см3). При температуре 0-10°С к нитрующей смеси дозируют раствор 4 мл ацетоуксусного эфира (0,0443 моль) в 80 мл дихлорэтана (ДХЭ). По окончании дозировки температуру поднимают до комнатной и выдерживают реакционную смесь 1 час.
Дихлорэтановый слой отделяют, минеральную фазу экстрагируют 40 мл ДХЭ, органические фазы объединяют.
К полученному дихлорэтановому раствору динитроуксусного эфира прибавляют 9,4 мл 40%-го раствора NaOH, нагревают реакционную массу при перемешивании до 70-80°С и выдерживают 20 минут, затем охлаждают до 0-3°С и при этой температуре прибавляют 13,4 мл концентрированной серной кислоты. Дихлорэтановый слой, содержащий динитрометан, отделяют и приливают к нему 10 мл 40%-го спиртового раствора КОН, доведя рН до 7-8 (не более). Образовавшийся осадок отфильтровывают, промывают изопропанолом и сушат. Масса калиевой соли динитрометана 3,8 г. Выход 67%.
3.5. Изучение кинетики нитрования 6-гидрокси-2-метилпиримидин-4(3н)-она и 6-гидрокси-2-метил-5-нитропиримидин-4(3н)-она в серно-азотных кислотных смесях
Исходные вещества:
6-гидрокси-2-метилпиримидин-4(3Н)-он
6-гидрокси-2-метил-5-нитропиримидин-4(3Н)-он
2-(динитрометилен)-5,5-динитропиримидин-4,6(1Н,3Н,5Н)-дион
динитрометан
азотная кислота 70%
азотная кислота 99%
серная кислота 80%
серная кислота 82,5%
серная кислота 85%
серная кислота 92%
Методика приготовления и анализа серной кислоты заданной концентрации
Для приготовления серной кислоты заданной концентрации смешивают расчетные количества 92%-ой H2SO4 и дистиллированной воды. Концентрация контролируется по плотности, которая определяется пикнометрическим методом по 2 раза для каждой кислоты. По усреднённому значению плотности, используя [29] определяется концентрация.
Оборудование:
термостат
термостатируемая ячейка
термометр, градуированный от -30°С до 70°С( шкала деления 0,5°С)
магнитная мешалка
пипетка объёмом 1 мл
пипетка объёмом 10 мл
мерные колбы объёмом 100 мл
аналитические весы WA 35 (точность 0,05 мг)
УФ-спектрофотометр Spekord M 40
спектрофотометрические кюветы
Опыты по нитрованию 6-гидрокси-2-метилпиримидин-4(3Н)-она и
6-гидрокси-2-метил-5-нитропиримидин-4(3Н)-она проводили в термостатируемой ячейке, снабжённой магнитной мешалкой, термометром и подключённой к термостату.
Условия проведения экспериментов представлены в таблице 3.1.
Таблица 3.1
Условия кинетических экспериментов по нитрованию
|
Нитруемое соединение |
Концентрация серной кислоты, % |
Объём серной кислоты, мл |
Концентрация азотной кислоты, % |
Объём азотной кислоты, мл |
|
6-гидрокси-2-метилпиримидин-4(3Н)-он |
92 |
25 |
99 |
1 |
|
6-гидрокси-2-метилпиримидин-4(3Н)-он* |
92 |
25 |
99 |
1 |
|
6-гидрокси-2-метилпиримидин-4(3Н)-он** |
92 |
12.5 |
99 |
12.5 |
|
6-гидрокси-2-метилпиримидин-4(3Н)-он |
92 |
22 |
99 |
4 |
|
6-гидрокси-2-метилпиримидин-4(3Н)-он* |
92 |
23 |
99 |
3 |
|
6-гидрокси-2-метилпиримидин-4(3Н)-он*,** |
92 |
23 |
70 |
3 |
|
6-гидрокси-2-метилпиримидин-4(3Н)-он*,** |
80 |
23 |
99 |
3 |
|
6-гидрокси-2-метилпиримидин-4(3Н)-он*,** |
85 |
23 |
99 |
3 |
|
6-гидрокси-2-метилпиримидин-4(3Н)-он*,** |
82.5 |
23 |
99 |
3 |
|
6-гидрокси-2-метил-5-нитропиримидин-4(3Н)-он |
92 |
25 |
99 |
1 |
|
6-гидрокси-2-метил-5-нитропиримидин-4(3Н)-он |
92 |
24 |
99 |
2 |
*Нитруемое соединение предварительно растворяется в ½ части серной кислоты, используемой в опыте
**Спектры снимали как непосредственно после отбора пробы из реакционной массы, так и после выдержки разбавленного раствора в течение длительного времени (от 1-х до 3-х суток)
Предварительно были сняты УФ-спектры 6-гидрокси-2-метилпиримидин-4(3Н)-она, 6-гидрокси-2-метил-5-нитропиримидин-4(3Н)-она (мононитропризводного, МНП), 2-(динитрометилен)-5,5-динитропиримидин-4,6-(1Н,3Н,5Н)-диона (тетранитропроизводного, ТНП), 1,1-диамино-2,2-динитроэтилена(ДАДНЭ) и динитрометана в растворе 1,8%-ой серной кислоты.
Опыты проводили при многократном избытке нитрующего агента.
Методика проведения кинетических опытов
В термостатируемую ячейку помещали нитрующую смесь (V=26 мл) и после 30 минут термостатирования при 25°С к ней присыпали заданную навеску (от 10 до 30 мг) нитруемого вещества (или приливали его раствор в ½ части серной кислоты, используемой в опыте). Включается секундомер, и через определённые промежутки времени из реакционной смеси пипеткой отбираются пробы (1 мл). Проба вносится в колбу объёмом 100 мл, после чего дистиллированной водой объём доводится до 100 мл. Получаются 1,6-1,8 % растворы кислоты в воде.
Далее снимаются спектры поглощения приготовленных таким способом растворов. В кювету сравнения заливается раствор, полученный разбавлением в 100 раз кислотной смеси рабочей концентрации. На рисунке 3.1 представлен типичный вид Уф-спектра при изучении кинетики нитрования.
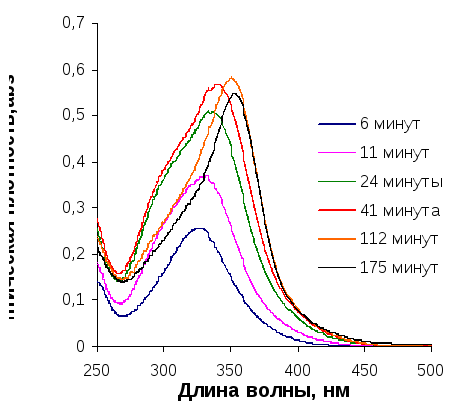

Рисунок 3.1
Зависимость УФ-спектров реакционной массы от времени при нитровании 6-гидрокси-2-метилпиримидин-4(3Н)-она в смеси 70 % HNO3 и 92 % H2SO4 до (слева) и после (справа) 24-х часовой выдержки
По полученным спектрам рассчитывается состав смеси, исходя из закона Ламберта-Бугера-Беера и принципа аддитивности оптических плотностей:
DλiΣ=Dλin1+Dλin2+Dλin3+Dλin4
DλnΣ =Ci*E λini,
где Ci-концентрация i-го компонента смеси, Dλi-оптическая плотность i-го компонента на определённой длине волны (λ),E-коэффициент экстинкции i-го компонента на определённой длине волны (λ).
