
ЗАНЯТИЕ №3
Методические указания для студентов
по теме «Кислотно-основные свойства биоорганических соединений: спиртов, тиолов, аминов, карбоновых кислот»
Цель занятия: Изучить закономерности проявления кислотности и основности как важнейших свойств, определяющих реакционную способность биологически активных соединений.
Значение изучения темы: Важным аспектом реакционной способности биологически активных органически соединений являются их кислотные и основные свойства, обуславливающие существование в ионном состоянии большинства органических биомолекул в условиях организма. Перенос протона происходит в ходе многих биохимических реакций. Образование водородных связей обеспечивает стабилизацию структуры ДНК, определяет вторичную структуру белка. Большую роль в биохимических процессах играет кислотный или основной катализ, осуществляемый с участием соответствующих ионогенных групп ферментов.
I. Теоретические вопросы
-
Кислоты и основания как сопряженные кислотно-основные пары согласно протеолитической теории Бренстеда.
-
Константы кислотности и основности как мера кислотно-основных свойств органических соединений.
-
Влияние размера атома, делокализации заряда, электроотрицательности атома, поляризуемости аниона на кислотно-основные свойства органических соединений.
-
Влияние природы заместителей на кислотно-основные свойства соединений.
-
Типы взаимодействий между кислотными и основными центрами биологически активных молекул.
-
Реакции, доказывающие наличие кислотных и основных свойств у органических соединений.
-
Амфолиты.
-
Понятие о водородной связи. Типы водородных связей. Роль водородной связи в формировании пространственной организации белков и нуклеиновых кислот.
II. Обучающие упражнения
Задание 1. На основе приведенных в таблице показателей кислотности, рассчитать константы и расположить указанные органические соединения в ряд по увеличению кислотности. Ответ обосновать с позиций электронного строения.
|
|
FCH2COOH (фторуксусная к-та) |
CH3COOH (уксусная к-та) |
CH3OH (метанол) |
H2O |
C2H5OH (этанол) |
|
Водный раствор, pKa |
2,59 |
4,76 |
15,49 |
15,74 |
15,90 |
Решение: Ка – константа кислотности. Для количественной характеристики кислотных свойств используется величина pKa = - lg Ka.
Чем меньше рКа, тем больше кислотность по Бренстеду.
Рассчитаем константы кислотности:
FCH2COOH (фторуксусная
кислота): ![]() ;
;
CH3COOH (уксусная
кислота): ![]() ;
;
CH3OH (метанол): ![]() ;
;
H2O: ![]() ;
;
C2H5OH (этанол):
![]() .
.
На основании данных таблицы и рассчитанных значений констант ряд по увеличению кислотности будет выглядеть так:
C2H5OH H2O CH3OH CH3COOH FCH2COOH;
С позиций электронного строения ряд можно обосновать таким образом: кислотные свойства представленных соединений обусловлена наличием ОН-групп, кислотность которых определяется влиянием непосредственно связанных с ними фрагментов молекулы: карбонильной крупы (фторуксусная и уксусная кислоты) и алкильного радикала (метанол и этанол). Для качественно оценки кислотности этих центров сравним стабильность соответствующих им анионов: карбоксилат-аниона – СОО– и алкоксид-аниона – RO–. В карбоксилат-анионе отрицательный заряд в результате р-сопряжения равномерно распределён между двумя атомами кислорода, что обуславливает высокую стабильность аниона:
![]()
В алкоксид-анионе R→O– сопряжение отсутствует, следовательно, его стабильность мала.
Более сильные кислотные свойства фторуксусной кислоты, по сравнению с уксусной, объясняются присутствием атома фтора, проявляющего –I-эффект. Длина углеводородного радикала, проявляющего +I-эффект, также сказывается на силе кислотных центров, в примере: метанол более сильная кислота, чем этанол.
Задание 2. Сравните основность следующих соединений: 2-аминоэтанол и этиламин, анилин. Для более сильного основания напишите реакцию образования соли.
Решение:
HO ← СH2 – СН2 → NH2 2-аминоэтанол CH3 – CH2 → NH2 этиламин
![]() анилин
анилин
Центрами, обуславливающими основными свойствами – основными центрами – в 2-аминоэтаноле являются атомы кислорода и азота, а в этиламине и анилине – атомы азота. Электроотрицательность атома азота ниже, чем у кислорода, поэтому основные свойства у этого центра выше. Влияние природы радикала: в анилине и 2-аминоэтаноле имеются электроноакцепторные заместители: бензольное кольцо и гидрокси-группа соответсвенно, которые снижают основные свойства соединений. Кроме того, в анилине пара электронов атома азота вступает в р-сопряжение с р-электронами бензольного кольца, что дополнительно снижает основность этого соединения. Таким образом, ряд пол уменьшению основных свойств представленных выше соединений будет выглядеть следующим образом: этиламин 2-аминоэтанол анилин.
Реакция образования соли:
CH3 – CH2 → NH2 + HCl ↔ CH3 – CH2 → NH3+ Cl–.
Задание 3. Укажите центры основности в молекуле новокаина — сложного эфира n-аминобензойной кислоты и диэтиламиноэтанола, который применяется в хирургической практике для местной анестезии. Напишите реакцию образования соли новокаина с хлороводородной кислотой.
Решение:
В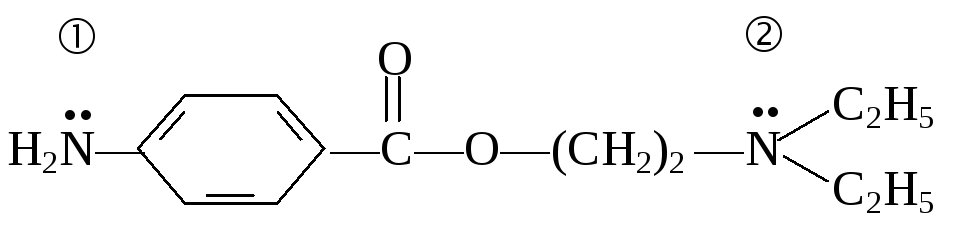 новокаине два наиболее выраженных
основных центра: 1) атом азота, связанный
с бензольным ядром, 2)атом азота, связанный
с алифатическими радикалами.
Электронодонорные заместители
повышают основные свойства, так как
увеличивают электронную плотность на
атоме основного центра, а электроноакцепторные
заместители понижают электронную
плотность и выраженность основных
свойств. Неподеленная пара электронов
атома азота (1) вступает в р,-сопряжение
с -системой
ароматического кольца, что приводит к
уменьшению основных свойств. Алкильные
радикалы, являясь электронодонорами,
увеличивают электронную плотность на
атоме азота (2) второго основного центра
и его основные свойства. Следовательно,
протон от кислоты присоединяется ко
второму центру.
новокаине два наиболее выраженных
основных центра: 1) атом азота, связанный
с бензольным ядром, 2)атом азота, связанный
с алифатическими радикалами.
Электронодонорные заместители
повышают основные свойства, так как
увеличивают электронную плотность на
атоме основного центра, а электроноакцепторные
заместители понижают электронную
плотность и выраженность основных
свойств. Неподеленная пара электронов
атома азота (1) вступает в р,-сопряжение
с -системой
ароматического кольца, что приводит к
уменьшению основных свойств. Алкильные
радикалы, являясь электронодонорами,
увеличивают электронную плотность на
атоме азота (2) второго основного центра
и его основные свойства. Следовательно,
протон от кислоты присоединяется ко
второму центру.

Задание 4. Сравнить кислотные свойства спиртов и тиолов. Объяснить различия с позиций электронного строения атомов, образующих кислотный центр. Привести схемы реакций, доказывающих кислотные свойства указанных соединений.
Решение: Качественной характеристикой кислотных свойств может служить стабильность образующегося аниона. Сила кислоты определяется стабильностью аниона, образующегося из этой кислоты: чем стабильнее анион, тем сильнее кислота. В пределах группы таблицы элементов Менделеева стабильность анионов возрастает с увеличением атомного номера элемента, так как увеличивается объем электронных орбиталей, и создается лучшая возможность для делокализации отрицательного заряда. Поэтому SH-кислоты (тиолы) являются более сильными кислотами, чем ОН-кислоты.
Тиолы, как более сильные кислоты, в отличие от спиртов, реагируют не только со щелочными металлами, но и со щелочами, а также оксидами и солями тяжелых металлов (ртуть, свинец, мышьяк, хром, висмут и др.):
![]()
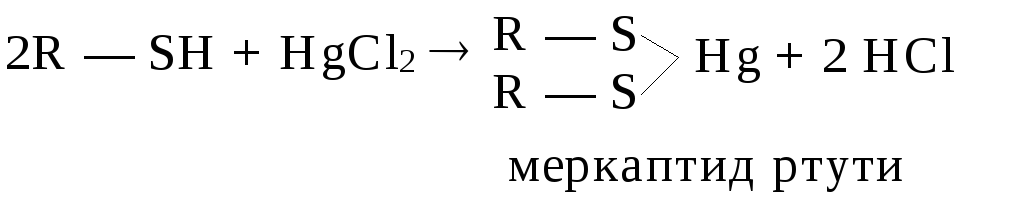
Задание 5. Возможно ли образование водородных связей в спиртах. Ответ пояснить. Влияет ли образование водородных связей на свойства соединений?
Решение: Водородная связь – это взаимодействие между двумя электроотрицательными атомами одной или разных молекул посредством атома водорода: А−Н ... В (чертой обозначена ковалентная связь, тремя точками – водородная связь). Связь обусловлена электростатическим притяжением атома водорода (несущим положительный заряд δ+) к атому электроотрицательного элемента, имеющего отрицательный заряд δ−.
В
спиртах в одной и той же молекуле
одновременно присутствуют слабые
кислотные (-ОН) и основные центры (![]() ),
что приводит к образованию межмолекулярных
водородных связей по схеме:
),
что приводит к образованию межмолекулярных
водородных связей по схеме:
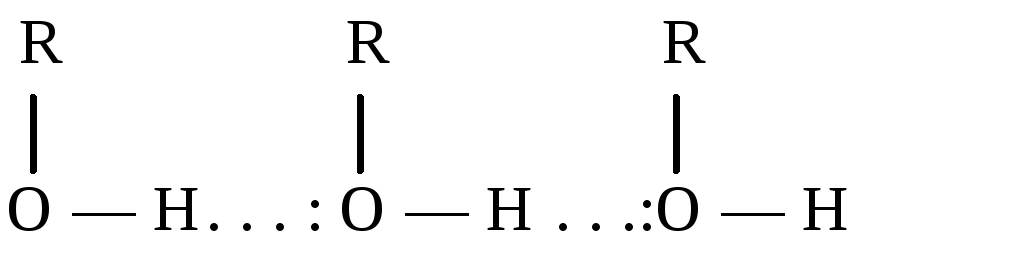
Энергия водородной связи небольшая, примерно 10-30 кДж моль, но обычно их образуется много и действует кооперативный эффект. Образование водородных связей в спиртах приводит к повышению температуры кипения по сравнению с углеводородами.
Задание 6. Проанализировать кислотные и основные свойства аминокислот на примере глицина. Ответ обосновать с помощью схем реакций, доказывающих амфотерные свойства аминокислот. Что такое изоэлектрическая точка?
Решение: Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной группы, т.е. являются амфотерными соединениями. Подобно аминам, они реагируют с кислотами с образованием солей аммония:
H2N–CH2–COOH + HCl → Cl – [H3N–CH2–COOH]+
Как карбоновые кислоты они образуют соли с основаниями:
H2N–CH2–COOH + NaOH → H2N–CH2–COO Na + H2O
а так же другие функциональные производные: сложные эфиры и амиды.
Кроме того, возможно взаимодействие амино- и карбоксильной групп как внутри одной молекулы (внутримолекулярная реакция), так и принадлежащих разным молекулам (межмолекулярная реакция).
NH2
– CH2COOH
![]() N+H3
– CH2COO–
N+H3
– CH2COO–
Благодаря амфотерности растворы аминокислот в воде обладают свойствами буферных растворов.
Изоэлектрической точкой (pI) аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом (биполярный ион, цвиттер-ион, бетаиновая структура).

При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
