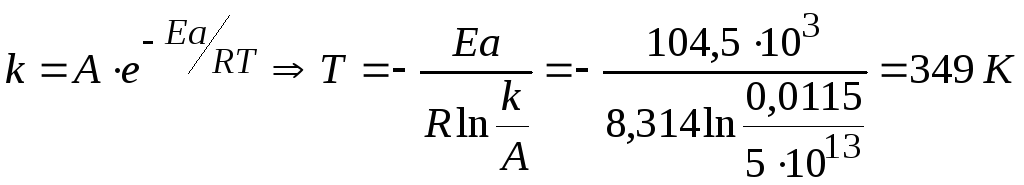- •Неравновесные явления
- •Тема 2: Реакции первого и второго порядка
- •Тема 3: Зависимость скорости реакции от температуры
- •Тема 4: Определение порядков химических реакции
- •Тема 5: Сложные химические реакции
- •Электрохимия
- •Тема 6: Электрическая проводимость и подвижность ионов
- •Тема 7: Теория электролитической диссоциации. Слабые и сильные электролиты
Тема 2: Реакции первого и второго порядка
Задача № 1
Рассчитайте k, если скорость реакции II порядка равна 4,5∙10-7 моль/см3∙с при концентрации одного компонента 1,5∙10-2 моль/л и другого 2,5∙10-3 моль/л.
Решение:
![]()
![]()
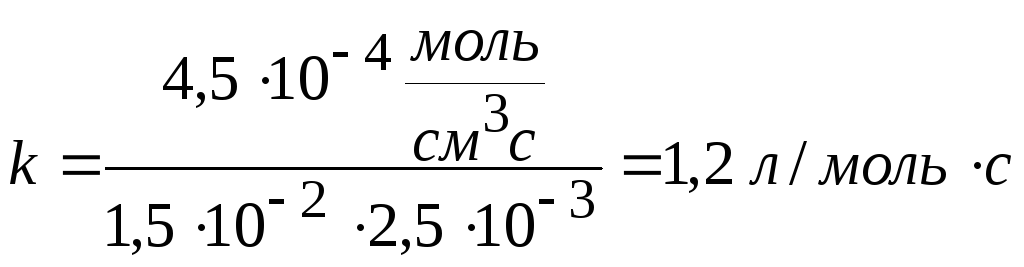
Ответ: k = 1,2 л/моль∙с
Задача № 2
Определите возраст мумии, если содержание изотопа углерода 14С в ее тканях составляет 80% от его содержания в живом организме, а период полураспада 14С равен 5600 лет. Реакция распада углерода относится к реакциям 1 порядка.
Дано:
сτ = 0,8с0
τ1/2 = 5600 лет.
____________________________
τ-?
Решение:
Допустим, что с0 = 1 моль/м3, тогда сτ = 0,8 моль/м3.
![]()
Рассчитываем возраст мумии:
![]()
Ответ: возраст мумии 1802 года.
Задача № 3
Реакция взаимодействия уксусного ангидрида с водой является реакцией первого порядка
(СН3СО)2О+Н2О=2СН3СООН
Дано:
с0=0,892 моль/л
τ=15,2 мин
сτ = 0,481 моль/л.
Найти: К, τ1/2, ω0, ω(τ1/2)
Решение:
Рассчитываем k:
![]()
![]()
Вывод: ко времени полупревращения скорость реакции уменьшается в два раза по сравнению с начальным моментом.
Задача № 4
Превращение перекиси водорода в диэтиловый эфир протекает как реакция I порядка. При 333 К за время 10 мин превращение прошло на 75%. Вычислите константу скорости реакции.
Решение:
Допустим, что с0 = 1 моль/л, тогда сτ = с0 – х = 100-75,2 = 24,8%
сτ = 0,248 моль/л.
![]()
Задача № 5
Фенилдиазохлорид разлагается по уравнению:
C6H5N2Cl=C6H5Cl+N2↑
При 323 К и начальной концентрации 10 г/л были получены следующие результаты:
-
τ, мин
6
9
12
14
22
26
30
∞
VN2, cм3
19,3
26
32,6
36
45
48
50,4
58,3
Рассчитайте константу скорости реакции, постойте график VN2 = f(τ) и сделайте вывод о порядке реакции.
Решение:
В данной химической реакции за ходом процесса удобно следить по объему выделившегося газа. Реакция мономолекулярная, скорее всего, протекает согласно реакции I порядка. Кинетическое уравнение для реакции I порядка выглядит так:
![]() или
или
![]()
Рассчитаем значение константы:
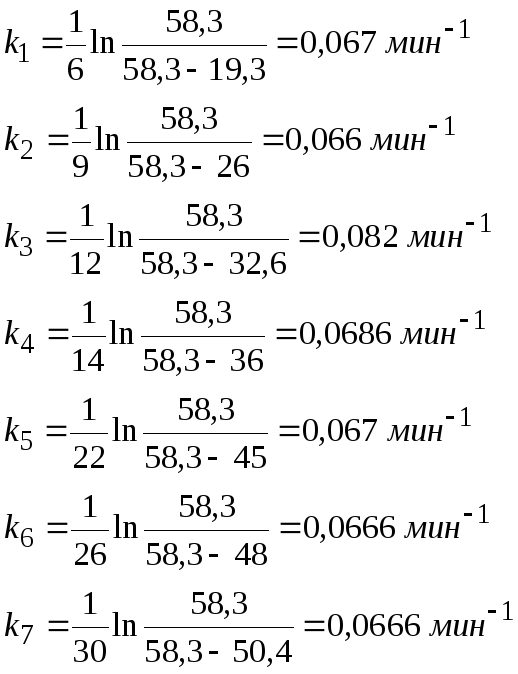
Значения констант скорости реакции имеет почти одинаковые значения, то это реакция I порядка и взятое нами уравнение удовлетворяет или описывает кинетику этого процесса.
Задача № 6
Найдите время, за которое реакция А→В с константой скорости 6,5∙10-5 с-1 пройдет а) наполовину; б) на 98%.
Решение:
по единице измерения константы можно сказать, что данная реакция относится к реакции I порядка.
Кинетическое интегральное уравнение можно записать:
![]()
При τ = τ1/2 сτ = 0,5с0, если с0 = 1 моль/м3, то сτ = 0,5 моль/м3.
![]()
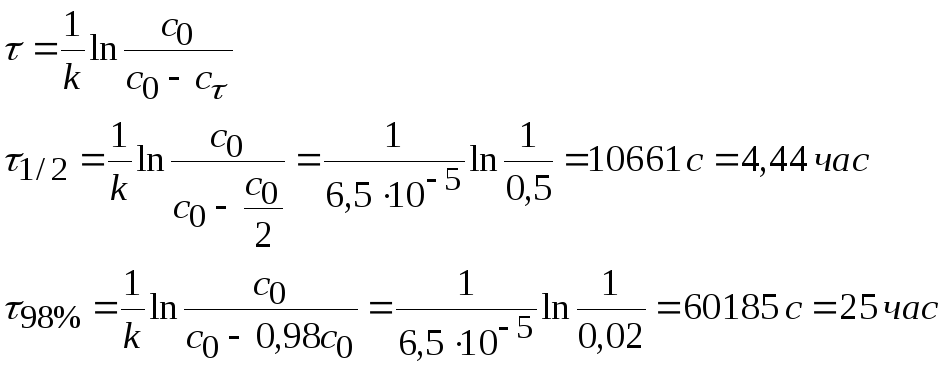
Тема 3: Зависимость скорости реакции от температуры
Задача № 1
Для реакции А+В = С+Д рассчитать изменение концентрации веществ А, В, С во времени, построить кинетические кривые, если к = 1,09∙10-4 м3/моль∙с, сА,0 = 30 моль/м3, сВ,0 = 20 моль/м3, τ = 5, 10, 20, 30 мин.
Решение:
По единице измерения константы − это реакция II порядка.
При сА,0≠сВ,0
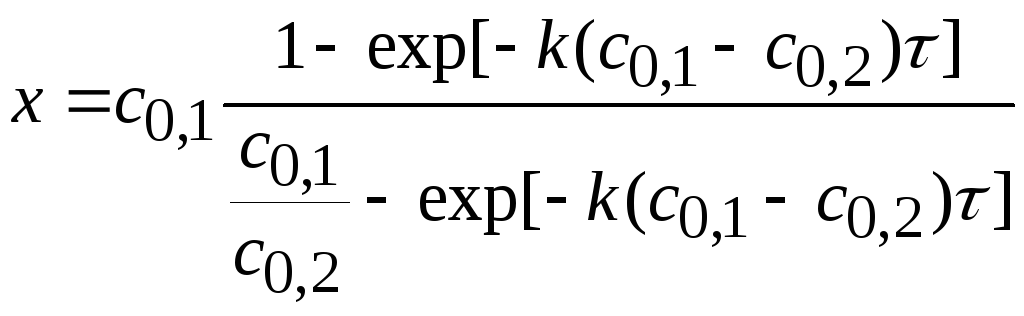
сА = сА,0 – х, сВ = сВ,0 – х, сс = х моль/м3
τ = 0 мин сА = 30 – 0, сВ = 20 – 0, сс = 0 моль/м3
τ = 5 мин = 300 с
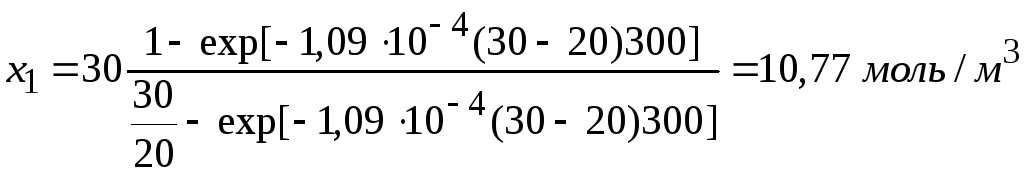
Тогда сА = 30 – 10,77 = 19,23 моль/м3, сВ = 20 – 10,77 = 9,23, сс = 10,77 моль/м3
τ = 10 мин х2 = 14,69 моль/м3
τ = 20 мин х3 = 17,80 моль/м3
τ = 30 мин х4 = 18,96 моль/м3
Сведем данные в таблицу:
|
τ, мин |
х = сс, моль/м3 |
сА, моль/м3 |
сВ, моль/м3 |
|
0 |
0 |
30 |
20 |
|
5 |
10,77 |
19,23 |
9,23 |
|
10 |
14,69 |
15,31 |
5,31 |
|
20 |
17,80 |
12,20 |
2,20 |
|
30 |
18,96 |
11,04 |
1,04 |
|
Обозначения на графике |
○ |
∆ |
□ |
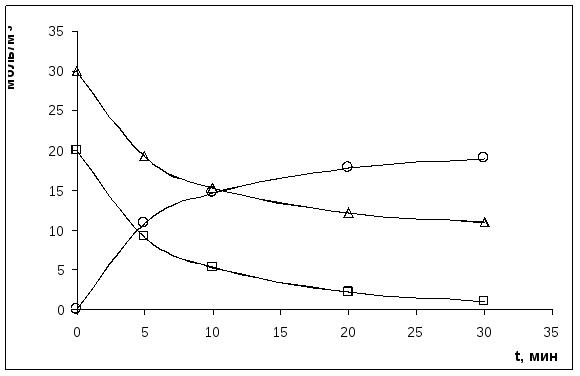
Задача № 2
Для гомогенной реакции
СО+Н2О=СО2+Н2
известны константы скорости реакции при двух температурах:
Т1 = 288.2 К к1 = 0,31·10-3 л/моль·мин
Т2 = 313.2 К к2 = 8,15·10-3 л/моль·мин
Порядок реакции совпадает с молекулярностью; с0,СО = с0,Н2О = 3,85 моль/л. Найдите для этой реакции количество вещества, израсходованное при 303,2 К за 35 мин.
Решение: Уравнение Аррениуса:
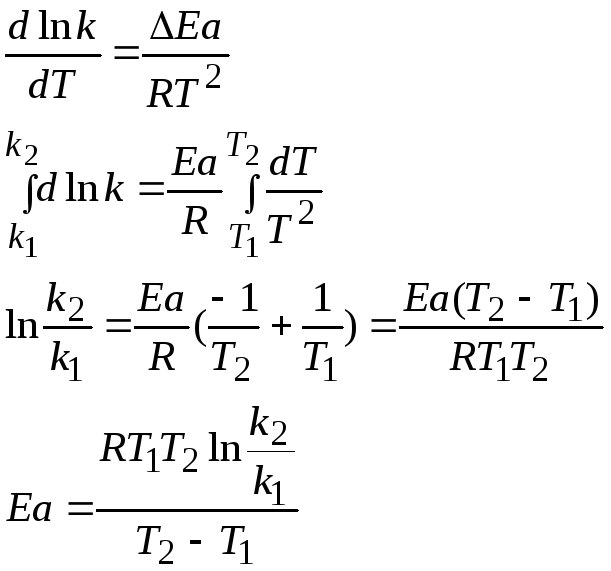
Найдем значение энергии активации:
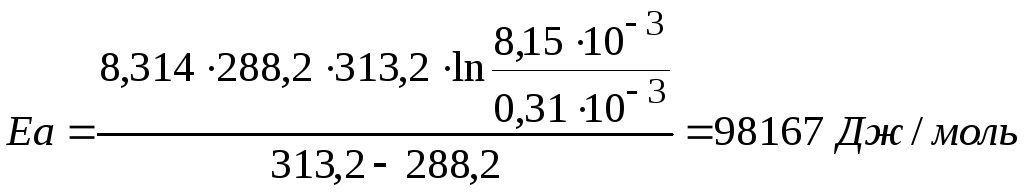
Зная величину Еа ,рассчитываем k3 при 303,2 К.

Найдем расход вещества для реакции II порядка:
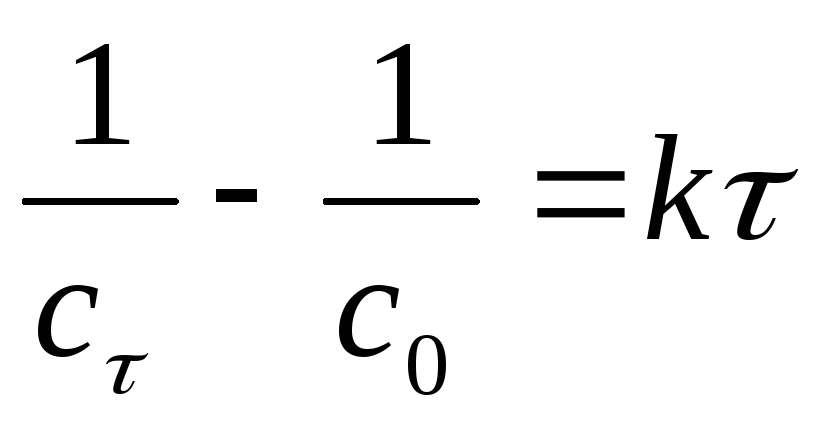 ,
после преобразования, получим значение
х:
,
после преобразования, получим значение
х:
![]()
Задача № 3
Константа скорости разложения органической кислоты зависит от температуры
-
k·102, с-1
5,45
10,54
12,78
22,20
Т, К
274,4
287
293
303
Рассчитайте графически параметры уравнения Аррениуса.
Решение
Уравнение Аррениуса
![]()
Для построения графика находим:
|
1000/Т, К-1 |
3,64 |
3,484 |
3,412 |
3,303 |
|
lnk |
-2,909 |
-2,249 |
-2,057 |
-1,505 |
|
lnk+3 |
0,091 |
0,751 |
0,943 |
1,495 |
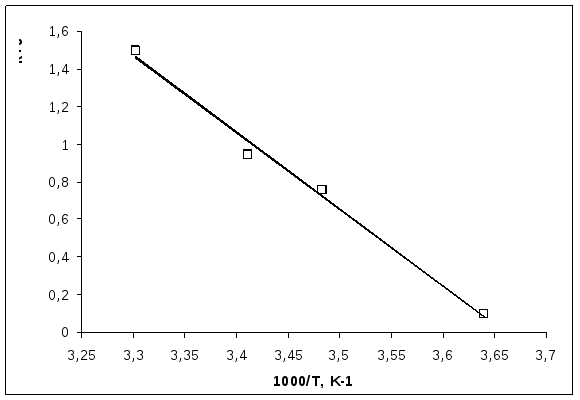
3) Из графика определяем:
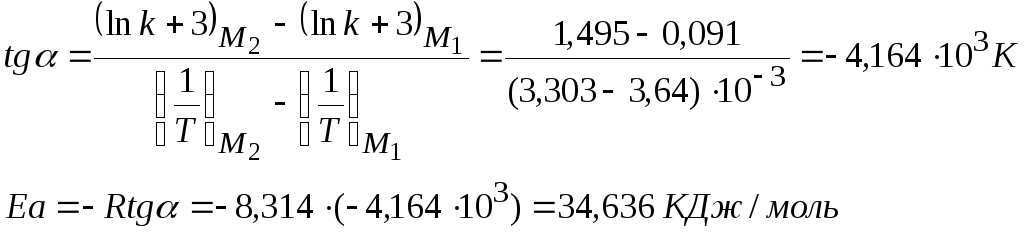
4) ![]()
Задача № 4
Энергия активации реакции I порядка равна 104,5 кДж/моль. В уравнении Аррениуса k=А·exp[-Ea/RT] значение А равно 5·1013 с-1. При какой температуре период полупревращения для этой реакции будет равен 1 мин?
Решение:
Для реакции I порядка
![]()
Рассчитываем Т: