
- •Неравновесные явления
- •Тема 2: Реакции первого и второго порядка
- •Тема 3: Зависимость скорости реакции от температуры
- •Тема 4: Определение порядков химических реакции
- •Тема 5: Сложные химические реакции
- •Электрохимия
- •Тема 6: Электрическая проводимость и подвижность ионов
- •Тема 7: Теория электролитической диссоциации. Слабые и сильные электролиты
Тема 5: Сложные химические реакции
Задача № 1
Реакция разложения изопропилового спирта в присутствии катализатора VO3 при 590 К протекает по схеме:
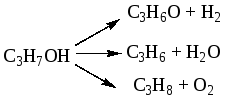
Все три реакции I порядка. Исходная концентрация изопропилового спирта составляет 45 моль/м3; значение констант к1 = 4,95·10-2 с-1, к2 = 5,42·10-2 с-1, к3 = 1,135·10-2 с-1.
определите концентрации С3Н6О, С3Н6 и С3Н8 ко времени 5 с.
Рассчитайте время, к которому концентрация С3Н7ОН уменьшится на 75%.
Решение
![]()
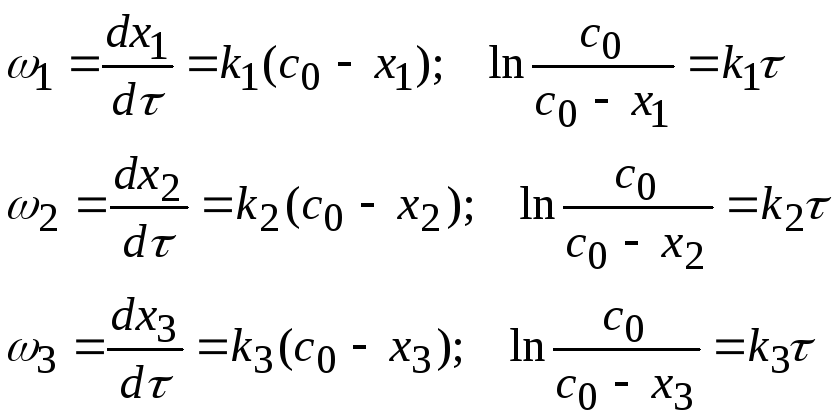
Найдем концентрации продуктов реакций к τ = 5 с по формуле:
![]()
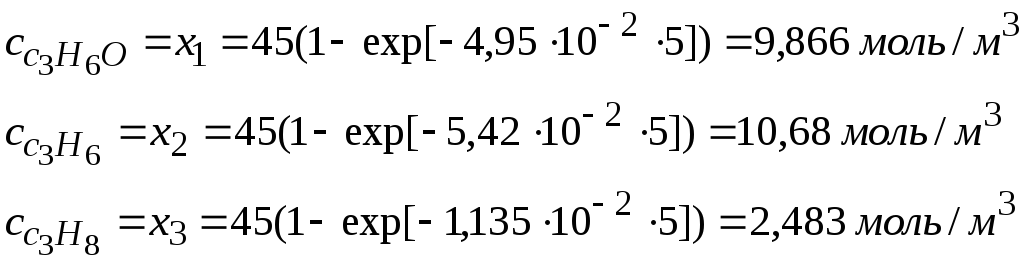
Рассчитаем время, к которому концентрация изопропилового спирта по сравнению с начальной уменьшится на 75%:
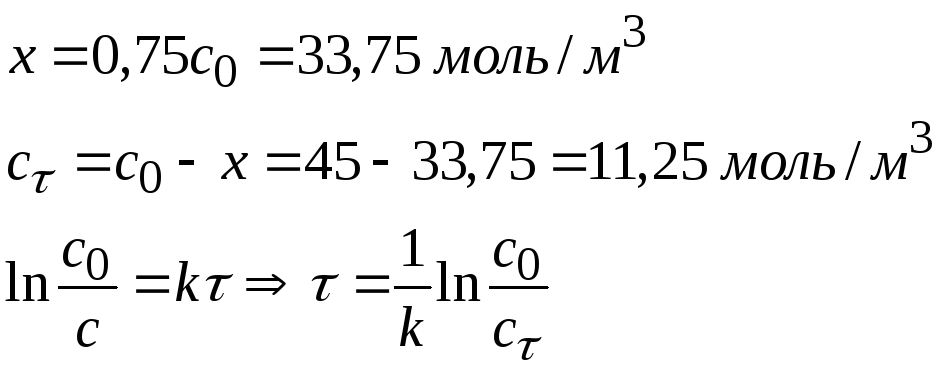
![]()
Задача № 2
Обратимые реакции
Превращение γ-оксимаслянной кислоты в γ-лактон, протекающее в водный среде является обратимой мономолекулярной реакций
![]()
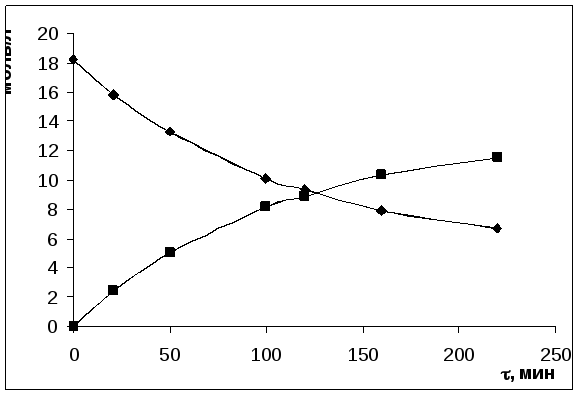
В результате проведенных опытов были получены следующие данные:
-
τ, мин
21
50
100
120
160
220
∞
х, моль/л лактона
2,41
4,96
8,11
8,90
10,35
11,55
13,28
Начальная концентрация оксимасляной кислоты равна 18,23 моль/л. Рассчитайте константу равновесия реакции, константу прямой и обратной реакции; постройте кинетические кривые скисл = f(τ) и слакт = f(τ)
Решение:
Схематически представим реакцию следующим образом
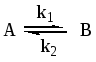
Кинетика обратимых реакций описывается следующим уравнением:
1)
![]()
2)
![]()
3)
![]()
Суммарная скорость обратимых реакций выражается системой уравнений:
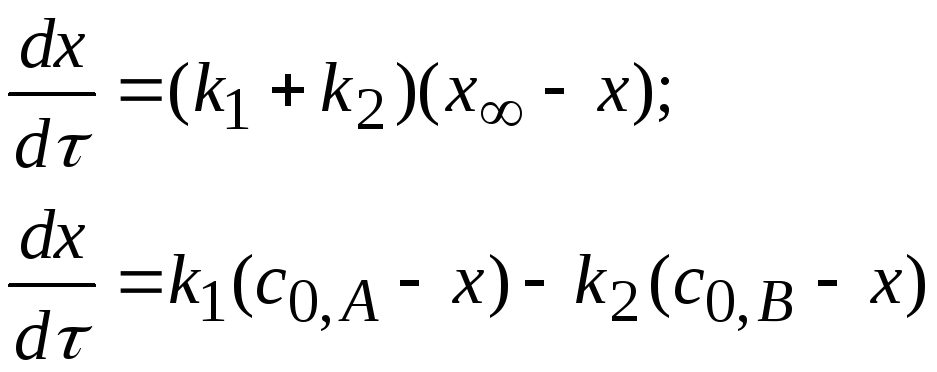
сВ = хτ; сА,τ = с0-хτ. Рассчитываем сА и сВ.
|
τ, мин |
0 |
21 |
50 |
100 |
120 |
160 |
220 |
∞ |
Обозначение на графике |
|
сА, моль/л |
18,23 |
15,82 |
13,27 |
10,12 |
9,33 |
7,88 |
6,68 |
4,95 |
♦ |
|
сВ, моль/л |
0 |
2,41 |
4,96 |
8,11 |
8,90 |
10,35 |
11,55 |
13,28 |
■ |
![]()
![]()
![]()
Рассчитываем значение (к1+к2):
![]()

Совместно решим два уравнения:
![]() и
и![]()
Решение дает:
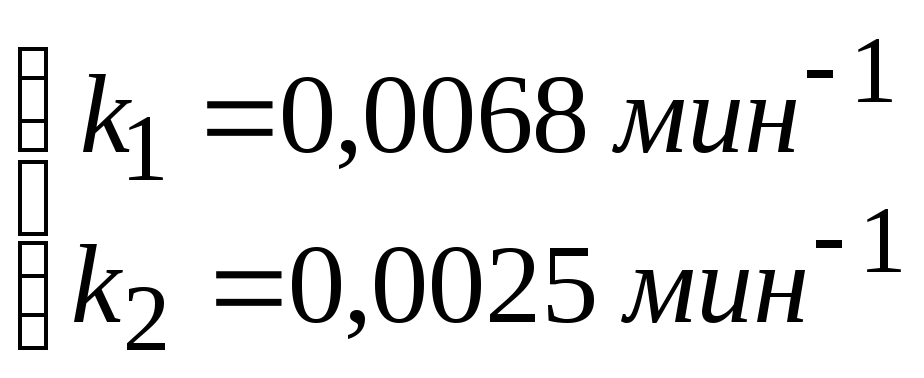
Задача № 3
Последовательная реакция первого порядка протекает при температуре 298 К по схеме:
![]()
Начальная концентрация вещества А равна 2 моль/л, значение к1 = 0,2 мин-1; к2 = 0,1 мин-1.
1) Постройте кинетические кривые:
сА = f(τ), cB = f(τ), сД = f(τ).
2) Вычислите координаты максимума кинетической кривой cB = f(τ) и сравните с данными из графика.
3) В какой момент времени концентрации исходного и промежуточного веществ будут равны?
Решение:
|
|
| ||
|
τ = 0 |
сА,0 |
0 |
0 |
|
τ≠0 |
cА,0 – х |
х – у |
у |
К любому времени τ
сА,0 = (сА,0 – х)+(х – у)+у
Кинетические уравнения прямой реакции:
![]()
Концентрация промежуточного соединения:
![]()
Концентрация конечного продукта:
![]()
Координаты максимума кинетической кривой сВ = f(τ)
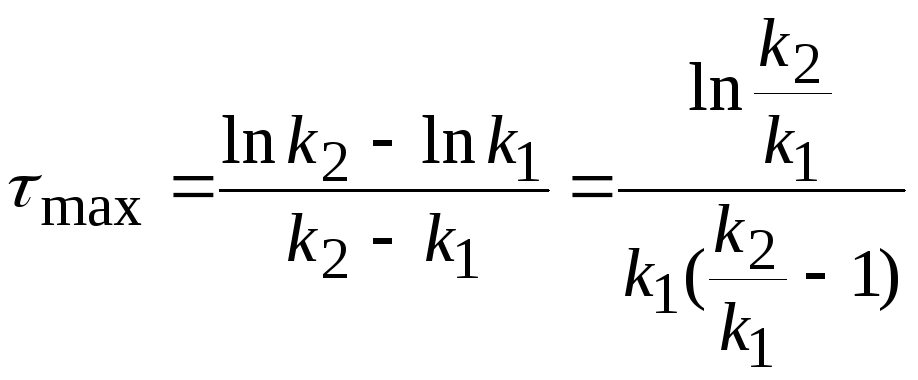
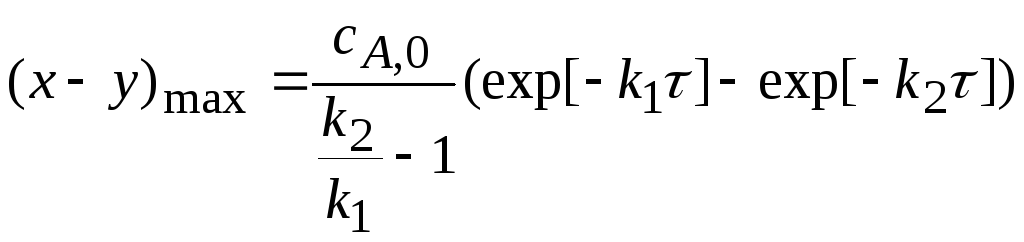
Если к2/к1
= 2, то
![]()
![]()
Рассчитаем концентрации всех реактантов ко времени τ, данные сведем в таблицу; построим кинетические кривые:
|
τ, мин |
х, моль/л |
сА = сА,0 – х, моль/л |
сВ = х – у, моль/л |
сД = у, моль/л |
|
0 |
0 |
2,0 |
0 |
0 |
|
5 |
1,264 |
0,735 |
0,957 |
0,307 |
|
7,5 |
1,554 |
0,446 |
0,997 |
0,58 |
|
10 |
1,729 |
0,271 |
0,931 |
0,798 |
|
20 |
1,963 |
0,036 |
0,468 |
1,495 |
|
30 |
1,995 |
0,005 |
0,189 |
1,806 |
|
40 |
1,999 |
0,0007 |
0,072 |
1,927 |
|
50 |
1,999 |
0,00009 |
0,026 |
1,973 |
|
60 |
1,999 |
0 |
0 |
1,990 |
|
Обозначение на графике |
♦ |
■ |
▲ | |
Определим max сВ = f(τ):
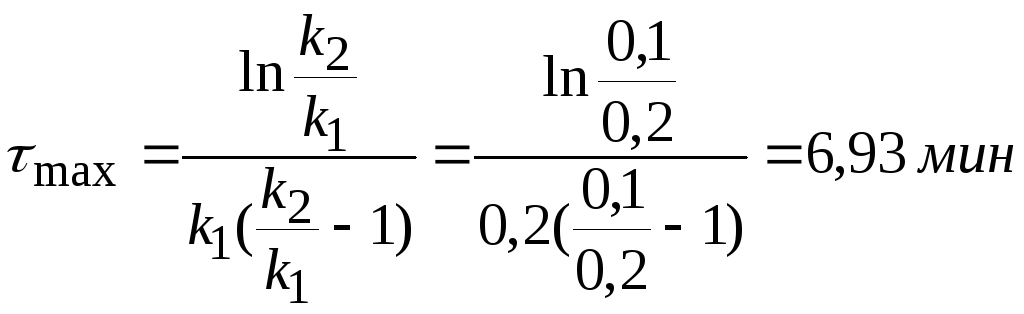
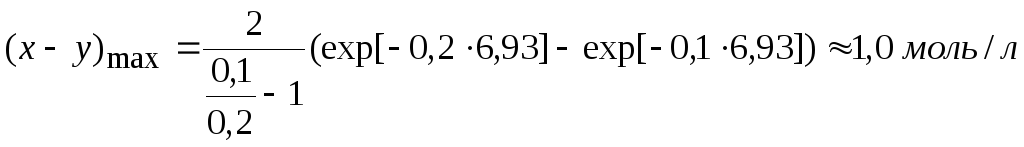
Равенство концентраций исходного и промежуточного веществ – точка пересечения кинетических кривых сА = f(τ), cB = f(τ). При τ = 4 мин, с ≈ 0,88 моль/л.
Кривая 1:
![]()
Кривая 2:
![]()
Кривая 3:
![]()
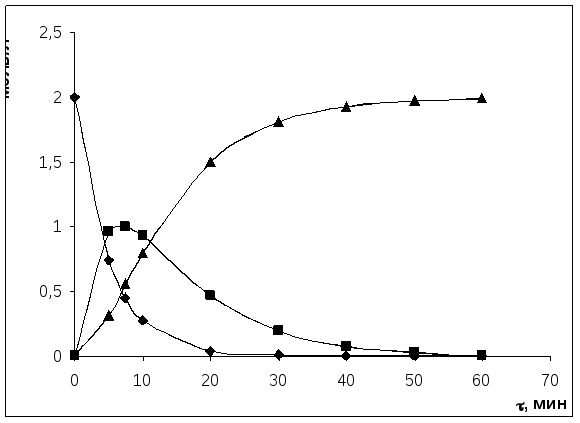
![]()
![]()
![]()
Из графика τmax = 7 мин, (x – y)max = 1 моль/л.
