
- •Неравновесные явления
- •Тема 2: Реакции первого и второго порядка
- •Тема 3: Зависимость скорости реакции от температуры
- •Тема 4: Определение порядков химических реакции
- •Тема 5: Сложные химические реакции
- •Электрохимия
- •Тема 6: Электрическая проводимость и подвижность ионов
- •Тема 7: Теория электролитической диссоциации. Слабые и сильные электролиты
Тема 4: Определение порядков химических реакции
Задача № 1
Для гомогенной реакции А+В=С дана зависимость сА = f(τ). Построить кинетическую кривую, рассчитать константу скорости реакции, определить интегральным методом порядок реакции, определить время получения 50% фосгена от максимально возможного при 27 0С.
СО+Сl2=COCl2
-
τ, мин
0
12
18
24
36
сСО = сCl2·102, моль/л
1,873
1,794
1,764
1,734
1,674
Решение:
Построим кинетическую кривую сСО = f(τ). По виду кинетической кривой можно определить, что это реакция II порядка.
Определение порядка реакции интегральным методом
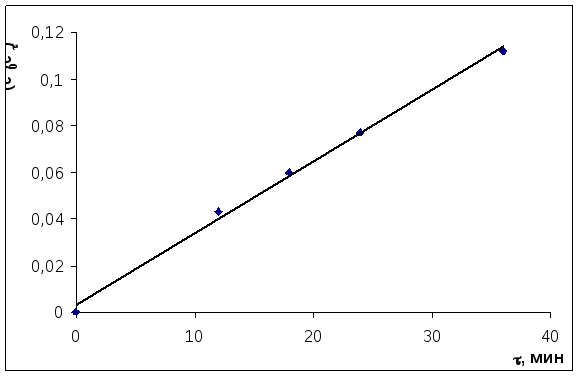
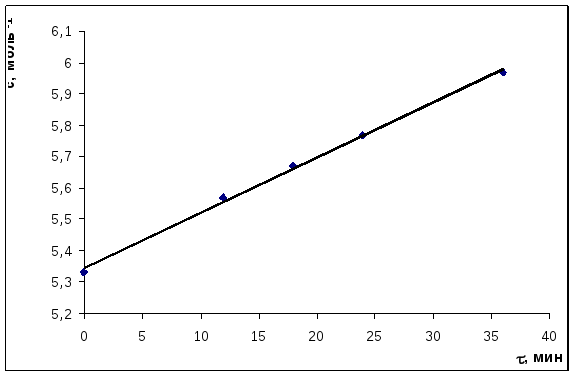
Если реакция I порядка – ln(c0/cτ) = f(τ), если II порядка, то должна быть прямая в координатах 1/сτ = f(τ)
|
τ, мин |
0 |
12 |
18 |
24 |
36 |
|
сСО·102, моль/л |
1,873 |
1,794 |
1,764 |
1,734 |
1,674 |
|
ln(c0/cτ) |
0 |
0,0431 |
0,0599 |
0,0771 |
0,112 |
|
10-3/c, моль-1 |
5,33 |
5,57 |
5,67 |
5,77 |
5,97 |
При анализе графических зависимостей ln(c0/cτ) = f(τ) и 1/сτ = f(τ) можно сделать вывод, что это реакция II порядка – все точки лежат на одной прямой.
сСО = сCl2, интегральное кинетическое уравнение реакции II порядка:
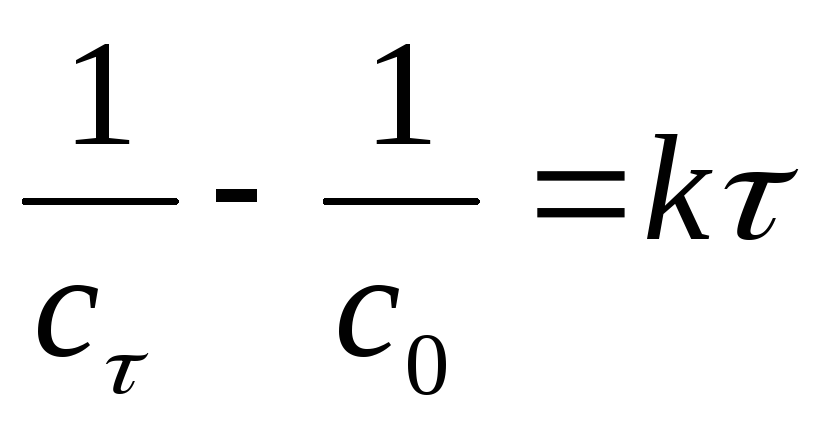 =>
=>
![]()

![]()
![]()
![]()
![]()
Рассчитаем τ1/2 для реакции II порядка:
![]()
Задача № 2
Для гомогенной реакции A1+A2+А3 = В дана зависимость А1 от времени, причем с0,А2 и с0,А3 значительно больше с0,А1. Постройте кинетическую кривую сА1 = f(τ), определите по ней дифференциальным методом частный порядок реакции по веществу А1 и эффективную константу скорости реакции (по методу изолирования Оствальда).
Решение:
A1+A2+А3 = В;
с0,А2 >> с0,А1 и с0,А3 >> с0,А1, тогда скорость реакции главным образом будет зависеть от сА1
![]()
1)
|
τ, мин |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
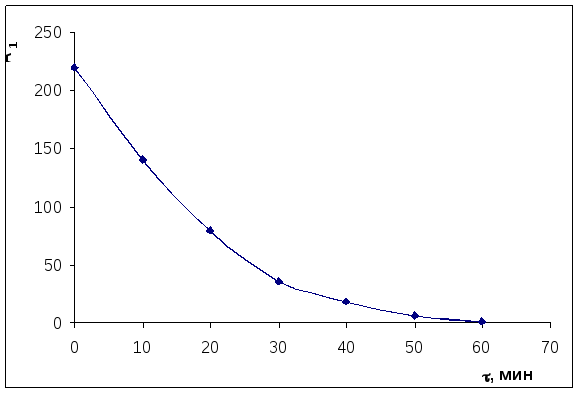
сА1, моль/м3 |
220 |
140 |
79 |
36 |
18 |
6 |
1 |
По данным построим кинетическую кривую сА,1 = f(τ).
2)
![]()
![]()
Логарифмируя, получим:
![]()
Строим график в координатах ln(ω) = f(lncA1).
Но для начала проведем соответствующие расчеты и сведем их в таблицу:
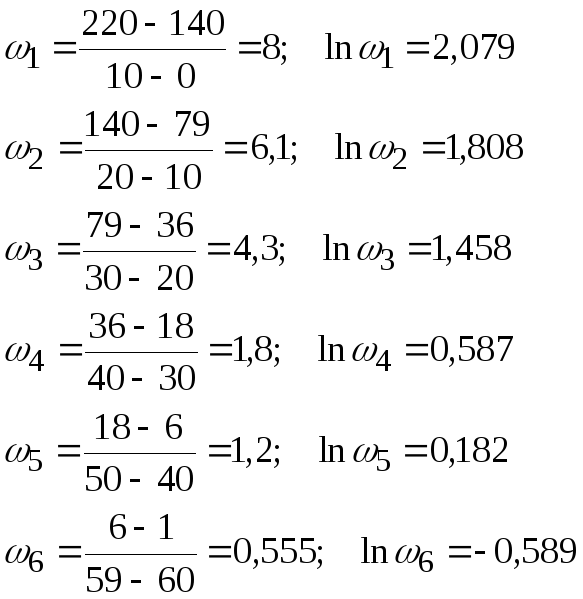
![]()
![]()
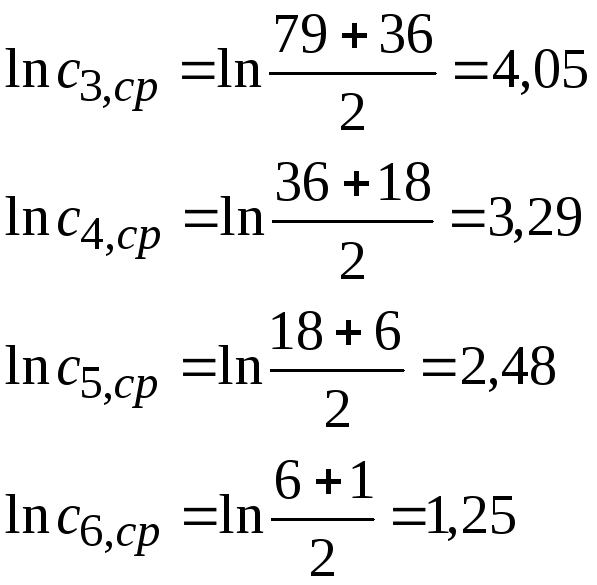
-
ω, моль/м3·мин
8
6,1
4,3
1,8
1,2
0,555
сср, моль/м3
180
109,5
57,5
27
12
3,5
lnω
2,079
1,808
1,458
0,587
0,182
-0,589
lncср
5,19
4,69
4,05
3,29
2,48
1,25
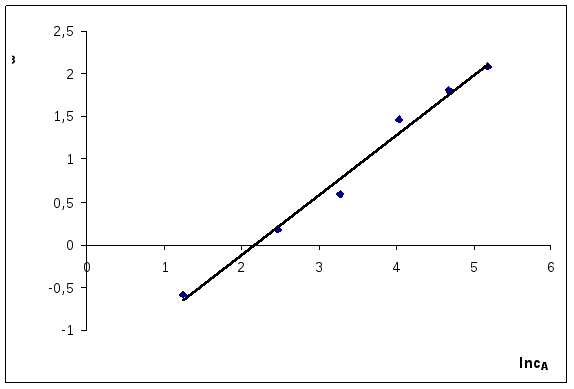
Рассчитаем порядок по компоненту А1
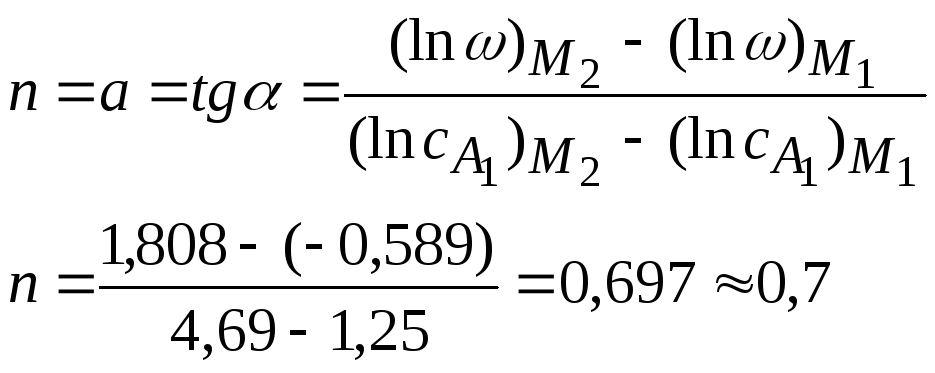
Частный порядок реакции по А1 равен 0,7
Рассчитаем из графика кэфф. Отрезок, отсекаемый по оси ординат равен
lnkэфф = −1,53 => кэфф = exp[−1,53]=0,216
Задача № 3
В реакции омыления эфира щелочью получены экспериментальные данные:
-
τ, мин
0
4,9
10,4
20
28,2
∞
сNaOH, моль/л
6,195
5,059
4,240
3,350
2,935
?
Определить порядок реакции методом подстановки и по Раковскому (по времени полупревращения).
Решение:
Метод подстановки.
I
порядок
![]()
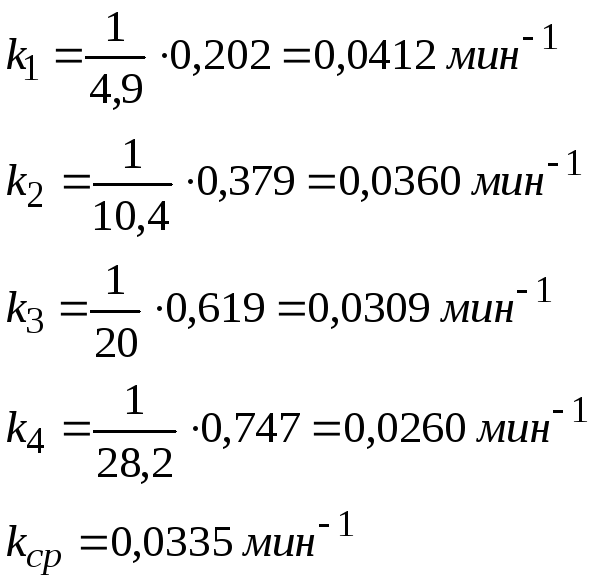
Максимальное отклонение от кср 22%. Разница в значениях k значительная.
II порядок (сА,0 = сВ,0)

Максимальное отклонение от kср 7%. Расчет константы скорости реакции говорит о том, что это реакция II порядка.
По Раковскому
По кинетической кривой cNaOH = f(τ) τ1/2 = 23 мин
II
порядок реакции
![]()
I
порядок
![]()
