
- •Екатеринбург
- •Содержание
- •1. Основные закономерности
- •1.1. Основные понятия
- •1.2. Энтальпия химических реакций
- •1.3. Закон Гесса. Следствие закона Гесса
- •1.4. Энтропия
- •1.5. Возможность самопроизвольного прохождения химических реакций. Энергия Гиббса
- •1.6. Скорость химических реакций
- •1.7. Химическое равновесие
- •Выражение константы равновесия имеет вид
- •1.8.. Принцип Ле Шателье
- •2. Электронное строение атомов и молекул
- •2.1. Квантово-механическая модель электронного строения атома
- •2.2. Основные закономерности распределения электронов в атомах
- •2.3. Электронные формулы атомов. Периодическая система д.И.Менделеева
- •3. Основные классы неорганических соединений: оксиды, гидроксиды, соли.
- •3.1. Оксиды, гидроксиды, соли
- •3.2. Некоторые свойства неорганических соединений Свойства оксидов и гидроксидов
- •Свойства солей
- •4.1. Основные понятия
- •4.2. Растворы электролитов. Электролитическая диссоциация
- •4.3. Ионные реакции в растворах электролитов
- •4.4. Диссоциация воды. Водородный показатель
- •4.5. Гидролиз солей
- •Гидролиз солей слабых кислот и сильных оснований. Гидролиз NaNo2.
- •Гидролиз солей слабых оснований и сильных кислот.
- •Гидролиз солей слабых оснований и слабых кислот.
- •Совместный гидролиз солей.
1.2. Энтальпия химических реакций
Большинство химических реакций сопровождаются выделением или поглощением тепла.
Количество тепла, которое выделяется или поглощается в результате химической реакции, называют её тепловым эффектом. Раздел химии, в котором изучают тепловые эффекты химических реакций, называют термохимией.
В дальнейшем тепловые эффекты химических реакций будем характеризовать величиной DH (кДж/моль). Особенности терминологии таковы, что величину DH называют энтальпией химической реакции (вместо более точного словосочетания – изменение энтальпии в ходе химической реакции).
Реакции, идущие с выделением тепла, называют экзотермическими, идущие с поглощением тепла – эндотермическими.
Принято, что энтальпия экзотермической реакции отрицательна (DH<0), а энтальпия эндотермической реакции положительна (DH>0).
Уравнения химических реакций, записанные с указанием значения энтальпии реакции и агрегатного состояния участвующих в реакции веществ, называют термохимическими уравнениями. Агрегатные состояния веществ обозначают подстрочными индексами: т – твёрдое, к – кристаллическое, ж – жидкое, г – газообразное, р – раствор. В термохимических уравнениях могут быть дробные коэффициенты:
Н2 (Г) + 1/2О2 (Г) = Н2О(Ж) DН0 = – 286 кДж/моль.
В справочных таблицах термодинамических величин приводят не энтальпии конкретных реакций, а стандартные энтальпии образования веществ (DНобр).
Энтальпией образования называют энтальпию реакции образования одного моля данного вещества из простых веществ, устойчивых в стандартных условиях.
Энтальпии образования простых веществ приняты за ноль.
1.3. Закон Гесса. Следствие закона Гесса
Закон, сформулированный Германом Ивановичем Гессом в 1840 году (закон Гесса), – основной закон термохимии:
энтальпия химической реакции зависит только от природы и состояния исходных и конечных веществ и не зависит от числа и характера промежуточных стадий, т.е. от пути процесса.
Из закона Гесса следует, что термохимические уравнения можно складывать и вычитать так же, как и алгебраические.
Следствие закона Гесса:
энтальпия реакции равна разности сумм энтальпий образования продуктов реакции и исходных веществ с учётом стехиометрических коэффициентов.
Как правило, оперируют со стандартными величинами, т.е.
![]() ,
,
где
![]() ,
,
![]() – стандартные энтальпии образования
исходных веществ и продуктов реакции;
– стандартные энтальпии образования
исходных веществ и продуктов реакции;
![]() ,
,
![]() -
стехиометрические коэффициенты.
-
стехиометрические коэффициенты.
Аналогичным образом можно рассчитывать изменение и других функций – энтропии (DS), энергии Гиббса (DG).
1.4. Энтропия
Энтропия
(S)
– количественная мера беспорядка в
системе.
Размерность -
![]() .
Чем беспорядочней система, тем больше
значение энтропии. В таблицах
термодинамических величин приводят
.
Чем беспорядочней система, тем больше
значение энтропии. В таблицах
термодинамических величин приводят![]() значения
стандартных энтропий веществS0.
Стандартная
энтропия простых веществ не равна нулю.
За нуль принимают энтропию совершенного
кристалла любого вещества при абсолютном
нуле температуры.
значения
стандартных энтропий веществS0.
Стандартная
энтропия простых веществ не равна нулю.
За нуль принимают энтропию совершенного
кристалла любого вещества при абсолютном
нуле температуры.
Процессы и реакции, сопровождающиеся увеличением беспорядка в системе: нагревание, расширение, кипение, плавление, растворение, увеличение количества газообразных веществ, - приводят к увеличению энтропии. Процессы, связанные с уменьшением беспорядка в системе, приводят к уменьшению энтропии: охлаждение, конденсация, сжатие, кристаллизация, реакции, сопровождающиеся уменьшением количества газообразных веществ.
Например, оценим изменение энтропии системы в химической реакции:
С(ГРАФИТ) + СО2(Г) = 2СО(Г).
В результате реакции возрастает количество газа, т.е. беспорядок возрастает, и энтропия должна увеличиваться.
-
Вещество
С(ГРАФИТ)
СО2(Г)
СО(Г)
S0,
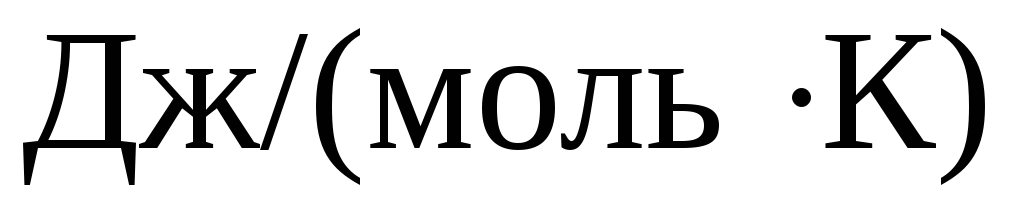
1,36
51,06
47,3
![]() .
.
Расчет подтвердил, что энтропия системы возрастает.
