
Zadachi po obshei himii
.pdf
38.Мочевинумассой3грастворилив500гводы.Чемуравна моляльнаяконцентрация полученногораствора?
[cm  0 100 моль
0 100 моль кг]
кг]
39.К 200 г воды прилили 40 мл раствора с молярной концентрацией хлорида калия 2 моль/л (пл.=1,1 г/мл). Определите молярную концентрацию и массовую долю KCl в полученном растворе,
если его плотность равна 1,05 г/мл. [c(KCl)=0,34 M, ω(KCl)=2,4%]
40.Смешали 4,24 г Na 2CO3 и 216 г воды. Рассчитайте моляльнуюконцентрациюимолярнуюдолюрастворенноговещества врастворе.
[cm  Na2CO3
Na2CO3
 0
0 185 моль
185 моль кг; N
кг; N  Na2CO3
Na2CO3
 3
3 3 10 3]
3 10 3]
41.Плотность 26%-ного раствора KOH равна 1,24 г/мл. Сколькомоль KOH содержитсяв 5 лтакого раствора?
[n  KOH
KOH 
 28 7 моль]
28 7 моль]
42.Рассчитайте молярность, моляльность водного раствора этаноласмассовойдолейравной47%. Плотностьраствораравна 0,92 г/мл. Чему равны молярные доли спирта и воды в данном растворе?
[c C2H5OH
C2H5OH 
 9
9 4 М; cm
4 М; cm  C2H5OH
C2H5OH 
 19
19 3 моль
3 моль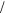 кг;
кг;
N  C2H5OH
C2H5OH 
 0
0 258; N
258; N  H2O
H2O 
 0
0 742]
742]
43. Смешали 200 гбензола,10 гэтанолаи 50 гацетона. Чему равна молярнаядолякаждоговещества?
[N  C6H6
C6H6 
 0
0 703; N
703; N  C2H5OH
C2H5OH 
 0
0 0596; N
0596; N  C3H6O
C3H6O 
 0
0 237]
237]
44. В медицинской практике используют гормональный препарат адреналин в виде растворов. В ампуле содержится 1 мл 0,1%-ного раствора ( 
 1 г
1 г мл). Вычислите молярную концентрацию этого раствора и массу адреналина в 1 мл раствора, введенноговорганизм
мл). Вычислите молярную концентрацию этого раствора и массу адреналина в 1 мл раствора, введенноговорганизм  Mадр
Mадр  219 7 г
219 7 г моль).
моль).
[cадр 4 55 10 3 моль л; mадр 1 10 3 г]
л; mадр 1 10 3 г]
45. Хлорид цинка используется в качестве вяжущего и асептического средства. Определите молярную концентрацию, молярную концентрацию эквивалента, массовую долю и титр рас-
твора, содержащего 5 г ZnCl 2 в 100 г раствора ( 
 1 г мл).
1 г мл).
[c ZnCl2
ZnCl2
 0 37 М; c
0 37 М; c 1
1 2ZnCl2
2ZnCl2
 0 74 моль
0 74 моль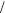 л;
л; 
 5
5 ; T
; T ZnCl2
ZnCl2
 0
0 050 г
050 г мл]
мл]
31

46. Определите молярную концентрацию эквивалента перманганата калия в приготовленном титранте, если на титрование в кислой среде химически чистого дигидрата щавелевой кислоты массой 0,063 г израсходовано раствора перманганата калия обе-
мом 10,25 мл.
[cэкв  KMnO 4
KMnO 4 
 0
0 098 н]
098 н]
47. Водный раствор аммиака массой 2,12 г разбавлен в мерной колбе вместимостью 250 мл. На титрование 10,0 мл разбавленного раствора затрачено 8,4 мл титранта с концентрацией c HCl
HCl 
 0 107 моль
0 107 моль л. Рассчитайте массовую долю аммиака в исходномрастворе.
л. Рассчитайте массовую долю аммиака в исходномрастворе.
[
 NH 3
NH 3
 18
18  04
04 ]
]
48. Для обработки ран используется раствор с массовой долейпероксидаводорода3% ( 
 1 г
1 г мл). Какприготовить 250 мл (стакан) такого раствора из конц ентрированного раствора с массовой долей пероксида водорода 30% (
мл). Какприготовить 250 мл (стакан) такого раствора из конц ентрированного раствора с массовой долей пероксида водорода 30% ( 
 1 г
1 г мл)? Какова молярнаяконцентрацияисходногоиполученногорастворов?
мл)? Какова молярнаяконцентрацияисходногоиполученногорастворов?
[чтобыприготовитьтребуемыйраствор, нужновзять 25 млисходного раствора и добавить 225 мл воды; концентрация исходного раствораравна 8,82 М, полученного — 0,882 М]
49. Содержание ионов Cu 2 составляет в плазме крови 85– 134 мкг. Вычислитеконцентрацию Cu2
составляет в плазме крови 85– 134 мкг. Вычислитеконцентрацию Cu2 вплазмекровивмоль/л,
вплазмекровивмоль/л,
если |
крови 1 |
03 |
г мл. |
||
[c Cu2 |
13 4– |
21 |
1 10 |
|
6 моль л] |
|
|||||
50. Перманганатом калия можно лечить змеиные укусы при отсутствии специальной сыворотки. Для этого в место укуса вводят шприцем 0,5– 1,0 мл 1%-ного раствора KMnO 4. Рассчитайте массуперманганата калияиобъемводы, необходимыедляприготовления 75 мл такого раствора, имеющегоплотность 1,006 г/мл. [m  KMnO 4
KMnO 4 
 0 754 г; V
0 754 г; V  H2O
H2O 
 74 6
74 6  75 мл]
75 мл]
51. В медицинской практике используется 3%-ный водный раствор пероксида водорода, а также 30%-ный раствор H 2O2 («пергидроль»). Какой объем воды надо добавить к 5 мл 30%-ного раствора H 2O2, чтобы получить 3%-ный раствор? Плотностьрастворов принятьравной 1 г/мл.
[V  H2O
H2O 
 45 мл]
45 мл]
32

52. При нагревании и на свету растворы пероксида водорода разлагаютсяитеряютсвоилечебныесвойства. Поэтомурастворы H2O2 хранят в склянках из темного стекла в прохладном месте. Определите объем кислорода (н. у.), который выделится при разложении 100 мл 3%-ного раствора H 2O2. Плотность раствора принятьравной 1 г/мл.
[V  O2
O2 
 0
0 99 л (н. у.)]
99 л (н. у.)]
53. Раствор H 2O2 используют для полоскания горла, полости рта. Для приготовления раствора H 2O2 удобно пользоваться гидроперитом — комплексным соединением H2O2 с карбамидом (мочевиной)состава  NH 2
NH 2  2CO H2O2. Рассчитайтемассовуюдолюпероксидаводородав гидроперите.
2CO H2O2. Рассчитайтемассовуюдолюпероксидаводородав гидроперите.
[
 H2O2
H2O2 
 36
36  17
17 ]
]
54. Вмедицинеприменяются5– 10%-ныеспиртовыераство- ры иода для обработки ран, ссадин, операционного поля. Какой объем 5%-ного спиртового раствора иода можно приготовить из 10 гкристаллическогоиода? Плотность раствора 0,950 г/мл.
[V  211 мл]
211 мл]
55. Раствор Люголя, применяющийся в ЛОР-практике для смазывания слизистой оболочки полости рта и горла, содержит в 17 млводы1 гиодаи2 гиодидакалия. Рассчитайтемассовыедоли иодаииодидакалия врастворе Люголя.
[
 I2
I2 
 0
0 05;
05; 
 KI
KI
 0
0 1]
1]
56. Питьевая сода (NaHCO3) входит в состав многих кулинарных рецептов, а также используется для полоскания горла
в виде 2%-ного раствора. Рассчитайте объем оксида углерода(IV) (н. у.), который может выделитьсяприреакции гидрокарбоната
натрия массой 10 гс избытком солянойкислоты. Сколько г соды нужно растворить в стакане воды (200 мл) для полоскания горла?
[V  CO 2
CO 2 
 2 67 л; m (NaHCO3) = 4,1 г]
2 67 л; m (NaHCO3) = 4,1 г]
57. При укусах муравьев, при соприкосновении с крапивой на коже возникает чувство жжения за счет действия муравьиной кислоты. Какаямассамуравьинойкислотыможетбытьнейтрализована с помощью 10 мл 2%-ного раствора NaHCO3, плотность которогоравна 1,013 г/мл?
[m  HCOOH
HCOOH 
 0 11 г]
0 11 г]
33

58. Определитемассу(г) каждогоизвеществ, взятыхдляприготовления 500 г 5%-ного спиртового раствора иода? Для смягчениядействияэтот раствордолженсодержать 1% глицерина.
[m  иода
иода
 25 г; m
25 г; m  глицерина
глицерина
 5 г; m
5 г; m  спирта
спирта
 470 г]
470 г]
59. Какие массы солии воды необходимовзять для приготовления 500 г 0,9%-ного раствора NaCl? Такой раствор называют изотоническимииспользуютв медицинскойпрактике.
[m  NaCl
NaCl 
 4 5 г; m
4 5 г; m  воды
воды
 495 5 г]
495 5 г]
60. Вычислите, какую массу раствора с массовой долей хлорида натрия 20% необходимодобавить к воде объемом 80 мл для полученияизотоническогораствора.
[m  р-ра
р-ра 
 3 77 г]
3 77 г]
61. Для оттока раневого содержимого наружно используют 3, 5 или 10%-ные растворы хлорида натрия. Вычислите объем воды, которыйнужнодобавитьк 50 г 20%-ногорастворахлорида натрия для получения растворов NaCl: а) 3%-ного; б) 5%-ного; в) 10%-ного.
[объемводыравен: а) 283 мл; б) 150 мл; в) 50 мл]
62. В желудочном соке человека массовая доля HCl составляет всреднем0,05%. Сколько моль HCl содержится в 500 мл желудочного сока? Плотность желудочного сока 1,005 г/мл.
[n  HCl
HCl 
 0 0069 моль]
0 0069 моль]
63. Нашатырныйспирт — этоводныйраствораммиака. Ваптеке для получения нашатырного спирта в 300 г воды растворили 112 л аммиака (н. у.). Вычислите массовую долю аммиака (в %) в полученномрастворе.
[
 NH 3
NH 3
 22
22  08
08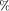 ]
]
64. Растворхлоридакальцияприменяетсявмедициневкачестве кровоостанавливающего и противоаллергического средства. Определитемассукатионовкальция, поступающихворганизмпри приеме внутрь столовой ложки раствора (15 мл), содержащего в 100 мл 5 г гексагидрата хлорида кальция. Какова массовая доля и молярная концентрация раствора, если для приготовления ле-
34

карственногопрепаратахлоридкальциямассой90 грастворилив
водеобъемом 800 мл ( |
1 083 г мл)? |
|
[m Ca 2 |
0 14 г; |
CaCl 2 10 1 ; c CaCl 2 0 985 моль л] |
65. Алюмокалиевыеквасцыиспользуютвмедицинскойпрактикенаружнодляпромываний, примочек. Сколькограммовквасцовнадодобавитьк1000 г5%-но горастворасульфатакалия, чтобымассоваядоляпоследнегоувеличиласьвдвое? Чтопроизойдет, если на полученный раствор подействовать избытком сульфида калия?
[m  квасцов
квасцов
 598 г]
598 г]
66. Вмедицинскойпрактикеиспользуется0,9%-ныйраствор NaCl вкачествеизотонического. РассчитайтемассукатионовNa  ианионов Cl в 100 млизотоническогораствора, плотностькоторогоравна 1,005 г/мл.
ианионов Cl в 100 млизотоническогораствора, плотностькоторогоравна 1,005 г/мл.
[m  Na
Na 

 0 36 г; m
0 36 г; m  Cl
Cl 

 0 55 г]
0 55 г]
67. В домашней аптечке часто можно встретить алюмокалиевые квасцы (KAl  SO 4
SO 4  2 12H 2O) — додекагидрат сульфата алюминия-калия. Разбавленные водные растворы этого соединения обладают кровоостанавливающим и противовоспалительным действием. Рассчитайте: а) количество(моль) водыв4,74 галюмокалиевыхквасцов;б) количество(моль) ичислоатомовкислорода иводородав 18,88 галюмокалиевыхквасцов.
2 12H 2O) — додекагидрат сульфата алюминия-калия. Разбавленные водные растворы этого соединения обладают кровоостанавливающим и противовоспалительным действием. Рассчитайте: а) количество(моль) водыв4,74 галюмокалиевыхквасцов;б) количество(моль) ичислоатомовкислорода иводородав 18,88 галюмокалиевыхквасцов.
[ H2O |
0 12 моль; O |
0 80 моль; |
H |
0 96 моль; |
N O 4 8 1023; N H 5 8 1023 ] |
|
|
||
68. |
«Свинцовый сахар» — |
тригидрат |
ацетата |
свинца(II) |
Pb  CH 3COO
CH 3COO  2 3H2O — входит в состав «свинцовой примочки» — раствора, который обладае т охлаждающим, вяжущим и противомикробным действием и незаменим при ушибах. Рассчитайте: а) массу воды в 1 моль этой соли; б) количество и число атомов кислородаиводородав томже количестве соли.
2 3H2O — входит в состав «свинцовой примочки» — раствора, который обладае т охлаждающим, вяжущим и противомикробным действием и незаменим при ушибах. Рассчитайте: а) массу воды в 1 моль этой соли; б) количество и число атомов кислородаиводородав томже количестве соли.
[m  H2O
H2O 
 54 г;
54 г; 
 O
O 
 7 моль;
7 моль; 
 H
H 
 12 моль; N
12 моль; N  O
O 
 4 2 1024; N
4 2 1024; N  H
H 
 7 2 1024 ]
7 2 1024 ]
69. Массоваядоляцинка, входящеговсоставядакобры(ценное лекарство!), равна 0,5%. Сколько атомов цинка потребуется кобре дляпроизводства 1 капли (30 мг) яда?
[N  Zn
Zn 
 1 38 1018 атомов]
1 38 1018 атомов]
35
70. Хлор используется для обеззараживания воды. Рассчитайте, какая масса хлора потребуется для хлорирования 500 г воды, если при хлорировании расходуется 0,002 мг хлора на 1 л воды. Объясните химико-биологическую сущность хлорирования.
[m Cl2 0 001 г]
71. Рассчитайте массу серебра, израсходованного при получении нитрата серебра («ляписа»), если в реакции серебра с азотной кислотой выделяется 4,48 л (н. у.) оксида азота(IV), а потери газа составляют 20%.
[m Ag 27 г]
72. При отравлениях ляписом желудок промывают 2%-ным раствором хлорида натрия. Рассчитайте массу AgCl, которая получится при реакции нитрата серебра массой 0,1 г с избытком хлорида натрия.
[m AgCl 0 084 г]
73. В состав успокаивающих средств (валидол, корвалол, валокардин) входит изовалериановая кислота C4H9COOH. Рассчитайте, какое количество изовалериановой кислоты прореагирует с гидроксидом натрия, содержащимся в 50 мл 0,1 М раствора.
[n C4H9COOH 0 005 моль]
74. При кипячении с водой аспирин распадается на салициловую и уксусную кислоты. Рассчитайте число молекул салициловой кислоты и ее молярную концентрацию в растворе, который образуется после растворения одной таблетки аспирина в 100 мл воды и последующего кипячения. Масса таблетки 0,5 г.
[N 1 67 1021; c сал. к-ты 0 028 моль л]
75. Молярная концентрация окислителя в растворе равна
0,05 моль/л. Рассчитайте молярную концентрацию эквивалента
окислителя, учитывая химизм реакции: |
|
|
|
|||||||
|
а) NH4 2Cr2O7 KI H2SO4 Cr2 |
SO4 |
3 |
|
||||||
|
б) NaIO3 |
KI |
H2SO4 I2 |
|
|
|
|
|||
|
1 |
2Cr2O7 |
|
|
|
|
|
|
||
[а) c 6 NH4 |
|
0 3 моль л; |
|
|
|
|||||
б) c |
1 |
|
|
|
|
|
|
|
|
|
10NaIO3 |
|
0 5 моль л] |
|
|
|
|
||||
76. Молярная концентрация восстановителя в растворе равна 0,05 моль/л. Определите молярную концентрацию эквива-
36
лента восстановителя, принимая во внимание химизм реакции H2O2 KIO3 H2SO4 I2 O2
[c |
1 |
|
|
|
|
2H2O2 |
|
0 1 моль л] |
|||
|
77. |
К 50 мл подкисленного раствора с молярной концентра- |
|||
цией сульфата железа(II) 0,03 моль/л добавили 0,032 г KMnO4. Какой объем раствора с молярной концентрацией KMnO4 0,01 моль/л следует добавить к полученной смеси для полного окисления сульфата железа(II)?
[V р-ра 9 75 мл]
78. На титрование раствора объемом 10 мл, содержащего пероксид водорода, израсходовано 9,8 мл 0,02 М раствора KMnO4 в сильнокислой среде. Какова масса пероксида водорода в 100 мл раствора?
[m H2O2 0 167 г]
79. Во сколько раз необходимо разбавить сточную воду, содержащую 0,001 моль/л Hg2 , чтобы ее можно было сливать в водоем? ПДК Hg2 0 005 мг л.
[в 41 000 раз]
80. Во сколько раз необходимо разбавить сточную воду, содержащую 0,001 моль/л фенола, чтобы ее можно было сливать в водоем, если ПДК фенола 0 001 мг л?
[в 94 000 раз]
81. Во сколько раз необходимо разбавить сточную воду, содержащую 0,001 моль/л KCN, чтобы ее можно было сливать в водоем? ПДК KCN 0 01 мг л.
[в 6500 раз]
82. Определите, сколько мл 0,1 н. раствора трилона Б и 0,1 н. раствора HCl израсходовано при определении жесткости воды методом комплексонометрии, если объем пробы воды равен 100 мл. Результаты анализа: общая жесткость Жо 3 ммоль экв л, карбонатная жесткость Жк 2 5 ммоль экв л.
[V р-ра трилона Б 3 мл; V р-ра HCl 2 5 мл]
83. Сколько мл 0,1 н. раствора трилона Б и 0,05 н. раствора HCl израсходовано при определении жесткости воды методом
37

комплексонометрии, если объем пробы воды равен 100 мл? Результаты анализа: общая жесткость Ж о  2 5 ммоль экв
2 5 ммоль экв л, карбонатная жесткостьЖ к
л, карбонатная жесткостьЖ к  2 ммольэкв
2 ммольэкв л.
л.
[V  р-ра трилонаБ
р-ра трилонаБ 
 2 5 мл; V
2 5 мл; V  р-ра HCl
р-ра HCl 
 4 мл]
4 мл]
84. Какую массу икаких реагентов нужнозатратить на умяг-
чение |
30 л воды, имеющей |
следующие величины жесткости: |
Жк |
1 6 ммоль экв л, Жо |
2 75 ммоль экв л? Составьте урав- |
ненияпроцессовумягчения. |
|
|
[mк |
1 776 г; mо 4 372 г] |
|
85. Наумягчениеводыобемом150 лизрасходованоCa  OH
OH  2 массой 5,57 г и Na2CO 3 массой 26,6 г. Рассчитайте общую жесткостьЖо исходнойводы. Составьтеуравненияпроцессовумягчения.
2 массой 5,57 г и Na2CO 3 массой 26,6 г. Рассчитайте общую жесткостьЖо исходнойводы. Составьтеуравненияпроцессовумягчения.
[Жо |
4 30 ммоль экв л] |
86. |
В 4 м3 водысодержатсяCa HCO 3 2 массой648 гиCaCl 2 |
массой 1335 г. Определите общуюжесткостьводы. |
|
[Жо |
8 0 ммоль экв л] |
87.Общая жесткость воды в реке Кубань равна 4,6 ммоль-экв/л,
авременная - 3,5 ммоль-экв/л. Какая масса соды Na2CO3 необходима для умягчения 5 л воды? [2,4 г]
88.На титрование пробы раствора гидроксиданатрия затратили15,1 млрабочегорастворасконцентрациейсолянойкислоты 0,103 моль/л. Чему равна масса NaOH в исследуемомрастворе?
[m  NaOH
NaOH 
 0 062 г]
0 062 г]
89. Загрязненный примесями образец дигидрата щавелевой кислотымассой1,300 граствориливколбена100 мл.Натитрование 10,0 мл полученного раствора перманганатом калия в кислой средебылозатрачено 20 млтитранта, c KMnO 4
KMnO 4
 0 002 моль
0 002 моль л. Рассчитайте массовуюдолюосновноговещества в образце.
л. Рассчитайте массовуюдолюосновноговещества в образце.
[
 H2C2O4 2H2O
H2C2O4 2H2O 
 96
96 9
9 ]
]
90. Вычислите массу уксусной кислоты в исследуемом растворе, если на титрование пробы этого раствора было затрачено 20,5 мл раствора с молярной концентрацией NaOH, равной
0,1145 моль/л.
[m  CH 3COOH
CH 3COOH 
 0
0 141 г]
141 г]
38

91. Рассчитайте молярную концентрацию хлорида ртути(II) в неводном растворе, полученном смешиванием 9,98 г соли и 120 мл этанола, плотностькоторого равна 785 г/л.
[0,39 моль/кг]
92.Приотравленияхцианидами внутривенновводят2%-ный
раствор нитрита натрия (  р ра
р ра  1 011 г
1 011 г мл
мл . Рассчитайте молярнуюконцентарцию ититр солив данномрастворе.
. Рассчитайте молярнуюконцентарцию ититр солив данномрастворе.
[c NaNO 2
NaNO 2 
 0 2930 моль
0 2930 моль л; T
л; T NaNO 2
NaNO 2 
 0 02022 г
0 02022 г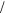 мл]
мл]
93.Общая концентрация ионов кальция в плазме крови составляет2,5ммоль/л,нотолько46% находитсявсвободномионизированномсостоянии.Предполагая,чтосвободныеионыкальция находятся только в виде хлорида кальция, вычислите массовую долю (в % и мг %)хлорида кальция в плазме крови. Плотность плазмы кровисоставляет 1,04 г/мл.
[ω CaCl 2
CaCl 2 
 0 0124
0 0124 или 12 4 мг%]
или 12 4 мг%]
94.Ампула фиксанала содержит 0,1 моль-эквивалентов дихромата калия. Из ампулы приготовили 2 л раствора. Какова молярнаяконцентрация эквивалента дихромата калия в полученном растворе? Фактор эквивалентности солиравен 1/6.
[c 1
1 6K2Cr2O7
6K2Cr2O7 
 0 05 моль
0 05 моль л]
л]
95.При определении кислотности желудочного сока на титрование15млсокабылоизрасходовано6,5млрастворасмолярной концентрацией гидроксиданатрия 0,02 моль/л. Какова масса солянойкислотыв 200 млжелудочногосока?
[m  HCl
HCl 
 0 064 г]
0 064 г]
96.Какой объем воды необходимо добавить к 200 мл раствора с молярнойконцентрацией хлорида натрия 1 моль/л, чтобы приготовить раствор с молярной концентрацией хлорида натрия 0,154 моль/л, используемый в медицинской практике как изотоническийплазме крови?
[V  H2O
H2O 
 1
1 1 л]
1 л]

М о д у л ь 2
ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ И ХИМИЧЕСКОЙ ЭНЕРГИИ
ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ И КИНЕТИЧЕСКИЕ ВЕЛИЧИНЫ
Параметр |
|
|
Обозначение, |
|
Смысловое значение |
||||||
|
|
|
единица |
|
|
||||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
||||||
Внутренняя |
|
|
U, кДж/моль |
|
Полная энергия системы, рав- |
||||||
энергия |
|
|
|
|
|
|
|
|
|
|
ная сумме кинетической, потен- |
|
|
|
|
|
|
|
|
|
|
|
циальной и других видов энер- |
|
|
|
|
|
|
|
|
|
|
|
гии всех частиц этой системы. |
|
|
|
|
|
|
|
|
|
|
|
Это функция состояния, прира- |
|
|
|
|
|
|
|
|
|
|
|
щение которой равно теплоте, |
|
|
|
|
|
|
|
|
|
|
|
полученной системой в изохор- |
|
|
|
|
|
|
|
|
|
|
|
ном процессе |
|
|
|
|
|
|
||||||
Работа |
|
|
A, кДж/моль |
|
Энергетическая мера напра- |
||||||
|
|
|
|
|
|
|
|
|
|
|
вленных форм движениячастиц |
|
|
|
|
|
|
|
|
|
|
|
в процессе взаимодействия си- |
|
|
|
|
|
|
|
|
|
|
|
стемы с окружающей средой |
|
|
|
|
|
|
||||||
Теплота |
|
|
Q, кДж/моль |
|
Энергетическая мера хаотиче- |
||||||
|
|
|
|
|
|
|
|
|
|
|
ских форм движения частиц |
|
|
|
|
|
|
|
|
|
|
|
в процессе взаимодействия си- |
|
|
|
|
|
|
|
|
|
|
|
стемы с окружающей средой |
|
|
|
|
|
|
||||||
Первый |
|
|
Q U A |
|
Теплота, подведенная к закры- |
||||||
закон термо- |
|
|
|
|
|
|
|
|
|
|
той системе, расходуется на |
динамики |
|
|
|
|
|
|
|
|
|
|
увеличение внутренней энергии |
|
|
|
|
|
|
|
|
|
|
|
системы и на совершение си- |
|
|
|
|
|
|
|
|
|
|
|
стемой работы против внешних |
|
|
|
|
|
|
|
|
|
|
|
сил окружающей среды |
|
|
|
|
|
|
||||||
Энтропия |
|
S, Дж моль |
К |
|
Функциясостояния,характери- |
||||||
|
|
S |
|
Q |
|
T, |
|
|
Æ |
|
зующая меру неупорядоченно- |
|
|
|
|
|
Sр-ции |
|
сти системы, т. е. неоднородно- |
||||
|
iSiÆ прод. р-ции |
||||||||||
|
|
|
|
SÆ исх. в-в |
сти расположения и движения |
||||||
|
|
|
|
i |
|
i |
|
|
|
|
ее частиц, приращение которой |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
40
