
- •Моногалогенопроизводные
- •I. Моногалогенопроизводные, галоидные алкилы.
- •Методы получения
- •1. Реакции нуклеофильного замещения атома галогена (Hal)
- •Характеристика связей углерод-галоген
- •II. Реакции элиминировании (е) (отщепления) в ряду моногалогенозамещенных.
- •III. Реакции моногалогенопроизводных с металлами
- •3. Получение литийорганических соединений.
- •Алкенилгалогениды
- •Одноатомные спирты (алканолы)
- •II. Спирты – основания и нуклеофилы
- •1. Проявление оснόвных свойств
- •2. Проявление нуклеофильных свойств
- •III. Реакции замещения он-группы
- •2. Реакции замещения он группы на галоген.
- •IV. Внутримолекулярная дегидратация
- •V. Окисление и дегидрирование спиртов
- •Многоатомные спирты
- •Методы получения
- •2.Образование сложных эфиров
- •3. Реакция замещения он-группы на галоген
- •5. Периодатное окисление
- •Простые эфиры
- •II. Нуклеофильные свойства
Одноатомные спирты (алканолы)
Номенклатура и классификация

Методы получения
1. Гидратация алкенов (см. тему «Алкены»)
2. Из альдегидов и кетонов восстановлением или действием реактивов Гриньяра (см. тему «Альдегиды и кетоны»).
3. Гидролиз в щелочных условиях моногалогенопроизводных.
Строение
Атомы углерода и кислорода в алифатических спиртах находятся в sp3-гибридизации.

(длины связей С-О и О-Н)
Спирты образуют ассоциаты с помощью водородных связей. Энергия водородных связей составляет 20 кДж/моль, с этим связаны высокие температуры кипения спиртов (т. кип. метанола – 64оС, т. кип. этанола – 78оС).
Реакционная способность
Основные реакционные центры одноатόмных спиртов указаны на схеме:

I. Спирты – ОН –кислоты (кислотные свойства спиртов).
Спирты являются очень слабыми ОН – кислотами, слабее воды.
Значения рКа некоторых спиртов
СН3ОН 15,5 ССl3 – CH2OH 12
CH3CH2OH 15,9 (CF3)3C – OH 6,5
(CH3)3C – OH 18,0
Для сравнения: рКа Н2О 15,7
Спирты реагируют со щелочными и щелочно-земельными металлами, а так же с солями более слабых кислот, при этом образуются алкоголяты (солеобразные соединения). Алкоголяты легко гидролизуются до спиртов, так как НОН более сильная кислота, чем спирты.
Примеры реакций:

Реакции со щелочами обратимы.
II. Спирты – основания и нуклеофилы
1. Проявление оснόвных свойств
Спирты являются основаниями Льюиса за счет двух НПЭ атомов кислорода, и способны реагировать с протонными кислотами и кислотами Льюиса с образованием солеобразных соединений.

2. Проявление нуклеофильных свойств
Нуклеофильность спиртов как и их основность связана с наличием двух НПЭ. Спирты относятся к слабым нуклеофилам.
а) реакция этерификации – образование сложных эфиров из спиртов и кислот (органических и минеральных). В этом разделе рассматривается образование сложных эфиров карбоновых кислот.
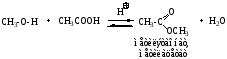
Механизм SN (нуклеофильное замещение ОН-группы в карбоновой кислоте на алкоксигруппу из спирта).

б) Алкоголиз третичных галоидных алкилов; синтез простых эфиров, содержащих углеводородный радикал третичного типа (для первичных и вторичных галогенидов не реализуется).

Механизм SN1

III. Реакции замещения он-группы
Образование сложных эфиров минеральных кислот
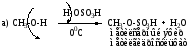

2. Реакции замещения он группы на галоген.
а) реакция с HHal (кроме HF – слишком слабая кислота)
Общая схема реакции:

Сила галогеноводородных кислот уменьшается в ряду:

В случае HI реакция идет до образования алкана

Поскольку реакция равновесна и присутствие воды сдвигает равновесие влево, HCl и HBr используют в виде газов или концентрированных кислот, связывание воды и смещают равновесие реакции вправо.
Замещение ОН-группы в спиртах относится к реакциям нуклеофильного замещения. В качестве нуклеофилов выступают бромид- и хлорид-анионы, причём Br- более сильный нуклеофил, чем Cl- (электроотрицательность брома меньше электроотрицательности хлора, размер атома брома больше размера атома хлора).
Для первичных спиртов реакция с HCl идет только в присутствии безводного ZnCl2, причиной является высокая прочность связи С-О в первичных спиртах (для ее разрыва необходима помощь кислоты Льюиса).

Механизм SN2 (для RпОН)
1-й этап: связывание ОН-группы и катализатора (образование оксониевого иона) для превращения ОН-группы в хорошую уходящую группу.
2-й этап: нуклеофильная атака хлор-аниона, образование переходного состояния.

Вторичные и третичные спирты реагируют без катализатора по механизму SN1.

Механизм SN1 (для RтОН)
1-й этап: превращение ОН-группы в хорошую уходящую группу (*) за счет протонирования кислорода.
2-й этап: диссоциация с образованием карбкатиона.

Реакции с HBr идут легче, т.к. нуклеофильность бром-аниона больше нуклеофильности хлор-аниона.
б) Реакции с SOCl2, PCl5
Использование хлористого тионила и пятихлористого фосфора, является наиболее удобным способом получения хлоридов всех типов. Реакции с SOCl2 и PCl5 идут через образование промежуточного соединения, в котором ОН-группа превращается в хорошую уходящую (сложноэфирную) группу на первомэтапе взаимодействия с реагентом. Далее эта группа удаляется при внутримолекулярной нуклефильной атаке галогена.
Реакция с SOCl2

Реакция с PCl5

3.Образование простых эфиров (только для первичных спиртов)

Реакцию можно рассматривать также как межмолекулярную дегидратацию. Кроме концентрированной серной кислоты в качестве водоотнимающего агента используют Al2O3 при 300С. В этих условиях вторичные и третичные спирты не могут давать простые эфиры, они превращаются в алкены, т.е. происходит внутримолекулярная дегидратация.
