
02. Титриметричний аналіз
..pdf
питомої електропровідності тощо. При цьому визначаєма КТТ максимально наближена або співпадає з точкою еквівалентності.
Візуальні методи фіксування КТТ поділяють на безіндикаторні та індикаторні.
Вбезіндикаторних методах КТТ визначають за появою чи зникненням забарвлення титранту або розчину, що титрують.
Віндикаторних методах до аналізуємої проби додають індикатор, який
надає їй певне забарвлення, і далі титрують до різкої зміни цього забарвлення.
Титриметричний аналіз має ряд переваг над іншими методами аналізу – це простота обладнання; швидкість виконання аналізу; можливість автоматизації процесу; досить висока точність (відносна похибка визначень 0,01–0,1%).
Розрахунки в титриметричному аналізі
В основі усіх розрахунків у титриметричному аналізі лежить закон еквівалентів.
Хімічні елементи і речовини реагують між собою у масових кількостях, пропорційних їхнім еквівалентам.
Еквівалент елемента простої чи складної речовини – це така його кількість, яка приєднує або заміщує у хімічних реакціях один моль атомів водню, або взаємодіє з одним еквівалентом будь-якої речовини.
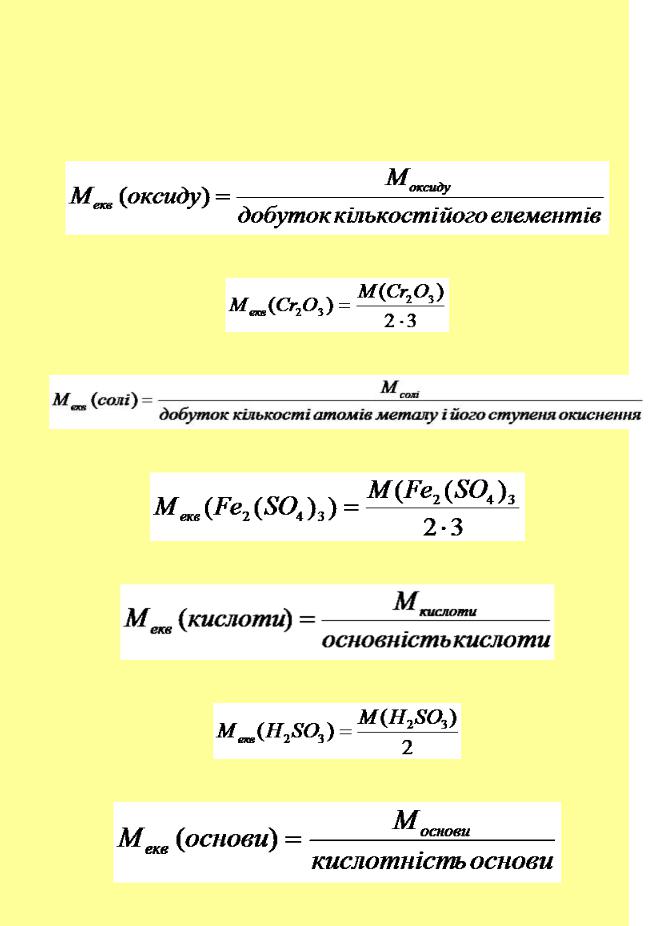
Масу одного еквівалента елемента або речовини називають молярною масою еквівалента або еквівалентною масою (одиниці вимірювання г/моль)
Еквівалентну масу оксиду розраховують за формулою:
Наприклад:
Еквівалентну масу солі розраховують за формулою:
Наприклад:
Еквівалентну масу кислоти розраховують за формулою:
Наприклад:
Еквівалентну масу основи розраховують за формулою:
Наприклад:

Втитриметричному аналізі використовують наступні способи вираження концентрацій розчинів.
1. Молярна концентрація речовини у розчині С — це відношення кількості розчиненої речовини в молях, що міститься у розчині, до об'єму цього розчину.
Всистемі СІ основною одиницею молярної концентрації є моль/л. Скорочено дозволяється молярні концентрації позначати літерою М. Наприклад, розчин з молярною концентрацією розчиненої речовини, рівною 0,1 моль/л можна позначити як 0,1 М розчин. Правилами ІЮПАК термін ”молярність розчину” не рекомендований для користування. Не дозволяється також скорочення М для позначення одиниць вимірювання молярної концентрації. Наприклад, не слід писати С(HCl)=0,1 М.
2. Молярна концентрація речовини еквівалента у розчині або нормальна концентрація (застарілі назви«еквівалентна» концентрація або «нормальність») — це відношення кількості речовини еквівалента у розчині до об'єму цього розчину
Одиниця вимірювання молярної концентрації еквівалента: моль/л За рекомендаціями ІЮПАК, якщо в 1 л розчину міститься 1 моль
речовини еквівалента, то такий розчин можна назвати нормальним розчином

цієї речовини. Тому скорочено молярні концентрації еквіваленту можна позначати літерами н. або N. Не допускається скорочення н. або N для позначення одиниць вимірювання молярної концентрації еквівалента. Не слід писати С(1/2 H2SO4)= 0,1 н. Використання термінів "грам-еквівалент", "грамеквівалент/літр", ”нормальність” не рекомендується.
Слід підкреслити, що використання термінів ”нормальний” розчин і ”нормальна” концентрація має сенс лише тоді, коли фактор еквівалентності менший одиниці. У тих випадках, коли фактор еквівалентності дорівнює одиниці, слід користуватися виключно терміном ”молярний” розчин і молярна концентрація. Наприклад, для 0,01 М розчину HCl (f екв =1) не слід використовувати вираз 0,01н. HCl .
Титр розчину Т– це кількість грамів речовини, що міститься в1 см3 розчину:
Одиниці вимірювання: г/см або г/мл.
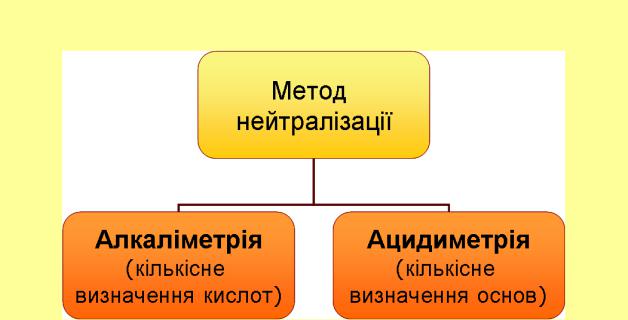
МЕТОД НЕЙТРАЛІЗАЦІЇ Сутність методу нейтралізації
В основі методу нейтралізації лежить реакція між кислотами та лугами, наприклад:
Отже, у точці еквівалентності буде мати місце співвідношення 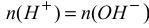 , з якого випливає, що при титруванні сильних кислот
, з якого випливає, що при титруванні сильних кислот

сильними лугами (або навпаки), рН у точці еквівалентності буде дорівнювати 7.
Дисоціація води. Іонний добуток води. Водневий показник.
Чиста вода є слабким електролітом, який в незначній мірі проводить електричний струм. Насправді, при 22°С її ступінь електролітичної дисоціації дорівнює 1,8 10-9, тобто дисоціює тільки одна молекула з 555 000 000 молекул води. Однією з причин такої незначної дисоціації води є те, що дисоціація пригнічується дією водневих зв'язків, які типові для води. Дисоціацію води можна записати таким чином:
2Н2О Н3О+ + ОН-.
Для спрощення і зручності рівняння записують у такому вигляді: Н2О Н+ + ОН-.
Застосувавши до цієї рівноваги закон діючих мас, маємо:
де К – константа електролітичної дисоціації води, яка дорівнює 1,8 10-
16.
Оскільки ступінь дисоціації води дуже маленька величина, то практично [H2O] = const (кількість дисоційованих молекул не враховують) і тоді
[H+] [OH-] = KН2О. Константа KН2О називається іонним добутком води.
Оскільки [H2O] = 1000г/18 = 55,56 моль/л, то при 22°С KН2О = 10-14. Таким чином [H+][OH-] =10-14.
Значення KН2О є сталою величиною при даній температурі.
При кімнатній температурі нейтральні розчини мають однакову концентрацію: [H+] = [OH-] = 10-7 моль/л и KН2О = 10-14. таке ж саме значення KН2О мають при такій же температурі і водні розчини кислот і основ. Тому,

якою б не була концентрація іонів гідрогена, концентрація гідроксид-іонів не матиме нульового значення або навпаки. Це дає можливість розраховувати концентрацію [H+] або [OH-], якщо одна з цих величин відома:
Наприклад, концентрація іонів гідрогена в 5 10-3 М розчині натрій
гідроксиду дорівнює:
|
10 |
−14 |
|
||
[H + ] = |
|
|
= 2 10−12 |
моль / л |
|
5 10 |
−3 |
||||
|
|
|
|
||
Проте записувати концентрації іонів H+ і OH- через негативний ступінь не зовсім зручно. Тому кислотні властивості розчинів датський біохімік Серенса запропонував характеризувати величиною водневого показника рН, який визначається співвідношенням
pH = - lg [H+]
оскільки експериментально в розчині визначають не концентрацію іонів водню, а їх активність.
Оскільки концентрація іонів гідрогена може змінюватися в межах іонного добутку, то рН змінюється в інтервалі від 0 до 14.
У нейтральному розчині [H+] = 10-7 моль/л; рН = - lg 10-7 = 7. У кислому розчині [H+] > 10-7 моль/л; рН<7. Так, для 10-3 н. розчині НСl [H+] = 10-3
моль/л; рН = 3. Для розчину КОН такої ж концентрації
|
+ |
|
KH2O |
|
|
10−14 |
−11 |
|
||||
[H |
|
] = |
|
|
|
= |
|
|
|
= 10 |
|
; PH = 11 |
|
[OH |
− |
|
10 |
−3 |
|
||||||
|
|
|
|
] |
|
|
|
|
||||
Таким чином, нейтральний розчин рН = 7 |
||
кислий розчин |
рН < |
7 |
лужний розчин |
рН > 7 |
|
Розчини, значення рН яких знаходяться в інтервалі від 0 до 3, належать до сильнокислих; при рН = 4…6 – слабокисле середовище. Слаболужні розчини мають рН = 8…10, а сильно лужні – рН = 11…14.
Вивчення рН розчинів має велике практичне значення в хімії, біології, медицині, харчовій промисловості, сільському господарстві тощо. Так, грунтознавцям обов'язково необхідно знати рН грунтів, щоб правильно здійснювати комплекс агрохімічних прийомів для вирощування високих урожаїв.
У медицині дуже важливо знати рН, наприклад, крові, шлункового соку, оскільки відхилення рН від норми свідчить про хвороботворні процеси в організмі людини. Так, рН крові здорової людини приблизно дорівнює 7,4, а хворого – 5,9. Дуже важливим є контроль рН хімічних і біологічних процесів за участю ферментів.
Класифікація методів кислотно-основного титрування
Приготування та стандартизація робочих розчинів
У якості робочих розчинів у методі нейтралізації використовують: розчини кислот (найчастіше 0,1 М або 0,05 М розчин ) HCl та розчини лугів (найчастіше 0,1 М або 0,05 М розчин ) NaOH . Приготування та стандартизація 0,1 М розчину HCl

а) приготування 0,1 М розчину HCl
Загалом, часто розчин HCl готують з фіксаналу. У випадку відсутності фіксаналу, приймаючи до уваги леткість і токсичність хлоридної кислоти, її розчин готують наступним чином:
1)розраховують, яка кількість грамів НСl повинна міститися в1 л 0,1М розчину:
2)оскільки чистої хлоридної кислоти не існує, то для подальших розрахунків визначають густину наявної хлоридної кислоти. Її виміряють ареометром, для чого останній занурюють у циліндр з кислотою, а потім за таблицею (див. Довідник хіміка) знаходять її процентну концентрацію за знайденою густиною кислоти;
3)розраховують, в якій кількості кислоти, що є в лабораторії, міститься потрібне число грамів чистої НСl;
4)оскільки зважувати кислоту незручно, то перераховують її масу на об’єм V, виходячи із співвідношення V= m/ρ,(де m– маса кислоти, г; ρ– густина кис-лоти, г/см3);
5)відміряють знайдений об’єм кислоти циліндром або піпеткою, розводять дистильованою водою до 1 л у мірній колбі і ретельно перемішують отриманий розчин. Розчин переливають у чисту склянку, наносять маркування (концентрація, дата).
б) Стандартизація приготованого розчину HCl
Стандартизацію розчину HCl проводять за первинним розчином бури (Na2B4O7 10H2O), який був приготовлений з фіксаналу. Концентрація цього
розчину: С (1/2 Na2B4O7 10H2O) = 0,1 моль/л. В основі стандартизації лежить наступна реакція:

Концентрацію кислоти встановлюють титруванням 10 або 20 мл розчину бури з метиловим жовтогарячим 0,1М розчином хлоридної кислоти. Титрування вважають закінченим у той момент, коли забарвлення індикатора
врозчині перейде (від додавання однієї краплі хлоридної кислоти) з жовтого
вжовтогаряче (рН= 4). Визначають за бюреткою об’єм розчину кислоти, витраченої на титрування, і занотовують дані в журнал. Титрування повторюють декілька разів до отримання не менш, ніж трьох результатів, що відрізняються не більш, як на 0,03 мл, причому кожного разу рівень розчину
вбюретці треба встановлювати на нуль, а при відліку стежити за тим, щоб око було на рівні меніску.
Знаходять середнє значення об’ємів хлоридної кислоти, витрачених на титрування, враховуючи тільки результати, що сходяться, і визначають її концентрацію із співвідношення:
де С (1/2 бури ) – молярна концентрація еквівалента бури, моль/л; C (HCl) - молярна концентрація хлоридної кислоти, моль/л;
V (бури) V ( HCl) – об’єми відповідних розчинів, мл.
Приготування та стандартизація 0,1 М робочого розчину лугу
У методі нейтралізації в якості розчинів лугів використовують зазвичай 0,1 М розчин гідроксиду натрію. Оскільки NaOH енергійно реагує з СО2 повітря, утворюючи на поверхні реактиву карбонати, та є гігроскопічним, то його розчин готують швидко, за приблизною наважкою.
а) Приготування ~ 0,1 М розчину NaOH
Для приготування1 л 0,1 М розчину гідроксиду натрію наважка NaOH повинна бути 4 г (m(NaOH) = 0,1·40 =4 г ), але замість розрахованих 4 г NaOH беруть 5–6 г. Наважку зважують швидко на технохімічних вагах в
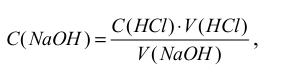
закритому бюксі. Після чого висипають її у склянку і ополіскують 2–3 рази малими порціями води. Промитий їдкий натр вміщують у калібровану на 1 л колбу, доливають невелику кількість води, а коли реактив повністю розчиниться, дають розчинові охолонути і доводять об’єм розчину дистильованою водою до позначки. Ретельно перемішують і переливають у чисту склянку. Наносять маркування (концентрація, дата).
б) Стандартизація приготованого розчину NaOH
Стандартизацію розчину NaOH виконують відстандартизованим робочим розчином HCl або за 0,1 М розчином HCl, який приготували з фіксаналу.
Для титрування сильної кислоти гідроксидом натрію можна вибрати будь-який індикатор, рН якого найближче підходить до рН= 7 (точка еквівалентності). У випадку титрування сильних кислот лугами (або навпаки) можуть використовуватися і метиловий жовтогарячий, і фенолфталеїн.
Концентрацію лугу встановлюють швидким титруванням 10 або 20 мл робочого розчину HCl з метиловим жовтогарячим приготованим розчином NaOH до переходу кольору від червоного через жовтогарячий до жовтого від однієї краплини NaOH (рН= 4,4). З фенолфталеїном розчин HCl титрують від безкольорового до слабко рожевого забарвлення (рН= 9), яке не зникає протягом 30 сек. Титрування повторюють не менш ніж тричі; різниця у вимірюванні об’єму не повинна перевищувати 0,03 мл. Користуючись кількома індикаторами (метиловий жовтогарячий, фенолфталеїн), перевіряють концентрацію розчину лугу.
Розрахунок концентрації лугу ) ( NaOH C виконують за формулою:
де C( HCl) – молярна концентрація кислоти, моль/л;
V (HCl) – об’єм кислоти, який взяли для титрування, мл; V ( NaOH) – об’єм лугу, який пішов на титрування, мл.
