
03. Колігативні властивості розчинів_new хімія
.pdf
КОЛІГАТИВНІ ВЛАСТИВОСТІ РОЗЧИНІВ
1.Розчинність газів у рідинах. Залежність розчинності газів від тиску
(закон ГенріДальтона), природи газу та розчинника, температури.
2.Поняття про колігативні властивості розчинів.
3.Математичний вираз закону Рауля і Вант-Гоффа. Суть ізотонічного коефіцієнту.
4.Закон Вант-Гоффа та його рівняння для неелектролітів та електролітів. Рівняння Галлера.
5.Вплив електролітів на розчинність газів (закон Сєченова).
6.Розчинність газів у крові. Кесонна хвороба.
7.Розчинність рідин та твердих речовин в рідинах. Залежність розчинності від температури, природи розчиненої речовини та розчинника.
8.Розподіл речовини між двома рідинами, що не змішуються. Закон розподілу Нернста та його значення у явищі проникності біологічних мембран.
9.Плазмоліз, гемоліз, тургор. Роль осмосу і осмотичного тиску в біологічних системах.
10.Кріометрія, ебуліометрія, осмометрія та їх застосування.
Розчинність визначається трьома факторами: природою розчинника,
природою розчиненої речовини (агрегатний стан) і зовнішніми умовами
(температура, а для газів і тиск).
Вплив природи розчинника і розчиненої речовини виражається правилом “подібне розчиняється в подібному”. Полярні та іонні сполуки добре розчиняються в полярних розчинниках (вода, спирти, ДМФА), а неполярні
(прості речовини, вуглеводні) – у неполярних (вуглеводні, тетрахлорметан). Так,
галогеноводні (полярні молекули) добре розчинні у воді (полярний розчинник),
але погано розчинні у бензені (неполярний розчинник). З іншого боку, у воді не розчиняються галогенпохідні вуглеводнів (тетрахлорметан, дихлоретан), які добре розчинні у бензені.
Розчинність газів у рідинах
Необхідно враховувати хімічну природу газу і можливість утворення хімічних сполук при взаємодії газу з розчинником. За однакових умов

(температурі і тиску) розчинності у воді азоту і аміаку неоднакові. Насправді,
аміак енергійно взаємодіє з водою, утворюючи амоній гідроксид:
NH3 + H2O = NH4OH,
тоді як молекулярний азот не утворює з водою ніяких сполук. От чому при кімнатній температурі в одному об'ємі води розчиняється всього 0,02 об'єми азоту і приблизно 700 об'ємів аміаку.
1. Розчинність газів при постійному тиску зменшується із зростанням температури. Кип'ятінням розчину можна практично повністю позбавитися
розчинених в рідині газів.
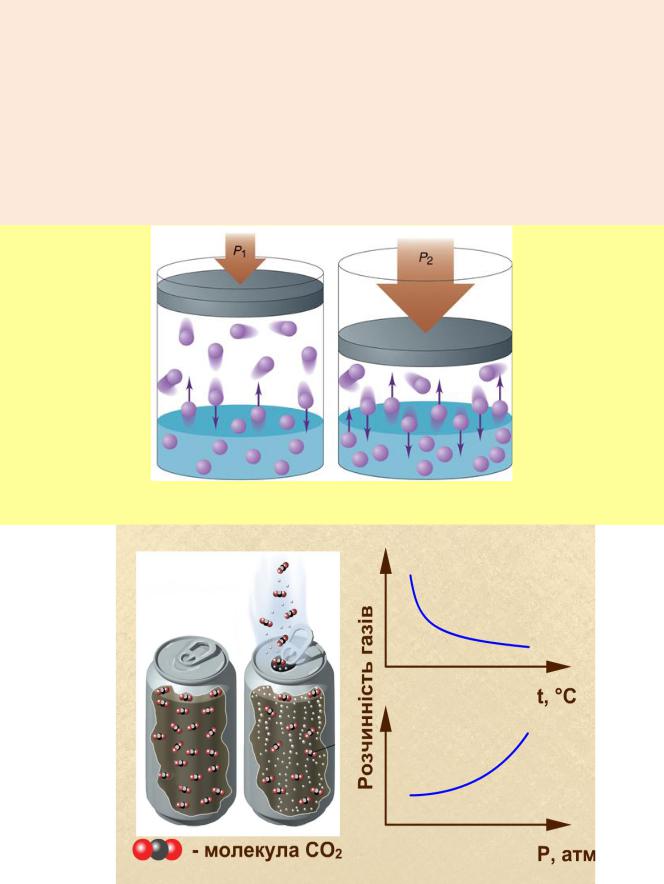
2. Залежність розчинності газу від тиску виражається законом Генрі-
Дальтона: розчинність газу при постійній температурі в рідині прямо пропорційна його парціальному тиску.
m = kp,
де m – маса газу, який розчиняється в 1 л розчинника; р – тиск газу (або парціальний тиск у разі суміші газів); k – коефіцієнт, який характеризує природу компонентів розчину.
Гірська хвороба
Розчинність кисню, вуглекислого газу та азоту має особливе значення для нормального перебігу фізіологічних процесів у живих організмах.

На різниці парціальних тисків кисню та вуглекислого газу в крові і в повітрі ґрунтується газообмін, який здійснюється в основному у легенях.
Так, на певній висоті за умов зниженого тиску виникає гірська хвороба.
При цьому значно зменшується концентрація кисню в крові (кисневе голодування), різко збільшується легенева вентиляція.
Під час зниження атмосферного тиску гази, що містяться всередині організму, розширюються, знижується їх розчинність у рідкому середовищі,
точка кипіння крові та інших рідин знижується до такої міри, що вони можуть закипіти за температури тіла.
У льотчиків, які здійснюють політ у негерметичній кабіні, може виникнути
“висотний метеоризм” (розширення повітря в кишках), біль у вухах, кровотечу з носа через розрив дрібних судин.
На висоту понад 19 км не можна підніматися без надійної герметизації кабіни. У разі розгерметизації космічного корабля настає миттєва смерть унаслідок закипання крові та інших рідин організму, а також через розвиток блискавичної форми гіпоксії.
Кесонна хвороба
При опусканні на глибину внаслідок збільшення тиску концентрація газів у крові збільшується.

При швидкому підніманні водолазів з глибини різке зниження тиску призводить до бурхливого виділення розчинених у крові газів. Утворені бульбашки закупорюють капілярні кровоносні судини (газова емболія),
порушують кровопостачання органів, що може спричинити серйозні функціональні розлади. Тому для попередження кесонної хвороби людину з глибини слід піднімати на поверхню повільно.
В умовах гіпербарії у крові та всіх тканинах організму розчиняється додаткова кількість газів. Азот, який міститься в повітрі спричинює синдром специфічних порушень у осіб, що працюють з підвищеним тиском. Найбільших уражень зазнає нервова система.
Спочатку це виявляється легким збудженням, що нагадує єйфорію
(“глибинне захоплення”), далі настають явища некрозу та інтоксикації. Для уникнення цих явищ в підводні пристрої подають киснево-гелієві суміші.
3. Залежність розчинності газів від наявності у розчині електролітів.
Експериментально доведено, що розчинність газів у розчинах електролітів завжди менша, ніж у чистій воді. Наприклад, якщо в 1 дм3 води за температури 0 °С розчиняється 2,2 дм3 хлору, то у розчині з масовою часткою натрій хлориду
26 % розчиняється його тільки 0,2 дм3, що пояснюється зменшенням кількості
“вільної” води, оскільки частина її витрачається на гідратацію йонів.
Відомо, що всі біологічні рідини, і зокрема кров, є водними розчинами багатьох неорганічних і органічних речовин, тому розчинність у ній кисню,

вуглекислого газу і азоту є меншою, ніж у чистій воді. Так, в 1 дм3 води за температури 37 °С розчиняється 23,7 см3 кисню, а у плазмі крові - 23,0 см3.
Розчинність газів у фізіологічних розчинах і розчинах електролітів вивчав російський фізіолог І. Сєченов. Він довів, що розчинність газів у розчинах електролітів менша, ніж у чистому розчиннику. Цю залежність математично виражають рівнянням
де 5- розчинність газу в розчині електроліту з концентрацією С (моль/дм3); S0 -
розчинність газу у воді; k - константа, яка залежить від температури і природи компонентів розчину; е - основа натуральних логарифмів.
У логарифмічній формі закон Сеченова можна виразити рівнянням
Таким чином, логарифм відношення розчинності газу у чистому розчиннику і розчині електроліту прямо пропорційний концентрації електроліту.
І. Сєченов зауважив також, що зі збільшенням кількості кисню в крові полегшується віддача кров’ю вуглекислого газу, і, навпаки, при збільшенні тиску вуглекислого газу розчинність кисню в крові зростає.
Розчинність різних твердих речовин в одному і тому ж розчиннику може змінюватися в широких межах. При підвищенні температури розчинність більшості твердих речовин збільшується, проте для деяких сполук вона може зменшуватися. Зменшення розчинності з підвищенням температури характерне для речовин, розчинення яких супроводжується виділенням теплоти. Це,
наприклад, Са(ОН)2, гіпс СаSO4∙2Н20. В деяких випадках зменшення розчинності обумовлене зміною характеру твердої фази, яка насичує розчин.
Наприклад, Na2SO4∙10H2O при температурі 32,4°С зневоднюється і
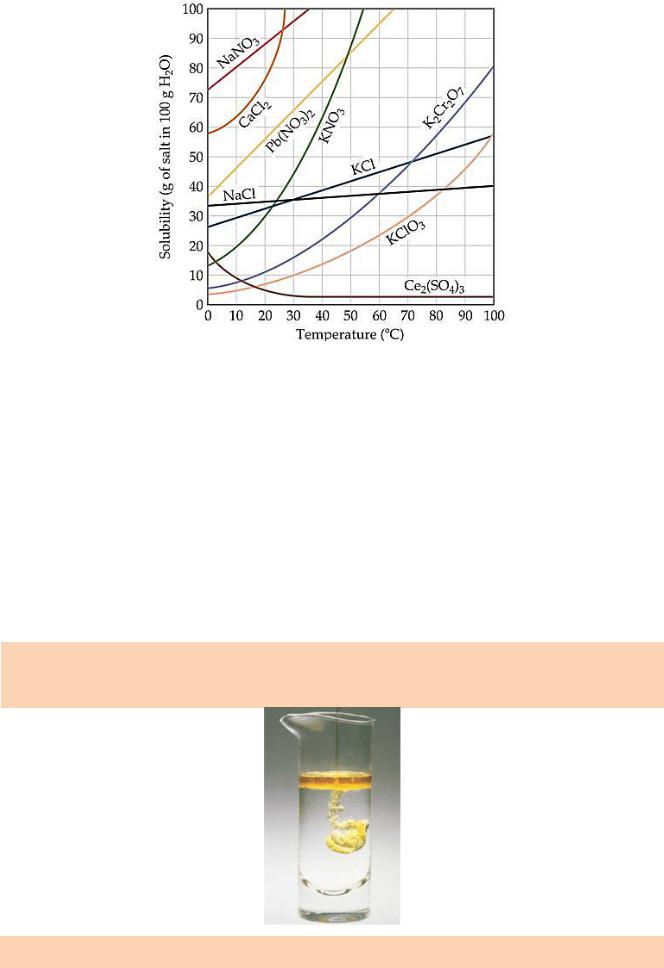
розчинність безводного Na2SO4 зменшується при підвищенні температури.
Рис. Залежність розчинності деяких солей від температури.
Існують таблиці розчинності твердих речовин. На підставі таблиць розчинності можна зробити висновки щодо доцільності очищення від домішок речовин перекристалізацією. Якщо розчинність солі різко змінюється з підвищенням температури (наприклад, розчинність КNО3, при 0°С дорівнює 13,3
г солі на 100 г води, а при 100°С - відповідно 246 г), то вихід солі після її перекристалізації досягає 80-90% від узятої для очистки цим методом кількості речовини.
Розчинність рідин у рідинах.
Рідини одна в одній можуть розчинятися обмежено (олія-вода, ртутьвода)
або необмежено (спирт-вода, толуен-бензен).
Розчинність обмежено розчинних рідин залежить від температури.

При нагріванні взаємна розчинність рідин збільшується і при деякій температурі настає необмежена взаємна розчинність компонентів.
Критична температура розчинення - це температура при якій обмежена розчинність переходить в необмежену.
КОЛІГАТИВНІ ВЛАСТИВОСТІ РОЗЧИНІВ
Вивчення властивостей розбавлених розчинів неелектролітів показало, що їх властивості змінюються прямо пропорційно концентрації розчинів. Це і зрозуміло, оскільки в розбавлених розчинах між молекулами розчиненої речовини немає помітної взаємодії і тому їх властивості залежать тільки від відносного числа частинок речовини і не залежать від природи розчиненої речовини.
Властивості розчинів, які залежать тільки від їх концентрації і не
залежать від природи розчиненої речовини, називаються колігативними.
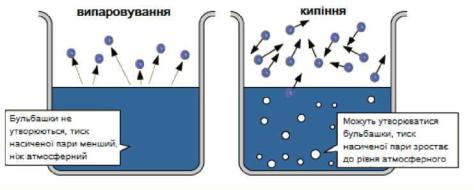
Тиск пари розчинів
Внаслідок випарювання над рідиною утворюється пара, тиск якої можна виміряти за допомогою манометра. Одночасно з ендотермічним процесом випаровування відбувається зворотний екзотермічний процес конденсації, за певних умов між цими процесами встановлюється рівновага:
(Н2O) рідина ↔ (Н2O) пара
Рівноважний стан системи рідина - пара за певної температури характеризується тиском насиченої пари розчинника.
Під час розчинення в рідині будь-якої нелеткої речовини тиск насиченої пари над цією рідиною знижується. Це можна пояснити тим, що концентрація

розчинника в разі утворення розчину зменшується, внаслідок чого рівновага системи рідина - пара порушується. Згідно з принципом Ле Шательє,
розпочинається процес, спрямований на зменшення зовнішнього впливу
(зменшення концентрації розчинника за рахунок введення нелеткої речовини),
тобто відбувається процес конденсації розчинника, що й призводить до зниження тиску насиченої пари над розчином. Отже, тиск пари розчинника над розчином р менший, ніж над чистим розчинником р0.
Розчинена речовина ускладнює випаровування розчинника внаслідок взаємодії молекул речовини і розчинника. Тому при постійній температурі тиск пари над розчином нелеткої речовини менше, ніж над розчинником, за винятком розчинів, в яких речовина є леткою (NН3, НС1).
Зниження тиску пари над розчином тим більше, чим вища концентрація розчину.
Залежність зниження тиску пари розчинів від їх концентрації виражається першим законом Рауля: відносне зниження тиску насиченої пари над
розчином прямо пропорційне мольній частці розчиненої речовини.
Математично цей закон Рауля можна записати так:
де р0 - тиск пари чистого розчинника;
р - тиск пари розчину;
χ- мольна частка розчиненої речовини;
р= р0 - р - зниження тиску пари;
р/р0 - відносне зниження тиску пари над розчином;
З рівняння витікає, що зниження тиску пари не залежить від природи розчиненої речовини, а обумовлено тільки числом його молів в певній кількості розчинника, тобто його концентрацією.
Температура кипіння і температура замерзання розчинів
Температура кипіння і температура замерзання розчинів залежать від тиску пари розчинів. Зниження пари розчину викликає підвищення температури кипіння або зниження температури замерзання розчину порівняно з відповідними температурами для чистого розчинника.
Температура кипіння рідини це температура, за якої тиск її насиченої пари стає таким, що дорівнює зовнішньому тиску. Наприклад вода за нормального атмосферного тиску (101,3 кПа) кипить за температури +100°С. Якщо тиск пари розчинника внаслідок розчинення в ньому речовини знизився, то для досягнення початкового тиску треба підвищити температуру. Отже, температура кипіння розчину вища за температуру кипіння розчинника.
Температурою замерзання рідини є температура, за якої тиск насиченої пари цієї над її рідкою фазою стає таким, що дорівнює тиску пари над її твердою фазою. Наприклад, вода за нормального атмосферного тиску (101,3 кПа) замерзає за температури 0°С. Розглянемо рівновагу рідинатверда фаза (водалід за 0°С):
(Н2O) тв. ↔ (Н2O) рідина
Якщо розчинити у воді невелику кількість певної речовини, то концентрація молекул води в рідкій фазі зменшиться і, згідно з принципом Ле Шательє,
почнеться процес її підвищення - плавлення льоду. Для встановлення нової рівноваги необхідно знизити температуру. Отже, температура кристалізації розчину менша за температуру кристалізації розчинника.
