
- •I. 51.01.01 «Геология и разведка месторождений
- •28 Октября 2005 г., протокол №
- •Предисловие
- •Лекция 1
- •Объекты и содержание минералогии
- •Значение минералов для человека
- •История развития минералогии
- •История развития минералогии в России
- •Лекция 2
- •Минералы в строении вселенной Минералы метеоритов
- •Строение земной коры и минералогическая зональность
- •Химическая связь
- •Кристаллическая структура минералов
- •Лекция 3
- •Полиморфизм и полиморфные модификации
- •Псевдоморфозы (ложные кристаллы)
- •Явление изоморфизма
- •Типы изоморфизма
- •Изоструктурные минералы
- •Твердые растворы
- •Лекция 4
- •Химический состав минералов
- •Химические анализы
- •Расчет формул минералов
- •Расчет формулы сфалерит
- •Расчет формулы граната
- •Причины кристаллизации минералов
- •Аморфные и скрытокристаллические минералы
- •Лекция 5
- •Морфология кристаллов Закон постоянства гранных углов
- •Двойниковые сростки кристаллов
- •Микрорельеф поверхности кристаллов
- •Пирамиды и зоны роста кристаллов
- •Расщепленные кристаллы, скелетные кристаллы и дендриты, метасомы, пойкилосомы
- •Включения в кристаллах
- •Облик и габитус кристаллов
- •Морфология кристаллических агрегатов
- •Лекция 6
- •Физические и химические свойства минералов
- •Анизотропия свойств кристаллов
- •Физические свойства изоморфных смесей
- •Оптические свойства
- •Отражение и преломление света
- •Поляризация и двойное лучепреломление
- •Светопроницаемость (прозрачность)
- •Лекция 7
- •Окраска минералов
- •Собственные окраски минералов Окраска за счет избирательного светопоглощения
- •Анизотропия окраски
- •Игра и переливы цвета
- •Чужеродные окраски
- •Лекция 8
- •Цвет черты
- •Люминесценция
- •Плотность
- •Механические свойства
- •Твердость
- •Спайность, излом
- •Лекция 9
- •Прочность минералов
- •Магнитные свойства минералов
- •Электрические свойства
- •Пьезоэлектричество
- •Пироэлектричество
- •Радиоактивность
- •Лекция 10
- •Определение и описание минералов
- •Макроскопическая идентификация минералов
- •Физические свойства минералов
- •Морфология кристаллов
- •Цвет и черта
- •Твердость
- •Плотность и методы ее определения
- •Лекция 11
- •Спайность, отдельность и излом
- •Прочность
- •Специальные физические тесты
- •Люминесценция
- •Магнетизм
- •Электрические свойства
- •Радиоактивность
- •Минеральные ассоциации
- •Химические тесты при изучении минералов
- •Растворимость
- •Вкус и запах
- •Лекция 12
- •Лабораторные методы определения минералов
- •Устройство микроскопа
- •Оптические методы определения минералов
- •Изучение прозрачности
- •Изучение формы зерен
- •Исследование включений
- •Определение оптического класса
- •Определение показателя преломления
- •Изучение окраски минерала и плеохроизма
- •Определение силы двупреломления
- •Угол погасания
- •Изучение минералов в сходящемся свете
- •Лекция 13
- •Основные методы определения ювелирных минералов
- •Рефрактометр. Определение показателя преломления
- •Полярископ
- •Рефлектометр
- •Определение окраски ювелирных камней
- •Цветной фильтр Челси
- •Дихроизм и дихроскоп
- •Спектроскоп
- •Лекция 14
- •Методы исследования структуры минералов
- •Дифракция рентгеновских лучей
- •Виды дифракционных исследований
- •Порошковый метод рентгенографии
- •Монокристалльный метод рентгенографии
- •Дифракция нейтронов
- •Дифракция электронов и электронный микроскоп
- •Методы исследования химического состава минералов
- •Электронно-зондовый микроанализ
- •Рентгеновский флуоресцентный анализ
- •Лекция 15
- •Генетическая минералогия
- •Среды минералообразования
- •Причины и способы минералообразования
- •Типы минеральных месторождений
- •Лекция 16
- •Эндогенное минералообразование
- •Магматический этап минералообразования (магматические минеральные месторождения)
- •Лекция 17
- •Минеральные ассоциации пегматитов
- •Гидротермальное минералообразование
- •Полезные ископаемые гидротермальных образований
- •Контактово-метасоматическое минералообразования
- •Скарны и грейзены
- •Полезные ископаемые скарнов
- •Полезные ископаемые грейзенов
- •Метаморфическое минералообразование
- •Минеральные ассоциации метаморфизованных месторождений
- •Минеральные ассоциации метаморфических месторождений
- •Лекция 18
- •Экзогенное минералообразование Минералы коры выветривания
- •Минералы осадочных пород
- •Обломочные осадочные месторождения
- •Хемогенные осадочные месторождения
- •Биогенные осадочные месторождения
- •Диагенетическое минералообразование
- •Заключение
- •Литература
- •Дополнительная
- •Оглавление
Собственные окраски минералов Окраска за счет избирательного светопоглощения
При светопоглощении электроны переходят из стационарных (основных, энергетически выгодных позиций) в вакантные (энергетически невыгодные, но потенциально возможные) позиции. Светопоглощение происходит за счет поглощения энергии света при его пропускании кристаллом или отражении. Соответственно, цвет минерала характеризуется спектрами пропускания и отражения. Энергия перехода электрона из стационарной позиции в вакантную обозначается как Еп. Величина перехода электронов у разных минералов разная.
Рассмотрим причины собственных окрасок минералов.
1. Значение величины перехода Еп. Если величина Епбольше энергии света, электроны не будут переходить в другие позиции, т. е. свет не взаимодействует с кристаллом, не отдает ему энергии, минерал оказывается прозрачным и бесцветным (например, алмаз). Если энергия перехода очень мала, что характерно для самородных металлов с «электронным газом», то энергия всех лучей достаточна для выбивания электронов в вакантные позиции, поэтому поглощаются все лучи света и минерал становится черным и непрозрачным. Но электроны тут же возвращаются в исходные позиции, испуская световые лучи, что проявляется металлическим блеском. Цветовые оттенки металлов и многих минералов (полупроводников) возникают из-за энергетической неравнозначности переходов электронов. Могут более сильно поглощаться лучи из той или иной области спектра (например, реальгар, аурипигмент, прустит).
2. Элементы-хромофоры. Наиболее типично проявляется избирательность поглощения света как причина окраски у прозрачных минералов – диэлектриков, в составе которых есть элементы–хромофоры («красители»). Наиболее важными из них являются Ti,V,Cr,Mn,Fe,Co,Ni,Cu. Все эти ионы имеют частично заполненные электронами уровни (dиf). В кристаллической структуре минералов у этих ионов за счет химической связи с соседями появляютсярезко различные по энергетическим характеристикам вакантные позиции,в результате энергия перехода Епдля различных хромофоров и для разных переходов у одного и того же хромофора сильно варьируют. В зависимости от значения Епкристаллом поглощаются разные лучи, происходит избирательное светопоглощение. Минерал окрашивается в цвет дополнительный к поглощенному.
Один и тот же хромофор, например ион Cr3+, в разном окружении, т.е. в соседстве с разными атомами и в разной структурной позиции может вызывать разные цвета. Например, у корунда с примесью хрома в позициях алюминия она рубиновая, у бериллаBe3Al2(Si6O18) с хромом также в позициях алюминия она изумрудная. Однако не все ионы-хромофоры могут быть причиной окраски. Ионы, не имеющие неспаренных электронов:Cr6+,V5+,Cu+,Ce4+и т. д. не могут быть причиной окраски. Здесь вступают в силу другие явления.
3. Явление переноса заряда. Например, минерал крокоит с шестивалентным хромом Pb(CrO4) не имеет неспаренных электронов – теоретически все вакантные позиции заняты у всех ионов (Cr6+,Pb2+,O2+) электронные оболочки заполнены.. Особенностью структуры является наличие комплексного иона (CrO4)2–, который и является красителем – хромофором. После расчета энергетических состояний электронов, находящихся на молекулярной орбитали комплексного аниона, заметили, что происходит некоторое смещение одного электрона от кислорода к хрому за счет поглощения энергии, равной энергии синих лучей. При этом крокоит окрашивается в оранжевый цвет. Это явление называется явлением переноса заряда. Такие же электронные переходы (переносы заряда) служат причиной окраски сапфира. Сапфир – это корунд с изоморфной примесью железа и титана. Возникновение окраски объясняется так: в минерале в позициях алюминия вместо двух его атомов располагаются катионы (парыFe2++Ti4+). За счет переноса заряда (электрона) отFe2+кTi4+происходит поглощение лучей с соответствующей длиной волны и образуется параFe3++Ti3+, а минерал приобретает синий. Еще один пример переноса заряда – минерал вивианит. Идеально чистый вивианитFe32+(PO4)2• 8H2Oбесцветен. При переходеFe2+→Fe3+за счет поглощения части света появляется синяя окраска. Точно также бесцветны минералы двухвалентного марганца. Окраска возникает при изменении его валентности.
4. Электронно-дырочные центры. Еще одна причина неравномерного светопоглощения некоторых минералов – это наличие в их структуре так называемых электронно-дырочных центров. Они являются точечными дефектами структуры. Классическими примерами такой окраски являются окраски флюорита, аметиста, дымчатого кварца, лазурита, топаза, синего галита (рис. 12). Окраска флюорита часто связана со смещениями анионовF–из обычной для них позиции. Каждая такая позиция является ловушкой для электронов. В кварце причиной окраски служит компенсация валентности из-за включений ионовAl3+в позицииSi4+(в морионе) иFe3+в аметисте. Для компенсации валентности в свободные места кристаллической решетки внедряются катионы щелочных металлов или водорода.
Под действием облучения (радиация, гамма-излучение) происходит смещение электрона от кислорода к Al3+(Fe3+)cпоглощением части света; ионыO–становятся центрами окраски. Поэтому окраска некоторых минералов может быть связана с воздействием радиации на протяжении геологической истории их существования.


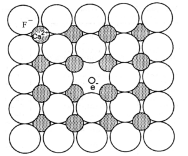
в
Рис. 12Схема идеальной структуры кварца (а) и реальной структуры дымчатого кварца (раухтопаза, мориона) (б). В дымчатом кварце ионы кислорода являются центрами окраски минерала. Схема дефектной структуры флюорита (в), в которой электрон занял место смещенного из узла решетки атома фтора. Каждый такой дефект является центром окраски флюорита (по А. Г. Булаху, 1999).
