
- •I. Основные понятия и законы химии
- •II. Строение атома
- •1. Ядерная модель атома. Строение атома. Состав атомных ядер. Массовое число. Атомный номер. Нуклид. Изотопы. Явление радиоактивности. Воздействие радиоактивного излучения на живую материю.
- •III. Периодический закон и периодическая система элементов д.И.Менделеева
- •IV. Химическая связь и строение вещества
- •Поскольку в этой молекуле оба атома кислорода равноценны (и, следовательно, равноценны обе связи s-o), свойства молекулы лучше передает графическая формула с делокализацией π-связью:
- •5. Ионная и металлическая связь. Механизм образования ионной связи. Степень ионности связи. Ионные кристаллические решетки. Координационное число иона.
- •9. Молекулярное и немолекулярное строение веществ. Молекулярные, атомные и ионные соединения. Графические и структурные формулы веществ. Газообразное и конденсированное состояния веществ.
- •V. Химическая кинетика и термодинамика
- •VI. Растворы
- •VII. Окислительно-восстановительные реакции (овр)
- •Электродвижущая сила (эдс) гальванического элемента
- •1. Оценить окислительно-восстановительные свойства веществ.
- •2. Предсказать принципиальную возможность осуществления реакции в
- •4. Выбрать наиболее вероятную реакцию из нескольких возможных.
- •4.Коррозия металлов. Основные виды коррозии металлов. Методы защиты металлов от коррозии.
- •VIII. Комплексные соединения
- •IX. Водород и элементы группы viia
- •Простые вещества
- •Водород
- •Галогены и их соединения
- •Бинарные соединения галогенов
VII. Окислительно-восстановительные реакции (овр)
1. Основные понятия и определения. Степень окисления как условный заряд атомной частицы в веществе. Диапазон значений степеней окисления. Связь между строением атомов элементов и значениями их степеней окисления. Правила расчёта степеней окисления. Процессы окисления и восстановления. Окислительно-восстановительные реакции. Восстановители и окислители. Зависимость окислительно-восстановительных свойств веществ от значений степеней окисления входящих в их состав атомных частиц. Классификация ОВР. Составление уравнений ОВР. Принцип электронного баланса. Метод полуреакций.
1. с.136-142; 2. с. 255-263; 3. с. 317-326; 4. с. 206-210; 5. с. 85-91; 6. с. 271-272; 8. с. 152-160.
Степень окисления - условный заряд атомной частицы, рассчитанный исходя из предположения, что вещество состоит из ионов.
Степени окисления принимают целочисленные или дробные значения от – 4 до +8 в соответствии с правилами:
1. Степень окисления атомных частиц в простых веществах равна 0;
2. Максимальные значения степеней окисления равны номерам групп за исключением O, F, Cu, Ag, Au, Co, Ni, He, Ne, Ar, Kr и некоторых лантанидов и актинидов.
3. Минимальные значения степеней окисления для металлов всегда равны 0, а для неметаллов (кроме водорода) – разности (№ группы – 8).
Степени окисления других элементов могут иметь переменные значения и рассчитываются, исходя из того, что сумма степеней окисления элементов в молекуле, радикале или в формульной единице равна 0, а в ионе - его заряду.
Окислительно-восстановительными называются реакции, сопровождающиеся изменением степеней окисления атомных частиц, входящих в состав реагирующих веществ.
В ходе любой ОВР одновременно протекают 2 процесса - окисление и восстановление. С точки зрения электронной теории, окисление - процесс отдачи электронов, в ходе которого степень окисления повышается, а восстановление - процесс присоединения электронов, в ходе которого степень окисления понижается.
Атомные частицы, которые в ходе ОВР отдают электроны, называются восстановителями, как и вещества, содержащие такие частицы.
Атомные частицы, присоединяющие электроны, называются окислителями, как и вещества, в состав которых входят эти частицы.
Таким образом, в ходе ОВР восстановитель, отдавая электроны, восстанавливает, но сам окисляется. В то же время окислитель, принимая электроны, окисляет, но сам восстанавливается. При этом общее число электронов, отданных восстановителем, всегда равно общему числу электронов, принятых окислителем.
Окислительно-восстановительные свойства веществ можно определить, исходя из значений степеней окисления элементов, входящих в их состав:
1. Если вещество содержит атомные частицы в минимальной степени окисления, то оно может проявлять только восстановительные свойства.
2. Если в состав вещества входят атомы элемента в максимальной степени окисления, то оно может проявлять только окислительные свойства.
3. Если в состав вещества входят атомы элемента в промежуточной степени окисления, то оно может проявлять как восстановительные, так и окислительные свойства.
Важнейшие восстановители и окислители перечислены на с.87-88 в пособии 5.
Классификация окислительно-восстановительных реакций.
1. ОВР межмолекулярного типа.
а) Если восстановитель и окислитель содержатся в разных исходных веществах, то ОВР относится к реакциям межмолекулярного типа. Например, в реакции
N-3Н3 + КСl+5О3 + KOH → КN+5O3 + КСl-1 + Н2О.
окислитель (Сl+5) и восстановитель (N-3) находятся в разных веществах.
б) Если в ОВР межмолекулярного типа окислителем и восстановителем являются атомы одного и того же элемента, то такие ОВР относятся к реакциям конпропорционирования или конмутации. Например, в реакции
N-3H3 + N+4O2 → N02 + H2O
окислителем и восстановителем являются атомы одного элемента – азота.
2. ОВР внутримолекулярного типа.
а) Если восстановитель и окислитель содержатся в одном и том же исходном веществе, то ОВР относится к реакциям внутримолекулярного типа, например:
(N-3 H4)2Cr+6 2O7 → N0 2 + Cr+3 2O3 + H2O
В данной реакции окислитель (Сr+6 ) и восстановитель (N-3) содержатся в одном веществе.
б) Если в реакциях внутримолекулярного типа окислителем и восстановителем являются атомы одного и того же элемента, то такие ОВР относятся к реакциям диспропорционирования или дисмутации. Например, в реакции
Сl02 + KOH → KCl-1 + KCl+1O3 + H2O
окислителем и восстановителем являются атомы одного элемента – хлора.
Обратите внимание, что реакции конпропорционирования можно рассматривать, как реакции, обратные реакциям диспропорционирования.
Расстановка коэффициентов в уравнениях ОВР.
Наиболее распространёнными методами расстановки коэффициентов являются метод электронного баланса и метод ионно-электронного баланса (метод полуреакций). Они основаны на одном и том же принципе равенства (баланса) общего числа электронов, отданных восстановителем, и принятых окислителем.
Метод электронного баланса заключается в составлении электронных уравнений процессов окисления и восстановления отдельных атомных частиц с последующим уравниванием чисел отданных и принятых электронов. Эти числа определяются по значениям степеней окисления атомных частиц до и после реакции. В электронных уравнениях фигурируют только атомные частицы и электроны независимо от состава и строения реагирующих веществ и от их агрегатного состояния. Поэтому данный метод является универсальным и применим для ОВР с участием веществ в любом агрегатном состоянии.
Обратите внимание на то, что в случае реакций межмолекулярного типа расстановка коэффициентов проводится слева направо, а в случае реакций внутримолекулярного типа - справа налево.
Пример.
Расставить коэффициенты методом электронного баланса в уравнении ОВР:
![]()
Определяем значения степеней окисления атомных частиц до и после реакции и находим элементы, у атомов которых изменились степени окисления.
Определяем тип ОВР, записываем электронные уравнения процессов окисления и восстановления, составляем схему электронного баланса.
Поскольку
атомные частицы
![]() ,
изменившие степени окисления, содержатся
в разных
веществах, то данная ОВР относится к
реакциям межмолекулярного типа. В таком
случае расстановку коэффициентов
проводим «слева направо». Это
значит, что в электронных уравнениях
число атомных частиц каждого элемента
равно их числу в формулах исходных
веществ.
Записываем электронные уравнения,
находим наименьшее общее кратное чисел
отданных и принятых электронов и
составляем схему электронного баланса:
,
изменившие степени окисления, содержатся
в разных
веществах, то данная ОВР относится к
реакциям межмолекулярного типа. В таком
случае расстановку коэффициентов
проводим «слева направо». Это
значит, что в электронных уравнениях
число атомных частиц каждого элемента
равно их числу в формулах исходных
веществ.
Записываем электронные уравнения,
находим наименьшее общее кратное чисел
отданных и принятых электронов и
составляем схему электронного баланса:
3

![]() -
3e-
= 3
-
3e-
= 3![]() 3 × 2 (процесс окисления);
3 × 2 (процесс окисления);
2![]() + 6e-
= 2
+ 6e-
= 2![]() 6 × 1 (процесс восстановления).
6 × 1 (процесс восстановления).
Находим числа атомных частиц, изменивших степени окисления. Для этого коэффициенты в первом уравнении умножаем на 2, а во втором – на 1. Получаем, что число атомных частиц иода равно 6, а хрома – 2.
Расставляем коэффициенты в уравнении ОВР.
Проверяем, одинаковы ли числа атомов каждого элемента в обеих частях уравнения:
![]()
2. Количественные характеристики ОВР. Электрохимический ряд напряжений металлов. Гальванический элемент. Направление движения электронов и ионов в гальваническом элементе. ЭДС гальванического элемента. Таблица окислительно-восстанови-тельных потенциалов и правила пользования ею. Направление протекания ОВР. Выбор окислителя и восстановителя.
1. с. 142-154; 2. с. 263-283; 3. с. 326-350; 4. с. 210-216; 5. с. 91-102; 6. с. 272-284; 8. с. 160-168.
Двойной электрический слой возникает у поверхности металла при погружении его в воду или в водный раствор соли этого металла. Если металл погрузить в воду, то между его поверхностью и раствором устанавливается равновесие:
Me0(тв) + xH2O ↔ Men+∙ xH2O + ne-.
Рис.2.
Схема
образования двойного электрического
слоя при погружении металла в воду
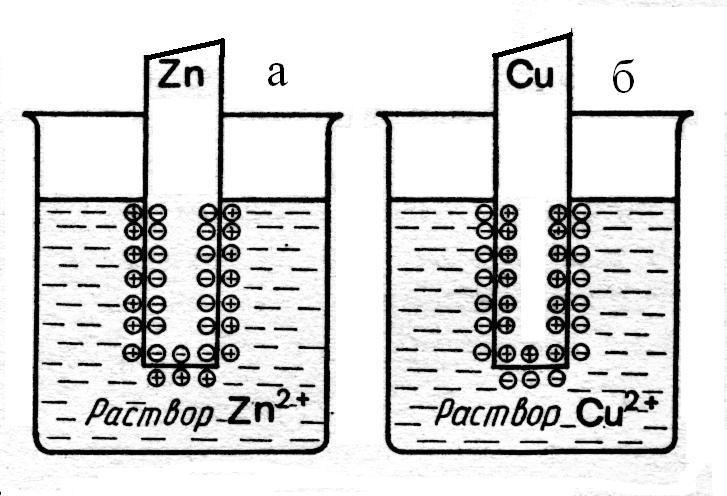
Рис.3.
Схема
образования двойного электрического
слоя при погружении металла в раствор
его соли
а– активный металл
б- малоактивный металл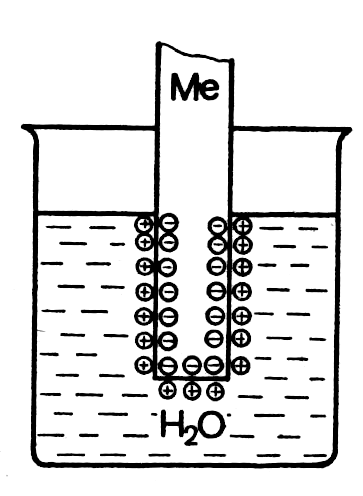
 Электроны,
остающиеся на поверхности металла,
сообщают ему некоторый отрицательный
заряд (потенциал). Катионы переходят в
раствор и удерживаются у поверхности
металла силами электростатического
притяжения. (Рис.2). Между отрицательно
заряженной поверхностью металла и
тонким слоем раствора, заряженным
положительно, возникает разность
потенциалов, называемаяскачком
потенциала или электродным потенциалом
Е. Пластинка
металла и его гидратированные катионы
вместе составляют единую
окислительно-восстановительную
систему, характеризующуюся определённым
электродным потенциалом, величина
которого зависит от природы металла,
концентрации его ионов в растворе, от
температуры и значения рН среды.
Электроны,
остающиеся на поверхности металла,
сообщают ему некоторый отрицательный
заряд (потенциал). Катионы переходят в
раствор и удерживаются у поверхности
металла силами электростатического
притяжения. (Рис.2). Между отрицательно
заряженной поверхностью металла и
тонким слоем раствора, заряженным
положительно, возникает разность
потенциалов, называемаяскачком
потенциала или электродным потенциалом
Е. Пластинка
металла и его гидратированные катионы
вместе составляют единую
окислительно-восстановительную
систему, характеризующуюся определённым
электродным потенциалом, величина
которого зависит от природы металла,
концентрации его ионов в растворе, от
температуры и значения рН среды.
При погружении металла в раствор его соли двойной электрический слой образуется по двум различным механизмам. В случае, если металл активный (расположен в ряду активности левее меди) (Рис. 3а), то скачок потенциала возникает так же, как при погружении металла в чистую воду. Если же металл малоактивный (расположен в ряду активности правее меди) (Рис.3б), то на его поверхности обратимо сорбируются катионы из раствора, вследствие чего поверхность металла приобретает положительный заряд. Анионы соли удерживаются у поверхности металла силами электростатического притяжения. И в данном случае между поверхностью металла и тонким слоем раствора так же возникает разность потенциалов.
Ряд стандартных электродных потенциалов металлов – ряд металлов, расположенных в порядке возрастания значений Ео полуреакций:
Men+ + ne- = Me0
в водных растворах при стандартных условиях (Т = 298 К, с(Меn+)= 1 моль/дм3).
Возрастание значений Е0 приводит к тому, что в этом ряду слева направо:
Восстановительные свойства простых веществ-металлов в водных растворах при стандартных условиях ослабевают. Поэтому самыми сильными восстановительными свойствами в указанных условиях обладает металл литий, а самыми слабыми – металл золото. В соответствии с этим металл, расположенный в данном ряду левее, может вытеснять при стандартных условиях металлы, расположенные правее, из водных растворов их солей. Необходимо помнить, что щёлочные и щёлочноземельные металлы в этих реакциях реагируют и с водой, что приводит к образованию побочных продуктов. Кроме того, металлы, расположенные в ряду стандартных электродных потенциалов левее Н, могут вытеснять водород из водных растворов кислот-неокислителей (Н2SO4, HCl, HBr, HI, Н3РО4).
Окислительные свойства гидратированных катионов металлов при стандартных условиях усиливаются. Поэтому самыми слабыми окислительными свойствами в водных растворах обладают катионы лития, а самыми сильными – катионы платины. В соответствии с этим, при электролизе водных растворов, содержащих смесь катионов металлов, на катоде в первую очередь восстанавливается правее стоящий металл.
Запомните, что положение металла в электрохимическом ряду определяет возможность протекания реакций с участием данного металла или его ионов только в водных растворах при стандартных условиях
Г
Рис.5
Схема
медно-цинкового гальванического
элемента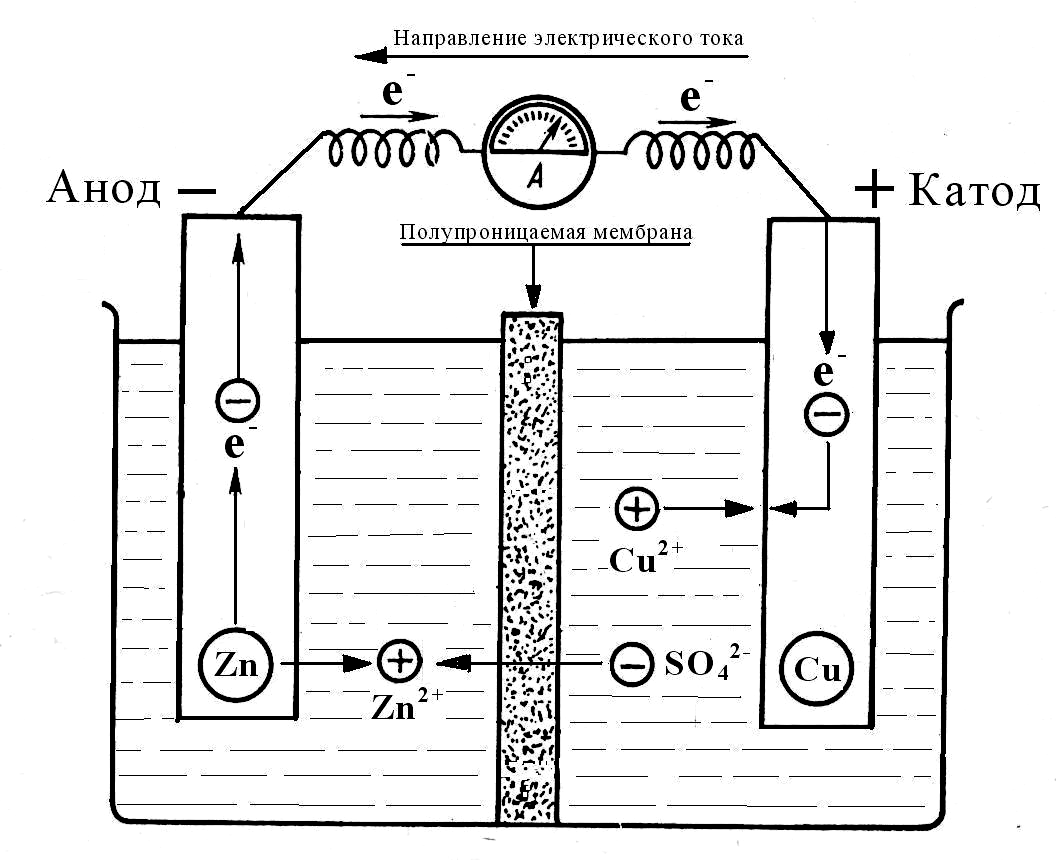
При функционировании гальванического элемента электроны движутся по внешней цепи в направлении от анода к катоду. Ионы движутся по внутренней цепи (через полупроницаемую мембрану) в противоположном направлени.
