
- •I. Основные понятия и законы химии
- •II. Строение атома
- •1. Ядерная модель атома. Строение атома. Состав атомных ядер. Массовое число. Атомный номер. Нуклид. Изотопы. Явление радиоактивности. Воздействие радиоактивного излучения на живую материю.
- •III. Периодический закон и периодическая система элементов д.И.Менделеева
- •IV. Химическая связь и строение вещества
- •Поскольку в этой молекуле оба атома кислорода равноценны (и, следовательно, равноценны обе связи s-o), свойства молекулы лучше передает графическая формула с делокализацией π-связью:
- •5. Ионная и металлическая связь. Механизм образования ионной связи. Степень ионности связи. Ионные кристаллические решетки. Координационное число иона.
- •9. Молекулярное и немолекулярное строение веществ. Молекулярные, атомные и ионные соединения. Графические и структурные формулы веществ. Газообразное и конденсированное состояния веществ.
- •V. Химическая кинетика и термодинамика
- •VI. Растворы
- •VII. Окислительно-восстановительные реакции (овр)
- •Электродвижущая сила (эдс) гальванического элемента
- •1. Оценить окислительно-восстановительные свойства веществ.
- •2. Предсказать принципиальную возможность осуществления реакции в
- •4. Выбрать наиболее вероятную реакцию из нескольких возможных.
- •4.Коррозия металлов. Основные виды коррозии металлов. Методы защиты металлов от коррозии.
- •VIII. Комплексные соединения
- •IX. Водород и элементы группы viia
- •Простые вещества
- •Водород
- •Галогены и их соединения
- •Бинарные соединения галогенов
Электродвижущая сила (эдс) гальванического элемента
Причиной возникновения электрического тока в гальваническом элементе является разность электродных потенциалов двух окислительно-восстановительных систем. Эту разность обозначают символом ∆Е и называют электродвижущей силой (ЭДС) гальванического элемента. Поскольку ЭДС - величина положительная, её находят кАк разность между большим (катод) и меньшим (анод) значениями электродных потенциалов:
∆Е = Е(катода) – Е(анода).
Таблица стандартных окислительно-восстановительных потенциалов
Чаще всего в таких таблицах полуреакции восстановления приводятся не в порядке увеличения значений Ео, а группируются по признаку содержания в них определённых элементов, например, соединения азота, марганца, хрома и т.д. Обратите внимание на следующее. В таблице, в соответствии с рекомендациями ИЮПАК, все полуреакции записаны в виде процессов восстановления, хотя в ходе любой ОВР полуреакция восстановления всегда сочетается с полуреакцией окисления. Запомните, что из двух полуреакций восстановления слева направо всегда протекает полуреакция с бóльшим значением Ео. Другая полуреакция с меньшим значением Ео всегда протекает в обратном направлении и является фактически полуреакцией окисления. Поэтому при составлении уравнений ОВР полуреакцию с меньшим значением Ео нужно «превратить» в полуреакцию окисления. Для этого в соответствующем уравнении необходимо поменять местами окисленную и восстановленную формы, оставив электроны в левой части, но перед их числом изменить знак с «плюса» на «минус». Учтите, что при этом знак электродного потенциала не меняется!
Используя значения электродных или окислительно-восстановительных потенциалов полуреакций, можно выполнить следующие операции:
1. Оценить окислительно-восстановительные свойства веществ.
Из нескольких веществ более сильными восстановительными свойствами обладает то вещество, которому соответствует полуреакция с более низким значением потенциала. И наоборот: более сильными окислительными свойствами обладает то вещество, которому соответствует полуреакция с более высоким значением потенциала.
2. Предсказать принципиальную возможность осуществления реакции в
указанном направлении.
Протекание окислительно-восстановительной реакции в данном направлении возможно лишь тогда, когда потенциал полуреакции с участием используемого окислителя будет больше потенциала полуреакции с участием используемого восстановителя.
3. Определить направление протекания реакции.
Любая ОВР всегда протекает в том направлении, в котором осуществляется полуреакциия с более высоким значением потенциала. Этому направлению соответствует положительное значение ЭДС реакции. Однако необходимо помнить, что в данном направлении реакция протекает практически необратимо при ЭДС, большей либо равной 0,4 В. Если же разность потенциалов оказывается меньше 0,4 В, то ОВР протекает обратимо и направление реакции определяется условиями ее проведения.
4. Выбрать наиболее вероятную реакцию из нескольких возможных.
Из всех возможных ОВР наиболее вероятной будет та реакция, которой соответствует максимальное значение (ЭДС).
3. Окислительно-восстановительные процессы с участием электрического тока. Электролиз расплавов и водных растворов электролитов. Электролиз с инертными и активными электродами. Схемы процессов на электродах. Получение неорганических веществ и их очистка при помощи электрического тока. Химические источники тока.
1. с. 155-159; 2. с. 285-295; 3. с. 350-358; 4. с. 236; 6. с. 285-287.
Э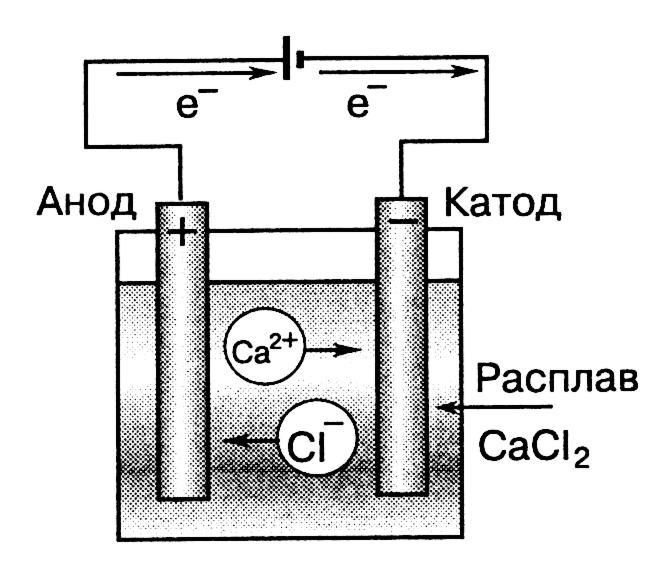 лектролиз
– электрохимический
окислительно-восстановительный процесс,
протекающий на электродах при прохождении
постоянного электрического тока через
расплавы или растворы электролитов.
лектролиз
– электрохимический
окислительно-восстановительный процесс,
протекающий на электродах при прохождении
постоянного электрического тока через
расплавы или растворы электролитов.
При электролизе энергия электрического тока превращается в химическую энергию и при этом осуществляется процесс, обратный происходящему в гальваническом элементе.
О
Рис.5.
Схема
процесса электролиза расплава хлорида
кальция
Катод – отрицательно заряженный электрод, соединённый с отрицательным полюсом источника тока. Катод при электролизе является восстановителем. На его поверхности протекают процессы катодного восстановления. Катод всегда изготавливается из инертных материалов (графит, платина, золото, иридий и др.)
Анод – положительно заряженный электрод, который при электролизе является окислителем. На его поверхности всегда протекают процессы анодного окисления. Анод может быть изготовлен как из инертных материалов («инертный» или «нерастворимый» анод), так и из металлов, способных в ходе электролиза переходить в раствор («растворимый анод»).
При пропускании электрического тока через расплав или раствор электролита содержащиеся в нём ионы принимают направленное движение: положительно заряженные катионы направляются к отрицательно заряженному катоду, а отрицательно заряженные анионы – к положительно заряженному катоду (Рис. 6).
Процессы на катоде.
В расплавах электролитов на катоде всегда происходит восстановление катионов металлов по схеме: Меn+ + ne- = Me0 .
В водных растворах электролитов характер процессов на катоде определяется природой катионов:
а) катионы H+ : 2Н+ + 2е- = Н2.
б) катионы [Li+ – Al3+ ] и катионы NH4+: 2Н2О + 2е- = Н2 + 2ОН-.
в) катионы [Bi3+ – Au3+]: Меn+ + ne- = Me0 .
г) катионы [Mn2+ – Pb2+]: одновременно восстанавливаются катионы металлов и молекулы воды.
Процессы на инертном аноде.
В расплавах электролитов.
а) анионы ОН-: 4ОН- - 4е- = О2 + 2Н2О;
б) галогенид-анионы: 2Гал- -2е- = Гал20;
в) сульфид- и селенид-анионы: Э2- - 2е- = Э0;
В водных растворах электролитов.
а) анионы ОН-: 4ОН- - 4е- = О2 + 2Н2О;
б) анионы Гал- кроме F-: 2Гал- -2е- = Гал20;
в) сульфид- и селенид-анионы: Э2- - 2е- = Э0;
г) анионы кислородсодержащих неорганических кислот и анионы F-:
2H2O – 4e- = O2 + 4H+
д) анионы карбоновых кислот: 2RCOO- -2e- = R2 + 2CO2.
При электролизе с растворимым анодом происходит его окисление по схеме:
Ме0 – ne- = Men+.
Образующиеся при этом катионы переходят в раствор и восстанавливаются на катоде. Таким образом, электролиз с растворимым анодом заключается в переносе металла с анода на катод.
Пример.
С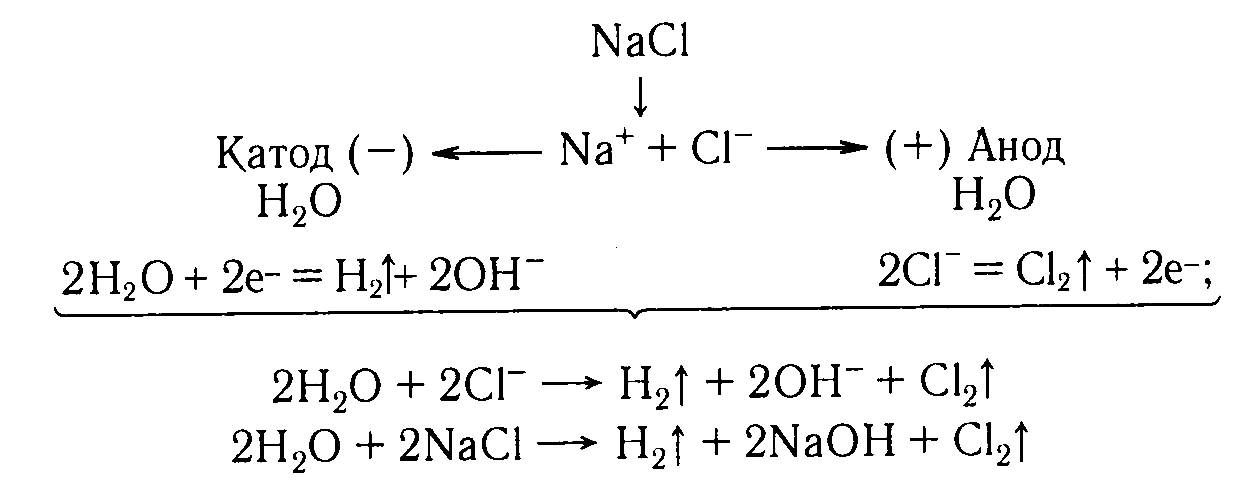 оставим
схемы процессов, протекающих на электродах
при электролизе раствора хлорида натрия
и общее уравнение процесса.
оставим
схемы процессов, протекающих на электродах
при электролизе раствора хлорида натрия
и общее уравнение процесса.
П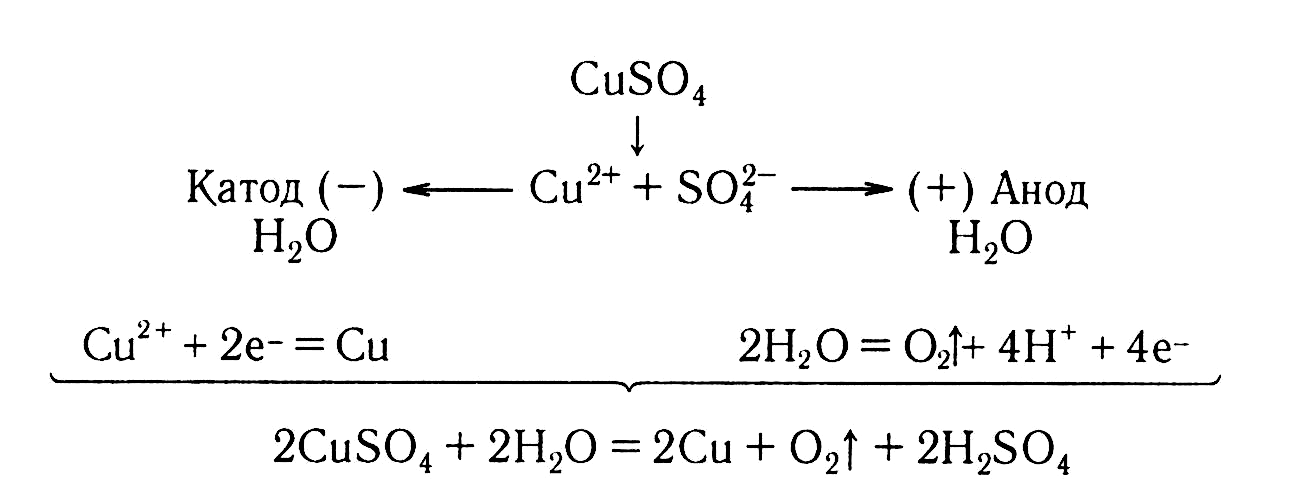 ример.
Составим схемы процессов, протекающих
на электродах при электролизе раствора
сульфата меди(II) и общее уравнение
процесса.
ример.
Составим схемы процессов, протекающих
на электродах при электролизе раствора
сульфата меди(II) и общее уравнение
процесса.
Пример. Составим схемы процессов, протекающих на электродах при электролизе раствора сульфата калия и общее уравнение процесса.
