
07 окт 2013
.docxЛекция по химии 07.10.13
Гидролиз солей
Гидролиз-р-ция, обратная рции диссоциации.
Соли,образ слабым основанием и сильной кислотой,гидролизуются по катиону
Соли образованные сильным основанием и сильной ктой
Если соли не растворимы,то они не гидролизуются.
Гидролиз солей
Ка+Ан+H2O-------kat(h20)h+An(h2o)
Водород в молекуле воды в таком сединения имеет свободную орбиталь, возникает химическая связь,подобная водородной.
-
Гидролиз по катиону.
Катионы маленького радиуса и большого заряда обладаю сильным гидролизующим действием, они оттяг на себя электроны… заряд уменьшается на 1. И образуется гидроксоний-катион.
pH<7------среда кислая. Рис 1
-
Гидролиз по аниону.
-
Анионы слабых кислот являются хорошим донором, они отдают 1 пару элекронов.
Гидролиз можно записать как
Рис 2.
Глубина гидролиза зависит от природы соли и от ее концентрации.
Закон действующих масс:
Формула 1.
Степень гидролиза
Форм 2.
Наиболее сильно гидролиз соли образованиы и слаб онованием и слаб кислотой.
pH=7+0,5(pKb-pKa)
если более слабым являются кта например, цианид аммония,то среда будет слабо щелочная.
Особый случай-ступенчатый гидролиз
Наприм соли аляминия-соли слабого основания. Гидролиз захватывает только 1 спупень, но можно довести реакция до оксида аляминия(2)
Рис 3
Гидролиз по аниону может так же быть ступенчатым, так анионы могут
Рис 4
Необратимый гидролиз.
В таблице растворимости солей около таких веществ стоит прочерк(в растворе не существует) гидролиз большинства солей- процесс обратимый и им можно управлять в соответствии с принципами ле шателье, добавление воды, то бишь растворение раствора усиливает гидролиз, значит, чтобы вво не гидролизовалось,нужно хранить в концентрации виде.
Если мы хотим подавить гидролиз, добавление хролной кты подавляет гидролиз.
Нагревание способст эндотермическому рру , поэтому такие рры нужно хранить в холодильнике.
Гидролиз-реакция необратимого разложения водой.
Рис 5
Взаимодействие ионов соли,приводящее к появлению слабого электролита называется гидролизом соли.
Буферные растворы
Буфер-мешает резкому изменению. Есть системы, поддерживает постоянство.в организме есть системы, поддерживающие постоянство.
Кислотно-основные буферные рры поддерживают постоянной значение pH. Буферные рры содержатсопряж катионы и наионы, мы имеем дело с сопряженным протолотическим равновесием.
Слабые кты диссоцииhe.n?f его ион подвергается гидролизу.
В качестве примера рассмотрим ацетатные буфер- укск=усная кта и соль ацетата натрия. Как влияет одноименный ион на диссоциацию кты.
Одноименный ион подавл диссоциации уксусной кты.
Форм 3
pH зависит от природы кты, и от соотношений концентрации соли и кты.
Ch3cooh по справочным таблицам имеет значение Ka=1,76*10-5
рКа=-lg1.,диапозон при котором работае ацетатно-буферная система- 3,76-5,76.
Буферные система основного типа сожержат основание и соли аммония.
Форм 4
Механим работы буферной система:
Буферные сит=стемы-не измен pH при добавлении небольших количеств кислоты или щелочи, при разбавлении водой.
Каждая буферная система облад своей буферной емкостью.
Буферная емкость:
-
По кислоте показывает сколько моль сильной кислоты надо добавит к 1 л буферного раствора чтобы изменит pH на 1.
-
По основанию показывает сколько моль сильной щелочи надо добавить к 1 л раствора чтобы изменить pH на 1.
Максимальная буферная емкость по щелочи =90% от концентрации донора протона.
Буферная емкость зависит от концентрации компонентов, от соотношения компонентов. Буферная емкость маскимальна,когда соотношение кислоты и основания 1 к 1.
В нашем организме существуют буферные системы, например буферные системы крови:
В плазме крови основной буферной систеой ыявляется гидрокарбонатная буферная система,она состоит из угольной кислоты и гидрокарботат аниона.
Катионы Н взайм с угольной кислотой,получающие со2, который выводится через легкие.
pH=6+lg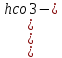
внутри клетки работает фосфантый буфер,он состоит из гидро идигидрофосфатов.
Соотношение акцептора и донора-4:1
В крови работает и белковый буфер(протеин) белок-соль.
В кислой среде присоед протон и образ белок-кислота. А в щелочной среде-белок основание.
При pH крови существует белок-соль и белок-основание.
Характеристики кислотно-основного состояния крови:
-
pH плазмы крови лежит в пределах 7,35-7,45
-
парциальное давление co2-45 мм рт ст
-
содержание гидрокарбоната- 24,4ммоль на литр.
-
Избыток или дефицит буферных оснований в крови-42 ммоль на литр.
Смещение равновесия в сторону кислоты называется ацидоз, а в сторону щелочи-алкадоз.
Наример пр остановке дыхания co2 не выводится из организма, поэтому развивается закисление.
Алкалоз-выводится с рвотными массами, защелачивание.
гемоглобиновая система.
Н-гемоглобин присоед кислород переходит в оксигемоглобин.
Форм 6
В крови всегда больше акцепторов протонов, чем доноров.
Если же организм исчерпал свои системы, то для ликвидации использовали внутреннее гидрокарбоната, а сейчас вводят трисомин.
Внутривенной вливание аскорбиновой кислоты(витамина С)
При лечении мочекаменной болезни, вызванных образ мочекаменных камней, используется препарат-цитратный буфер, и даже большие камни растворяются, опасность его в том, что это опасно-смещать кислотно-основное равновесие)
