
23 сент 2013
.docxЛекция по химии 23.09.13
Зависимость скорости от катализатора.
Самым эффективным катализатором является фермент.
В чем причина изменения скорости катализатора.
1.Фермент увеличивает скорость реакции, потому что снижает энергию активации.
Например,гидролиз мочевины. Уреаза снижает энергию активации в 1013 раз.
2.фермент всегда специфичен, фермент амилаза может расщеплять крахмал, но не может расщеплять клетчатку.
Для определения зависимости эфективного катализа от катализатора.(форм1 )
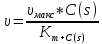 уравнене Михаэлиса
уравнене Михаэлиса
 Рис
1.
Рис
1.
 n=0 υ=υmaxX
n=0 υ=υmaxX

Есть такое понятие для ферментов- молекулярная активность,определяется действие субстрата, превращающаяся от 1 молекулы фермента в минуту.самый активный- карбоангидраза,который вызывает декарбоксилирование карбоновых кислот.
3.ферменты могут быть использованы в качестве лекарственных веществ.(мезим)-приводящие к быстрому гидролизу белков.
Реакции бывают сложными:
-
Обратимые-химическое равновесие
-
Термомидинамическое
ΔG=0
ΔG=ΔH-TΔS
ΔH=T*ΔS
-
Кинетическое
υпрям р-ции=υобр р-ции
Рассмотрим гомогенную обратимую реакцию.
υпрям р-ции=k1[A]a [B]b
Закон действующих масс для химического равновесия. константа химичского равновесия связана с величиной уравнения Гиббса.
Kравн=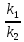 =
=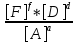
ΔG=-RTln(kравн)
ΔG<0; k>1;
ΔG>0; k<1;
ΔG=0; k=1;
Состояние химического равновесия-наиболее лучшая форма системы и при неизменных внешних условиях сохраняется сколько угодно долго. Если мы изменим любое условие(конц, температура, давл)то равенство нарушается. В первой половине 19 века установлен принцип Ле-Шателье:
Если на систему, находящуюся в равновесии оказывается внешнее воздействие, то это воздействие благоприятствует той реакции, которая уменьшает внешнее воздействие.
ln =
=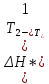 изобара Вант-Гоффа
изобара Вант-Гоффа
Нагревание в большей степень способствует эндотермической реакции и наоборот.
Изменения объема влияет только на реакции, связанных с давление и объемом.
Приложение закона действующих масс с гомогенной и гетерогенной реакции: всегда помним! Выражение закона действующих масс твердая фаза не входит.
закон действующих масс может быть приведен в электрохимию.
Растворение труднорастворимых электролитов.
-
Параллельные
-
Последовательные(вещество А дает вещество Х, и П)-фармакинетика, например, вещество попадает в желудок, потом в кровь, затем в мочу
Тема: «растворы коллегативные. Свойства растворов электролитов и неэлекролитов.»
Понятийные растворы-
-
истинные растворы
-
Коллоидные растворы
-
Золи
истинные растворы-устойчивая система гомогенного состава,состоящая из 2 и более компонентов, между которыми существуют достаточно сильные взаимодействи. Растворы представляют для медицины интерес, так как цитоплазма-кровь,лимфа,моча являются водными растворами белков,углеводов, липидоа.
Организм человека состоит на 60% из воды, а его имбрион на 90%
Вода не только среда,но и участник процессов жизнедеятельности. Если человек теряет 20% воды-наступает гибель.
Потребность воды- 35г воды на 1 кг массы тела.
-
Вода-вещество уникальное, обладает интересными аномалиями(теплоемкость 75,3Дж/к-она медленно остывает и медленно нагревается).там где воды много,там климат очень мягкий, там где воды нет-резкое изменение температур в ночное и дневное время.
-
у воды аномально высокая энергия ионизации.
-
Плотность воды в жидком состоянии выще чем у твердого состояния.
-
Процессы растворения
ΔGраств=ΔHраств-Т*ΔSраств
с повышением температуры реакция увеличивается. Таким образом, процесс растворения является сложным процессом, это зависит от природы, от температуры и от давления. Еще древние заметили: подобное растворяется в подобном.
При обычных условиях вода может находиться в 3 агрегатных состояниях.
Диаграмма состояния воды
Самая устойчивая является жидкая фаза.
Чем выше давление, тем будет выше температура кипения и плавления.
Правило фаз гипстера.:число степеней свободы=число компонентов-фаза +2
4.60С-точка,в которой находятся в равновесии вода во всех агрегатных состояниях.
КОЛЛЕГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ.
Свойства,не зависящие от свойств вещесв, а зависит от концентрации: диффузия,осмотическое давление, понижение давления насыщенного пара над раствором, понижение температуры замерзания и кипения раствора по сравнению с чистым растворителем.
-
ДИФФУЗИЯ-самопроизвольный процесс переноса частиц растворенного вещества и растворителя,который осуществл при наличии гредиента коц и приводит к выравн конц вва
Причиной явл 1 закон термодин.
Градиент=отн дельта С к дельта Х.
Диффузия имеет большое значение для биолог и медицины-перемещение питательных веществ и тканевой жидкости происходит благодаря диффузии.
В медицина использует в аппарате искусственная почка.
Если 2 раствора разной концентрации разделены полупроницаемой перегородкой, тогда будет наблюдаться осмос(проницаема для молекул растворителя, но не проницаема для молекул растворенного вещества.
Осмос-процесс односторонне диффузии молекул растворителя из разбавленного раствора на выравнивание концентрации. Столб жидкости давит на мембрану и приостанавливает осмос.
Форм 14
Pгидр=Pосм=ρgh
Вант гофф сравнил закон осмоса с законом идеального газа:форм 15


Метод определение молярных масс веществв на основе осмоса, называется осмометрия.
Осмос-одно из основных процессов доставки воды в клетку.
Осмотическое давление крови составляет 1,4-1,7 атм. Такая среда называ изотонической, примерно 0,9% раствор поваренной соли.
Осмотическое давление крови обосновано в основном за счет ионов. Часть осмотического давления носит название «?»
