
Химия экзамен - копия
.pdf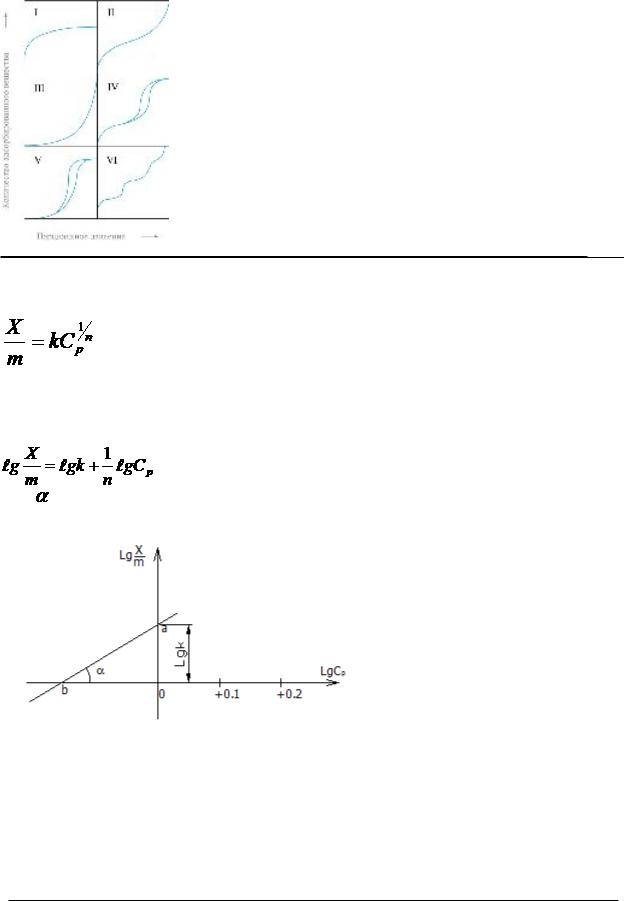
изотерма адсорбции - зависимость количества адсорбированного вещества (величины адсорбции) от парциального давления этого вещества в газовой фазе (или концентрации раствора) при постоянной температуре.
26.
Адсорбция на границе твердое телораствор Уравнение Фрейндлиха:
Где Х — количество адсорбированного вещества, m — навеска адсорбента,
Сp - концентрация вещества в растворе после установленного равновесия K и 1/n коэффициенты
Угол представляет величину 1/n , а отрезок отсекаемый прямой на оси ординат соответствует логарифму k.
Уравнение Фрейндлиха применимо для адсорбции недиссоциирующих или слабодиссоциирующих веществ, когда вещество адсорбируется молекулярно. Молекулярная адсорбция зависит от природы растворенного вещества, строения, природы поверхности адсорбента и природы растворителя. Молекулярная адсорбция обратима и всегда понижается с увеличением температуры.
Хроматография— динамический сорбционный метод разделения и анализа смесей веществ, а также изучения физико-химических свойств веществ. Основан на распределении веществ между двумя фазами — неподвижной (твердая фаза или жидкость, связанная на инертном носителе) и подвижной (газовая или жидкая фаза, элюент)

27.
Коллоидными растворами называются гетерогенные дисперсные системы, в которых частицы «растворенного» вещества обладают ультрамикроскопической (коллоидной) степенью дробления. Поперечник частиц дисперсной фазы в этих системах лежит в пределах 1 -100 нм. Мицеллы (уменьшительное от лат. mica - частица, крупинка) — частицы в коллоидных системах, состоят из нерастворимого в данной среде ядра очень малого размера, окруженного стабилизирующей оболочкой адсорбированных ионов и молекул растворителя. Например, мицелла сульфида мышьяка имеет строение:
{(As2S3)m•nHS−•(n-x)H+}x-•хН+
К мицеллам относят также частицы в растворах поверхностно-активных веществ (ПАВ), называемых лиофильными коллоидами. Например, мицеллы додецилсульфата в воде. Коллоидные ПАВ - ПАВ, молекулы которых образуют мицеллы, а растворы обладают моющим действием.
28.
Выражается в следующем: электрический ток, проходя через живой организм, производит термическое (тепловое) действие, которое выражается в ожогах отдельных участков тела, нагреве кровеносных сосудов, крови, нервных волокон и т.п.; электролитическое (биохимическое) действие - выражается в разложении крови и других органических жидкостей, вызывая значительные нарушения их физико-химических составов; биологическое (механическое) действие - выражается в раздражении и возбуждении живых тканей организма, сопровождается непроизвольным судорожным сокращением мышц (в том числе сердца, легких).
Электрический ток есть упорядоченное перемещение заряженных частиц. Растворы электролитов обладают ионной проводимостью (являются т.н. проводниками второго рода), т.е. электропроводность растворов электролитов обусловлена перемещением ионов в электрическом поле (в отличие от электронной проводимости проводников первого рода).
В качестве количественной меры способности раствора электролита проводить электрический ток используют обычно удельную электропроводность κ (каппа) – величину, обратную удельному сопротивлению (т.е. величину, обратную сопротивлению столба раствора между электродами площадью 1 см2, находящимися на расстоянии 1 см):
Молярная электропроводность раствора λ есть величина, обратная сопротивлению раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга. С удельной электропроводностью κ и молярной концентрацией раствора С молярная электропроводность связана следующим соотношением:
КОЛЬРАУША ЗАКОН
В бесконечно разбавленном р-ре электролита перенос электричества осуществляется всеми ионами независимо друг от друга. Вследствие этого общая молярная электрич. проводимость такого р-ра L° равна сумме электрич. проводимостей l°i отдельных ионов, а разность молярных электрич. проводимостей двух р-ров солей с общим катионом не зависит от природы этого катиона, напр. . При увеличении концентрации р-ра вследствие взаимод. ионов их движение уже не является независимым и К. з. не выполняется.
29.
Кондуктометрическое титрование - один из электрохимических методов анализа.
При титровании в р-ре вследствие реакций нейтрализаций или осаждения уменьшается конц. ионов исходного электролита. Поэтому удельная электропроводность р-ра постепенно изменяется. В точке эквивалентности связывается последние ионы исходного электролита и появ-
ся первые избыточные ионы электролита, добавляемого при титровании. Поскольку подвижность разных ионов не одинакова, в точке эквивалентности происходит резкое изменение удельной электропроводности р-ра. Оно определяет кол-во титруещего электролита, израсходанного на титровании до скочка электропроводности, и расчитывает конц титруемого р-ра. Кондук-им титрованием можно анализировать смеси сильных и слабых кислот и оснований, смесь галогенидов, мутных и окрашенных р-ов, когда невозможно использовать цветные индикаторы.
30.
Причины возникновения электродного потенциала могут быть различными. Так, например, в случае погружения цинковой пластинки в раствор соли цинка, полярные молекулы воды, действуя своими отрицательными полюсами на положительные ионы металла, переводят их в раствор. При этом электроны остаются на поверхности металла, заряжая ее отрицательно. Гидратированные ионы металла, перешедшие в раствор, притягиваются заряженной поверхностью пластинки и располагаются вблизи нее. В результате образуются два слоя с противоположными зарядами - так называемый двойной электрический слой. Процесс перехода ионов металла в жидкость является процессом обратимым.
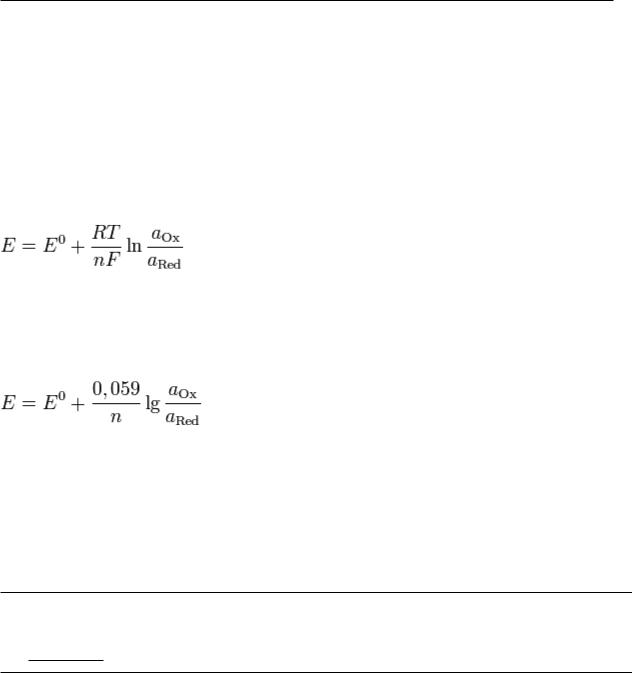
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными потенциалами окислительно-восстановительных пар.
где R— универсальная газовая постоянная, равная 8.31 Дж/(моль·K); T - абсолютная температура;
F-число Фарадея, равное 96485,35 Кл/моль;
n- число молей электронов, участвующих в процессе;
aox и aRed — активности соответственно окисленной и восстановленной форм вещества, участвующего в полу реакции.
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (кило паскалей).
Гальванический элемент - химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита. Сейчас широко распространены следующие гальванические элементы.
31.
Уравнение Нернста–Петерса
E=E0-0,059pH
32.
По типу электродной реакции все электроды можно разделить на две группы (в отдельную группу выделяются окислительно-восстановительные электроды.
Электроды первого рода: К электродам первого рода относятся электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл. Т.о., электроды первого рода обратимы по катиону и их потенциал связан уравнением Нернста (III.40) с концентрацией катиона (к электродам первого рода относят также и водородный электрод).

Электроды второго рода: Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона и зависимость их электродного потенциала от температуры и концентрации аниона может быть записана в следующем виде:
Хлорсеребряный электрод (ХСЭ) благодаря стабильности потенциала и простоте конструкции является одним из наиболее часто употребляемых в лабораторной практике электродов сравнения. Представляет собой серебряную пластинку или проволочку, покрытую слоем малорастворимой соли серебра (обычно - хлорида) и опущенной в насыщенный раствор хлорида калия. Схематически записывается как: Ag|AgCl|KCl|Cl−.
Каломельный электрод - электрод, использующийся в качестве электрода сравнения в гальванических элементах. Каломельный электрод состоит из платиновой проволочки, погружённой в каплю ртути, помещённую в насыщенный каломелью раствор хлорида калия определённой концентрации. Схематически его записывают следующим образом: Pt|Hg|Hg2Cl2| Cl-.
33.
Потенциометрические методы основаны на измерении электродвижущих сил (ЭДС):
E=E1-E2
где E - электродвижущая сила (ЭДС);
E1 и E2 - потенциалы электродов исследуемой цепи.
Потенциал электрода E связан с активностью и концентрацией веществ, участвующих в электродном процессе, уравнением Нернста:
R - универсальная газовая постоянная, равная 8,312 Дж/(моль К); T - абсолютная температура, К;
F - постоянная Фарадея, равная 96485 Кл/моль;
n - число электронов, принимающих участие в электродной реакции;
aox, ared - активности соответственно окисленной и восстановленной форм редокс-системы; [ox], [red] - их молярные концентрации;
Гox, Гred - коэффициенты активности.
Потенциометрические методы анализа подразделяют на прямую потенциометрию (ионометрию) и потенциометрическое титрование. Методы прямой потенциометрии основаны на прямом применении уравнения Нернста (1) для нахождения активности или концентрации участника электродной реакции по экспериментально измеренной ЭДС цепи или потенциалу соответствующего электрода. При потенциометрическом титровании точку эквивалентности определяют по резкому изменению (скачку) потенциала вблизи точки эквивалентности.
Беренд сообщил (1883) о первом потенциометрическом титровании.
34.
Высокомолекулярные соединения (полимеры), характеризуются молекулярной массой от нескольких тысяч до нескольких (иногда многих) миллионов. В состав молекул высокомолекулярных соединений (макромолекул)входят тысячи атомов, соединенных химическими связями. Любые атом или группа атомов, входящие в состав цепи полимера или олигомера, называются составным звеном. Наименьшее составное звено, повторением которого может быть описано строение регулярного (см. ниже) полимера, называется составным
повторяющимся звеном. Составное звено, которое образуется из одной молекулы мономера при полимеризации, называется мономерным звеном (ранее иногда называлось элементарным звеном). Растворы высокомолекулярных соединений обычно получают путем постепенного неограниченного набухания исходного вещества в подходящем растворителе.
Набухание - самопроизвольный процесс, характеризующийся постепенным поглощением больших количеств растворителя и одновременным значительным увеличением (до 10-15- кратного) объема набухающего тела. При приготовлении растворов из многих порошкообразных высокомолекулярных соединений, обладающих способностью значительно набухать в данном растворителе, часто приходится считаться с тем, что при неудачном смешении с растворителем набухающее высокомолекулярное вещество, имеющее вид порошка, образует комки, плохо взаимодействующие с жидкостью и в лучшем случае лишь чрезвычайно медленно переходящие в раствор. Для предупреждения комкования необходима правильная методика смешения порошкообразного материала с растворителем. Если процесс набухания происходит не слишком быстро, то порошкообразное вещество непрерывно перемешивают с постепенно прибавляемой жидкостью в ступке или осторожно (не слишком быстро) высыпают на поверхность жидкости с таким расчетом, чтобы воздух мог свободно выйти через еще несмоченные участки порошкообразной массы. Если процесс набухания происходит короткое время, то выгоднее воспользоваться другим приемом - смочить растворяемый материал растворителем, чтобы таким образом вытеснить жидкостью воздух, находящийся в порошкообразном материале.
34. Вязкость растворов ВМС
Макромолекулы ВМС имеют линейное строение, причем длина их намного превышает размеры в других направлениях. Даже при небольшой концентрации раствора под влиянием межмолекулярных сил макрочастицы непрочно сцепляются и переплетаются друг с другом, образуя пространственную молекулярную сетку-каркас, препятствующую истечению раствора по капилляру вискозиметра. С повышением давления рыхлый молекулярный каркас разрушается, нити макромолекул распрямляются и ориентируются своей длинной осью в направлении потока, в результате чего понижается гидродинамическое сопротивление и увеличивается скорость истечения раствора. Вычисленная по уравнению Ньютона или Пуазейля вязкость падает с увеличением приложенного давления до тех пор, пока не произойдет достаточно полная ориентация частиц. При дальнейшем повышении давления скорость истечения в некотором интервале значений градиента скорости не изменяется, а затем начинает возрастать вследствие перехода ламинарного истечения жидкости в турбулентное. Аналогичная зависимость вязкости от скорости течения наблюдается у концентрированных эмульсий и суспензий с палочкообразной, эллипсоидной или пластинчатой формами частиц. Капельки дисперсной фазы в эмульсиях с возрастанием приложенного давления и увеличением скорости истечения удлиняются, превращаясь из шариков в эллипсоиды. Это облегчает истечение и ведет к понижению вязкости.
Относительная,удельная и приведенная вязкость.
Относительная вязкость - отношение коэффициента динамической вязкости раствора к коэффициенту динамической вязкости чистого растворителя:

где μ — динамическая вязкость раствора; μ0 — динамическая вязкость растворителя.
Молекулярная масса
-важная характеристика всякого высокомолекулярного соединения, обусловливающая все основные его свойства. Поскольку в процессе получения ВМС образуются смеси
полимеров с различными длинами цепей, а следовательно, и с различной молекулярной массой (смеси полимергомологов), приходится говорить о некоторой средней молекулярной массе.
Методы измерения вязкости.
Все методы определения молекулярной массы высокомолекулярных соединений можно разделить на две группы:
а) криоскопический, эбулиоскопический, осмотический, основанные на вычислении молярной концентрации раствора, т. е. на определении числа частиц в навеске ВМС
б) диффузионный, вискозиметрический методы, основанные на вычислении среднего размера частиц в растворе.
1.Осмотический метод заключается в следующем: по величине гидростатического давления, при котором прекращается переход растворителя в раствор, измеряют осмотическое давление раствора ВМС, а затем используют уравнение Вант-Гоффа:
Так как при определении осмотического давления пользуются довольно концентрированными растворами, то в уравнение Вант-Гоффа вводят поправку, учитывающую проявление сил межмолекулярного притяжения:

Измерив осмотическое давление двух растворов с различным содержанием вещества m1 и m2 пользуясь уравнением (2), можно вычислить М. Данный метод применим для определения молекулярной массы до 150 000 а. е. м.
2.Вискозиметрический метод является самым простым и наиболее применимым на практике методом определения средней молекулярной массы ВМС. В этом случае с помощью капиллярного вискозиметра (см. рис. 14) определяют вязкость исследуемого раствора и, используя уравнение Штаудингера, вычисляют М:
Предварительно находят константу Км для полимергомологического ряда, членом которого является данный полимер. С этой целью криоскопическим методом определяют молекулярную массу какого-либо низшего гомолога данного полимергомологического ряда. Затем, измерив вязкость нескольких растворов этого вещества, находят среднее значение Км для данного ряда. Зная Км, по величине вязкости можно определять молекулярную массу любого полимера (члена данного гомологического ряда). Однако Км не является постоянной величиной и зависит от молекулярной массы полимера. Км уменьшается с увеличением М. Поэтому результаты, вычисленные по уравнению Штаудингера, не являются достаточно точными. Уравнение Штаудингера практически применимо лишь для веществ с молекулярной массой не более 30 000 а. е. м. Уменьшение постоянной Км с увеличением молекулярной массы обусловлено тем, что молекулы большей длины способны сильнее изгибаться и тем самым оказывают относительно меньшее противление потоку.
Уравнение штаудингера
37. Полиэлектролиты
Полиэлектролиты, полимерные электролиты, т. е. полимеры, способные диссоциировать в растворах на ионы. При этом в одной макромолекуле возникает большое число периодически повторяющихся зарядов. П. делятся на полимерные кислоты (например, полиакриловые), полимерные основания (например,
поливинилпиридиний) и полиамфолиты (сополимеры, в состав которых входят как основные, так и кислотные группы). Большинство П. содержит слабые кислотные или основные группы и поэтому ионизованы только в присутствии сильного основания — для поликислоты или сильной кислоты — для полиоснования.
К числу П. относятся важнейшие биополимеры — белки и нуклеиновые кислоты.
Изоэлектрическая точка
Изоэлектрическая точка - значение рН, при котором заряд амфотерной молекулы вещества равен нулю; значение рН среды (точнее, несколько значений, зона), при к-ром молекулы вещества (напр., белки) или клетки, находящиеся в этой среде, имеют нулевой потенциал и не передвигаются в электрофоретическом поле. И. т. живых микробных клеток расположена в кислой зоне рН, что обусловлено их отрицательным электрическим зарядом. В И. т. стабильность бактер. взвесей минимальная (возможна спонтанная агглютинация). И. т. у разных видов и у одного и того же вида в разных фазах развития (напр., у S- и R-форм) неодинаковы, что может быть использовано для прикладных целей. И. т. измеряют электрофоретической подвижностью взвесей в буферных р-рах с последовательными изменениями рН, методом изоэлектрической фокусировки, интенсивностью окраски объекта основными и кислотными красителями в среде с различными значениями рН.
Мембранное равновесие Доннана
Мембранное равновесие Доннана связано с переносом некоторого количества вещества низкомолекулярного электролита внутрь пространства, содержащего полимер, и, вследствие этого, неравномерного распределения концентраций этого электролита по обе стороны полупроницаемой мембраны.
Пусть в некоторый начальный момент времени концентрации ионов низкомолекулярного и высокомолекулярного соединений по обе стороны мембраны распределяются следующим образом:
В левой части сосуда, разделенного полупроницаемой мембраной, находится раствор полимера, который в результате диссоциации представлен поликатионом R(Z+) и противоионом Cl–, концентрации которых равны соответственно C1 и ZC1. В левой части – раствор низкомолекулярного электролита, например KCl, с концентрацией С2, диссоциирующий на К+ и Cl–. При установлении равновесия вследствие диффузии в такой системе малые ионы K+ перемещаются преимущественно из правой части сосуда в левую. Макрокатионы R(Z+) не могут проникать через мембрану, поэтому для сохранения электронейтральности вместе с катионами K+ справа налево происходит перемещение избыточного числа анионов Cl–. В результате этих процессов концентрация низкомолекулярного электролита в растворе ВМС повышается:
Условием равновесия является равенство произведений концентраций электролитов в левой и правой части сосуда, разделенного полупроницаемой мембраной:
[K+]внутр.[Cl–]внутр. = [K+]внеш.[Cl–]внеш.
X (ZC1 + X) = (C2 – X)2
Решая это уравнение относительно X, получаем:
C22
X = |
. |
ZC1 + 2C2
Это и есть уравнение Доннана, которое показывает количество низкомолекулярного вещества, переносимого в фазу ВМС через полупроницаемую мембрану. Из него следует вывод, что низкомолекулярный электролит распределяется неравномерно по обе стороны мембраны. Перенос вещества всегда существует из внешнего раствора во внутренний, в результате чего во внутреннем растворе наблюдается более высокая концентрация переносимых электролитов по сравнению с внешним раствором. Этим же объясняется некоторый избыток осмотического давления в растворах, содержащих ВМС и электролиты.
Если концентрация низкомолекулярного электролита намного больше концентрации полимера (С2 >> C1), то X = C2/2, т.е. при малых концентрациях
макроионов и больших концентрациях малых ионов наблюдается равномерное
распределение малых ионов по обе стороны мембраны.
При обратном соотношении концентраций (C2 << C1), XZC1 = C22, откуда
следует, что перенос X очень мал и обратно пропорционален величине ZC1.
Осмотическое давление раствора в левом отсеке складывается из
осмотического давления, обусловленного присутствием ВМС и
низкомолекулярного соединения:
(1 = (1(ВМС) + (1(НМС) – (2(НМС).
Та часть осмотического давления крови, которая создается растворенными в ней белками, называется онкотическим давлением. Хотя по абсолютной величине оно, как правило, незначительно (например, для плазмы крови на долю осмотического давления, создаваемого растворами белков приходится всего лишь 0,5 – 1 %), эта составляющая имеет большое физиологическое значение.
Все биологические мембраны полупроницаемы: в нормальных условиях проницаемы для неорганических солей и воды и непроницаемы для белков и полисахаридов. Этот эффект является одной из причин неравномерного распределения ионов вне и внутри клетки.
Онкотическое давление - коллоидно-осмотическое давление, доля осмотического давления, создаваемая высокомолекулярными компонентами раствора. В плазме крови человека составляет лишь около 0,5 % осмотического давления (3—4 кн/м², или 0,03— 0,04 ат). Тем не менее онкотическое давление играет важнейшую роль в образовании межклеточной жидкости, первичной мочи и др. Стенка капилляров свободно проницаема для воды и низкомолекулярных веществ, но не для белков. Скорость фильтрации жидкости через стенку капилляра определяется разницей между онкотическим давлением белков плазмы и гидростатическим давлением крови, создаваемым работой сердца. На артериальном конце капилляра солевой раствор вместе с питательными веществами переходит в межклеточное пространство. На венозном конце капилляра процесс идёт в противоположном направлении, поскольку венозное давление ниже онкотического давления. В результате в кровь переходят вещества, отдаваемые клетками. При заболеваниях, сопровождающихся уменьшением концентрации в крови белков (особенно альбуминов), онкотическое давление снижается, и это может явиться одной из причин накопления жидкости в межклеточном пространстве, в результате чего развиваются отёки.
