
Химия экзамен - копия
.pdf
5.
Химическая термодинамика — раздел физической химии, изучающий процессы взаимодействия веществ методами термодинамики.
Основными направлениями химической термодинамики являются:
1.Классическая химическая термодинамика, изучающая термодинамическое равновесие вообще.
2.Термохимия, изучающая тепловые эффекты, сопровождающие химические реакции.
3.Теория растворов, моделирующую термодинамические свойства вещества исходя из представлений о молекулярном строении и данных о межмолекулярном взаимодействии.
Эндергонические процессы
Свободная энергия (дельта G), т.е. доступная клетке энергия - это та часть энергии, которая может быть превращена в работу. При протекании химических реакций в живом организме самопроизвольно идут те процессы, в которых изменение свободной энергии будет отрицательным (-дельта G). Такие процессы называются экзергоническими. Процессы, для которых дельта G является величиной положительной, называются эндергоническими. Эти процессы не могут происходить самопроизвольно. При протекании эндергонических процессов необходим приток энергии извне.
Энергетического сопряжения
В основе биоэнергетических процессов лежит принцип энергетического сопряжения, в соответствии с которым молекулярные превращения, приводящие к возрастанию свободной энергии, — эндергонические реакции (например, синтез белков из аминокислот, гликогена из глюкозы, жиров из жирных кислот и глицерина за счет энергии АТФ) — находятся в динамическом равновесии с экзергоническими, происходящими со значительным уменьшением энергии (гликолиз и окисление органических веществ кислородом, гидролиз АТФ с образованием АДФ и фосфата).
6.
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений Основные понятия химической кинетики:
Скорость химической реакции — изменение количества вещества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции)
Факторы влияющие на скорость хим. реакции: 1) Природа химических реагентов
Свойство простых тел, а также формы и свойства соединений форм наход-хся в периодической зависимости от величины атомных весов Свойство простых веществ, а также формы и свойство соединений элементов, находящихся в
перио. Зависимости от величины заряда атома элемента.
Закон действующих масс = Закон сохранения масс
Скорость химической реакции прямо пропорционально концент. веществ в степени харак. Коэффициентов.
V=k*CAa*CBb | Vср = ± Dc / Dt | Vист. = ± dc / dt.
Отношение Dc / Dt характеризует скорость за какой-то промежуток времени и называется средней скоростью. Чем меньше интервал D t и изменение Dc, тем точнее отношение Dc /Dt соответствует истинной (мгновенной) скорости в данный момент. Математически это представляется в виде производной от концентрации по времени.
Гомогенные реакции протекают в пределах одной фазы, например, в смеси газов или в растворе.

Гетерогенные реакции протекают на границе раздела фаз, например, твердой и жидкой, твердой и газообразной.
Реакции, в которых исходные вещества способны образовывать разные продукты реакции или одно вещество одновременно способно реагировать с несколькими веществами, называются
параллельными.
Последовательными называются сложные реакции, протекающие таким образом, что вещества, образующиеся в результате одной стадии (т.е. продукты этой стадии), являются исходными веществами для другой стадии. Схематически последовательную реакцию можно изобразить следующим образом:
А ––> В ––> С ––> ..
Сопряжённые реакции.
Сопряжёнными принято называть сложные реакции, протекающие следующим образом:
1)А + В ––> С
2)А + D ––> Е,
причём одна из реакций может протекать самостоятельно, а вторая возможна только при наличии первой.
Цепные реакции.
Цепными называют реакции, состоящие из ряда взаимосвязанных стадий, когда частицы, образующиеся в результате каждой стадии, генерируют последующие стадии. Как правило, цепные реакции протекают с участием свободных радикалов. Для всех цепных реакций характерны три типичные стадии, которые мы рассмотрим на примере фотохимической реакции образования хлор водорода.
Н2 + Сl• ––> НСl + Н• Н• + Сl2 ––> НСl + Сl•
Молекулярность реакции
Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
H2S → H2 + S
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
СН3Вr + КОН → СН3ОН + КВr
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц:
О2 + NО + NО → 2NО2
Реакции с молекулярностью более трёх неизвестны.
Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Чётко определенной взаимосвязи между понятиями молекулярности и порядка реакции нет, так как порядок реакции характеризует кинетическое уравнение реакции, а молекулярность — механизм реакции.
7. Влияние концентраций реагирующих веществ. Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ:
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.

v = kcA cB
Реакции нулевого порядка V=k0
Реакции первого порядка
Реакции второго порядка
Константа скорости реакции k зависит от природы реагирующих веществ и от температуры, но не зависит от их концентраций.
Уравнение, связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Если опытным путем определено кинетическое уравнение реакции, то с его помощью можно вычислять скорости при других концентрациях тех же реагирующих веществ.
Еще одной кинетической характеристикой реакции является период полу превращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной. Выразим t1/2 для реакции первого порядка, учитывая, что С = ½Со.
8.
Влияние температуры на количество столкновений молекул может быть показано с помощью модели. В первом приближении влияние температуры на скорость реакций определяется правилом Вант-Гоффа (сформулировано Я. Х. Вант-Гоффом на основании экспериментального изучения множества реакций):
В интервале температур от 0оС до 100оС при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза:
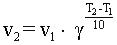 где g – t температурный коэффициент, принимающий значения от 2 до 4.
где g – t температурный коэффициент, принимающий значения от 2 до 4.
С. Аррениус рассчитал долю активных (т.е. приводящих к реакции) соударений реагирующих частиц a, зависящую от температуры: - a = exp(-E/RT). и вывел уравнение Аррениуса для константы скорости реакции:
K=k0*e-E/RT
где ko и E d зависят от природы реагентов. Е - это энергия, которую надо придать молекулам, чтобы они вступили во взаимодействие, называемая энергией активации.
9.
Катализ – явление изменения скорости химической реакции в присутствии веществ, состояние и количество которых после реакции остаются неизменными.
Гомогенный катализ – каталитические реакции, в которых реагенты и катализатор находятся в одной фазе. В случае гомогенно-каталитических процессов катализатор образует с реагентами промежуточные реакционноспособные продукты.
Гетерогенный катализ – каталитические реакции, идущие на поверхности раздела фаз, образуемых катализатором и реагирующими веществами. Механизм гетерогенно-каталитических процессов значительно более сложен, чем в случае гомогенного катализа.
Ферментативный катализ – каталитические реакции, протекающие с участием ферментов – биологических катализаторов белковой природы. Ферментативный катализ имеет две характерные особенности:
1.Высокая активность.
2.Высокая специфичность.
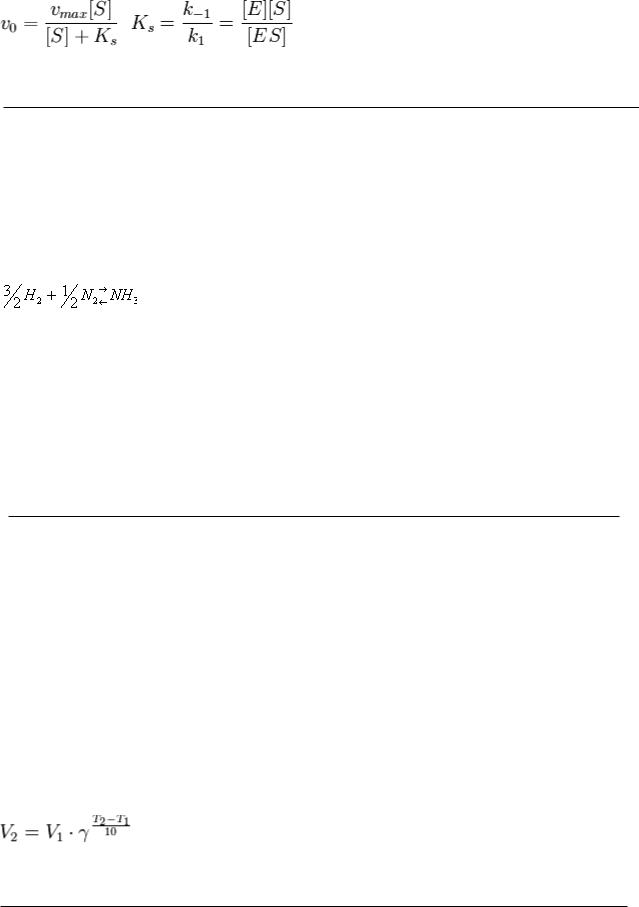
Уравнение МихаэлисаS — МентенS — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента
субстратная константа KS, характеризующая взаимодействие фермента с субстратом в равновесных условиях.
S- концентрация субстрата.
10.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
2KClO 3 = 2KCl + 3O 2 ↑
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
Константа равновесия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
С ростом температуры константа равновесия эндотермической реакции увеличивается. Константа равновесия гетерогенной реакции не зависит от концентраций твердых веществ.
В выражение константы равновесия гетерогенной реакции, как и в выражение закона действия масс, входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются, как правило, постоянными.
11.
Равновесие термодинамическое, состояние термодинамической системы, в которое она самопроизвольно приходит через достаточно большой промежуток времени в условиях изоляции от окружающей среды, после чего параметры состояния системы уже не меняются со временем. Одним из условий Равновесие термодинамическое является механическое равновесие, при котором невозможны никакие макроскопические движения частей системы, но поступательное движение и вращение системы как целого допустимы.
Константа равновесия( Кр) связана со стандартной энергией Гиббса реакции простым соотношением:
AG°r= -RT\nKp
где R — молярная газовая постоянная [8,31 Дж/(моль-К) ]. Т — термодинамическая температура, К.
Кр—константа равновесия гомогенной реакции. А – число активных молекул.
G- Энергия Гиббса.
Правило Вант-Гоффа
Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий (температура, давление, концентрация), то равновесие смещается таким образом, чтобы компенсировать изменение.
12.
Раствор — гомогенная (однородная) смесь, образованная не менее чем двумя компонентами, один из которых называется растворителем, а другой растворимым веществом, это также система переменного состава, находящаяся в состоянии химического равновесия.
Вода - прежде всего растворитель, в среде которого протекают все элементарные акты жизнедеятельности. К тому же вода - продукт и субстрат энергетического метаболизма в живой клетке. Образно говоря, вода - это арена, на которой разыгрывается действие жизни и участник основных биохимических превращений.
Наиболее важны следующие свойства воды:
∙Чистота воды – наличие в ней примесей, бактерий, солей тяжелых металлов, хлора и др.
∙Поверхностное натяжение – это степень сцепления молекул воды друг с другом.
∙Жесткость воды – наличие в ней солей. От жесткости зависит также степень взаимодействия воды с другими веществами.
∙Кислотно-щелочное равновесие воды. Основные жизненные среды (кровь, лимфа, слюна, межклеточная жидкость, спинномозговая жидкость и др.) имеют слабощелочную реакцию (в среднем 7,5 ед.).
∙Окислительно-восстановительный потенциал воды (ОВП). Это способность воды вступать в биохимические реакции. Она определяется наличием свободных электронов. Это очень важный показатель для организма человека.
∙Структура воды. Вода представляет собой жидкий кристалл.
∙Информационная память воды. За счет структуры кристалла происходит запись биополевой информации.
∙Минерализация воды. Наличие в воде макро- и микроэлементов необходимо для
здоровья.
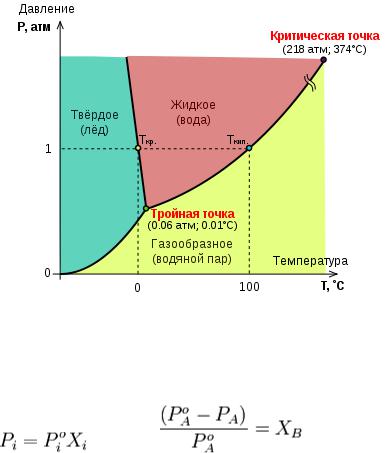
Диаграмма состояния воды
Идеальным раствором называют раствор, для которого выполняется первый закон Рауля. Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
Вода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.

13.
Растворимость газов в жидкостях зависит от ряда факторов: природы газа и жидкости, давления, температуры, концентрации растворенных в жидкости веществ (особенно сильно влияет на растворимость газов концентрация электролитов).
Наибольшее влияние на растворимость газов в жидкостях оказывает природа веществ. Растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью. Здесь С – концентрация раствора газа в жидкости, k – коэффициент пропорциональности, зависящий от природы газа. Закон Генри – Дальтона справедлив только для разбавленных растворов при малых давлениях, когда газы можно считать идеальными. Газы, способные к специфическому взаимодействию с растворителем, данному закону не подчиняются. Растворимость газов в жидкостях существенно зависит от температуры Закон Генри — Дальтона — относится к растворимости газов в жидкости в зависимости от упругости этого газа, производящего давление на жидкость.
14.
Коллигативные свойства растворов — это те их свойства, которые при данных условиях оказываются равными и независимыми от химической природы растворённого вещества; свойства растворов, которые зависят лишь от количества кинетических единиц и от их теплового движения.
Первый закон Рауля
Пар, находящийся в равновесии с жидкостью, называют насыщенным. Давление такого пара над чистым растворителем (p0) называют давлением или упругостью насыщенного пара чистого растворителя.
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p= p0 · χр-ль
p— давление пара над раствором, ПА;
p0 — давление пара над чистым растворителем; χр-ль — мольная доля растворителя.
Для растворов электролитов используют несколько другую форму уравнения, позволяющую добавить в неё изотонический коэффициент:
Δp = i · p0 · χв-ва
Δp — собственно изменение давления по сравнению с чистым растворителем; χв-ва — мольная доля вещества в растворе.
Второй закон Рауля
Повышение температуры кипения раствора по сравнению с температурой кипения растворителя, а равно и понижение температуры замерзания раствора по сравнению с аналогичным характеризующей величиной для растворителя прямо пропорциональна моляльности раствора, то есть,
ΔTкип/зам= Kэб/кр · bв-ва
Kэб/кр — соответственно эбулиоскопическая и криоскопическая (относится к замерзанию) константы, характерные для данного растворителя;
bв-ва — моляльность вещества в растворе.
Криометрия - используется, напр., для анализа биологических жидкостей.
15.
При контакте двух различных по своему составу тел независимо от их агрегатного состояния происходит взаимное перемещение молекул одного вещества в другое – диффузия.
Диффузия в растворах или газах сопровождается конвекцией (перемешиванием за счет разности температур в различных токах объема) или за счет различия в плотности соприкасающихся сред. В чистом виде диффузия происходит при контакте раствора или растворителя с плотной средой. В этих случаях скорость диффузии зависит главным образом от структуры плотного материала,

которая создает дополнительные препятствия для перемещения молекул диффундирующего вещества.
Осмос — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону большей концентрации.
Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану. Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.
Вант-Гоффа закон
Осмотического давления, определяет давление молекул растворённого вещества на полупроницаемую перепонку, отделяющую раствор от чистого растворителя и непроницаемую для растворённого вещества.
Изотонические растворы - растворы с одинаковым осмотическим давлением Гипертонические растворы - растворы, осмотическое давление которых выше осмотического давления в растительных или животных клетках и тканях.
Гипотонические растворы в биологии различные растворы, осмотическое давление которых ниже, чем в клетках растительных или животных тканей. В Г. р. клетки насасывают воду, увеличиваясь в объёме.
Осмометрия - совокупность методов определения осмотич. давления
16.
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы.
17.
Протолитическая теория
Датский физико-химик Йоханнес Бренстел (1879-1947 гг.) и английский химик Томас Лоури (1874-1936гг.) практически одновременно (1928-1929 гг.) предложили протолитическую теорию кислот и оснований, согласно которой кислота - донор катионов водорода Кислоты могут быть:
а) молекулярными HCI ↔ H+ + Сl–, б) катионными NH4+ ↔ NH3 + Н+, в) анионными HCO3– ↔ CO32- + Н+.
Основание - акцептор катионов водорода. Основания делятся на
а) молекулярные NH3 + Н+ ↔ NH4+, б) анионные ОН– + Н+ ↔ Н2О,
в) катионные AIOH2+ + Н+ ↔ AI3+ + Н2О.
Амфотерные вещества (амфолиты) - это вещества, которые являются как донорами, так и акцепторами протонов. Они могут быть заряженными , например:
H2PO4– ↔ Н+ + HPО42–,
H2PO4– + Н+ ↔ H3PO4.
Теория кислот и оснований Льюиса
В теории Льюиса было ещё более расширено понятие кислоты и основания. Кислота — это молекула, имеющая вакантные электронные орбитали, вследствие чего она способна принимать электронные пары, например BF3, AlCl3. Основание — это молекула, способная быть донором электронных пар. Например, основания Льюиса — все анионы, аммиак и амины, вода, спирты, галогены.
18.

Протолитические реакции. К протолитическим реакциям относят химические процессы, суть которых заключается в переносе протона от одних реагирующих веществ к другим. Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в полярном растворителе или при плавлении.
Степень диссоциации - это отношение числа распавшихся на ионы молекул N' к общему числу растворенных молекул N:
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы. Она зависит от концентрации электролита и от температуры. Константа диссоциации Kd определяется активностями катионов , анионов и недиссоциированных молекул следующим образом:
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора.
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении.
Электролиты, такие как: калий, магний, кальций, натрий и хлорид крайне важны для процессов в организме, влияющих на концентрацию человека, энергообмен, нервную трансмиссию и мышечные сокращения.
19.
Теория сиSльных электролиSтов ДебаяS — ХюSккеля — предложенная Петером Дебаем и Эрихом Хюккелем в 1923 году статистическая теория разбавленных растворов сильных электролитов, согласно которой каждый ион действием своего электрического заряда поляризует окружение и образует вокруг себя некоторое преобладание ионов противоположного знака — так называемую ионную атмосферу.
В отсутствие внешнего электрического поля ионная атмосфера имеет сферическую симметрию, и её заряд равен по величине и противоположен по знаку заряду создающего её центрального иона. В этой теории не уделено почти никакого внимания образованию пар противоположно заряженных ионов путём непосредственного взаимодействия между ними.
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полу сумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Теория электролитической диссоциации справедлива только к растворам слабых электролитов. Сильные электролиты диссоциируют полностью, создавая значительную концентрацию ионов в растворе. Их ионы в растворах как бы окружены оболочкой полярных молекул растворителя, что приводит к уменьшению скорости движения ионов. В результате степень диссоциации меньше единицы, хотя реально в растворе присутствуют только ионы. Такую экспериментальную величину называют кажущейся степенью диссоциации.
20.
Диссоциация воды
Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды распадаться (диссоциировать) на

два иона которые и являются проводниками электрического тока в чистой воде (ниже под диссоциацией подразумевается электролитическая диссоциация - распад на ионы):
H2O ↔ H+ + OH-
Ионное произведения водыS— произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды. Кислотно-щелочное равновесие - относительное постоянство концентрации водородных ионов во внутренних средах организма, обеспечивающее полноценность метаболических процессов, протекающих в клетках и тканях.
21.
Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита. Гидролиз - процесс обратимый.
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли. Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие. Гидролиз солей слабых многоосновных оснований и/или кислот происходит ступенчато. Число ступеней гидролиза равно наибольшему заряду одного из ионов соли.
Константа гидролиза — константа равновесия гидролитической реакции.
22.
Гетерогенный ионный обмен имеет место при сорбции из растворов электролитов на некоторых минералах (алюмосиликатах, гидратах окисей металлов, цеолитах), в клетках и мембранах живых организмов и в синтетических ионообменных сорбентах. Гетерогенный ионный обмен широко применяется для обессоливания воды, идущей для питания котлов паром высоких параметров, в гидрометаллургии
Произведение растворимости (Ks) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
Процессы образования и растворения минеральных компонентов костной ткани также обусловлены сдвигами гетерогенного равновесия в организме . Дело в том, что минеральные компоненты костной ткани, основу которых составляет гидрокс фосфат кальция Са5(РО4)3ОН, находятся в состоянии химического равновесия с ионами кальция и фосфата плазмы крови. Смещение этого равновесия под влиянием различных факторов может приводить к нарушению нормального хода обызвествления остеоидной ткани, т.е. к развитию рахита.
23.
Буферные растворы - растворы с определенной концентрацией водородных ионов, содержащие сопряженную кислотно-основную пару, обеспечивающую устойчивость величины их водородного показателя при незначительных изменениях концентрации либо при добавлении небольшого количества кислоты или щелочи.
Значение рН кислотно-основного буферного раствор зависит от концентраций компонентов буферной смеси, находящихся в химическом равновесии, и мало меняется при концентрировании

и разбавлении раствора, введении относительно небольших количеств веществ, взаимодействующих с одним из компонентов буферного раствора.
Наиболее распространены водные кислотно-основные буферные растворы Они содержат слабую кислоту НА и сопряженное с ней основание А, например СН3СООН и СН3СОО-, NH4+ и NH3.
По данным о константе диссоциации кислоты Ка = — [Н3О+] [А- ] /[НА] определяют значение рН раствора:
где [НА] и [А-] - равновесные концентрации соответственно кислоты и основания, рКа=—lgКа. Это значение рН остается практически постоянным, так как при добавлении небольших кол-в сильных кислот или оснований ионы Н3О+ или ОН-связываются основанием (к-той) с образованием сопряженной кислоты (основания).
БУФЕРНЫЙ РАСТВОР , поддерживает при изменении состава среды постоянство значения к.-л. характеристики, напр. рН (кислотно-основной Б. р.) или окислит.-восстановит. потенциала (окислит.-восстановит. Б. р.).
УРАВНЕНИЕ ГЕНДЕРСОНА-ГАССЕЛЬБАХА pH = pKa + lg (соль/кислота).
В химии буферная ёмкость раствора — определяет способность раствора сохранять постоянной концентрацию определённых ионов (обычно применяется к ионам H+) при условии, что в растворе протекают химические реакции, или при добавлении к раствору электролитов.
24.
Установлено, что состоянию нормы соответствует определенный диапазон колебаний рН крови – от 7,37 до 7,44 со средней величиной 7,40 . Кровь представляет собой взвесь клеток в жидкой среде, поэтому ее кислотно-основное равновесие поддерживается совместным участием буферных систем плазмы и клеток крови. Важнейшими буферными системами крови являются бикарбонатная, фосфатная, белковая и наиболее мощная гемогло-биновая.
Бикарбонатная буферная система – мощная и, пожалуй, самая управляемая система внеклеточной жидкости и крови.
Белковая буферная система имеет меньшее значение для поддержания КОР в плазме крови, чем другие буферные системы.
25.
Гетерогенные системы – системы, внутри которых есть такие поверхности раздела. Гомогенная система – однофазная, гетерогенная – состоит из не менее двух фаз. При размере частиц примесей воды меньше 10-3 мкм – это гомогенная система (однофазная из двух или более индивидуальных веществ). Если размер частиц ≥10-3 мкм, то примеси образуют с водой гетерогенную (неоднородную многофазную) систему. Истинные растворы, где примеси находятся в молекулярно-растворенном виде или в виде ионов, – это гомогенные системы. Гетерогенные системы – коллоиды (размер частиц: 10-2–10-1 мкм) или суспензии (частицы >10-1 мкм). Суспензии могут быть представлены взвесями, эмульсиями, пенами (частный случай эмульсий). ПоверхностноеS натяжениеS — термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объем системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными. ГИББСА - ГЕЛЬМГОЛЬЦА УРАВНЕНИЯ - термо-динамич. соотношения, устанавливающие связь между внутренней энергией U и Гелъмголъца энергией (свободной энергией) F или между энтальпией H и Гиббса энергией (свободной энтальпией) G:
ПоверхностноS -актиSвные веществаS(ПАВ) — химические соединения, которые, концентрируясь на поверхности раздела фаз, вызывают снижение поверхностного натяжения.
