Потенциометрия
.docxПотенциометрия.
Электрод- называют электропровлодящую фазу(ме или полупроводник, контактирующую с ионным проводником) например раствор соли. Электродные процессы представляют собой окислительно-восстановительные рекации на электродах. В ходе этих рций происходит переход из 1 фазы в другую.т на границе фаз возникает электрический слой.
Ионы, переход которых при переходе через границу раздела фаз приводит к возникнив двойного электрич слоя называется ПОТЕНЦИАЛОПРЕДЕЛЯЮЩИЕ ИОНА.
переход которых при переходе через границу раздела фаз приводит к скачку потенциала.
Различ:
Редокс потенциал. Раствор, содерж сопряж окисл восстан пару
Диффузный потенциал-на границе 2 растворов
Мембранный потенциал-возникает на разн сторонах полунепрониц перегородки мембр, раздел рры разн концентрации.
Возникновение электронного потенц.
Пусть ме помещ в чист воду. Под действ диполей воды с поверхн слоя ме вырываются и переходят в раствор его ионы. В рре они будут наход в гидротированном сост. Пластинка ме заряж отрицательное, раствор положит.
Ме+н2о-------me
Характ соотнош между работой выхода иона с пластинки в раствор(ионизация атомов ме)
И энерг гидратац этого иона.
Установив двойной электрич слой характ потенциалом(ϥ)
Ϥ завис от природы ме, а так же от концентрации(активности ионов ме), температуры.
Ϥ=ϥ0ме+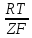 lna
lna
F-число Фарадея(константа) =96500кулон/моль
Берем цинковую пласт(ме средн хим активности) помещ в раствор соли. Результир будет: пластинка заряд отрицательное, прилеж раствор-положительно. В сранд услов равновес смещено вправо.
В кач сравнения возьмем медь(низкая хим активность). Пластинка заряж положительно, а раствор отрицательно, пластинка положительна.
Если бы смогли измерить скачок потенциала при переходе с пласт на раствор, мы бы получили характеристику окислительно-восстан своийст ме и его ионов в реакциях проход в водной среде, однако измерить скачок точек в разных фазах не представляется возможным. На практике можно измерит скачок потенциала междк точками, леж в одной и той же фазе, эти точки должны наход на 2 концах электрихим цепи. Если эти точки из 1 ме, то такую цепочку называют
Правильно разорванной.
Рис 1
ЭДС =ϥме1/ме 2+ϥме2/ме2+-ϥконст.
Чтобы занулить, то припой делают одним и тем же ме.
Солевой мостик изгот из электролитов, подвижность катионов и анионом которого равны.
На аноде идет прсс окисления, анод заряжен отрицательно.
На катоде идет прсс восстановления.
Анионы двиг из катионного раствора в катодный и наоборот.
Внешне стоит прибор(амперметр, вольтметр)
Как преобраз энерг хим рции в электрич можно с помощью гальванического элемента.
Возбмем пример медно-цинкового элемента. Цинковый раствор помещем в раствор с солью цинка и соответств меди.
Ри с 2
Цинк восстан катионы меди, по внешн среде двиг электроны.
По возрас ме- слева направо.
ЭДС =ϥси2+/Сu+
 lna(Cu2+)-
ϥZn2+/Zn+
lna(Cu2+)-
ϥZn2+/Zn+
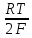 lna(Zn2+)
lna(Zn2+)
Если замкнуть цепь с проводником большлго сопротивл, то реакц пойдут бесконечно медленно и такой тип рции будет соотв равновесному сост. И это протек рции соотв максим электрич работе.
Энерг Гиббса хим рции-максимальная полезная работа, значит, измерив ЭДС посчитаем энерг Гиббса реакции.
W=ZFE(ЭДС)
W=-G
Расчет конст ЭДС самый надежный способ рассчит G.
Измерение электродных потенциалов.
Абсолютн значи потенц измерить невозм, можно ихмерить лишь ЭДС гальв элем, поэтому для определ электродн потенц сост гальван элем из станд водородн электрода, потенциал которого приним за 0 и стандартного исслед электрода.
Взяли Zn электрод, поместили с танд водор и изм ЭДС. Значение электродного потенц ЭДС цепи и имеет значение, если на нем протек прсс восстан.
ЭДС=ϥ02Н/н2
в станд усл водородн катод являются электродом сравн, но может быть индикаторный и измерительн.
Ϥ(водорода)=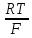 pH.
pH.
Ряд располож в порядке возр в станд электронных потенц называется РЯД НАПРЯЖЕНИЯ Ме.
РЯД СТАНДАРТНЫХ ЭЛЕКТРОННЫХ ПОТЕНЦИАЛОВ.
Чем выше значения потенциала, тем сильнее выражены свва ионов этого ме и слабее выраж восстан свва самого ме.
Ртуть и золото-слаб восстановитель.
В начале напряжения-хорошие восстановители.
литий выйграл 1 метсто, так как у него самая мощная гидратная оболочка.
У меди прочеая кристаллическая решетка, а энерг иониз и гидратации.
Так можно предсказать свойство ме и их ионов.
Возникновение редокс потенциал
-возник на границе раздела. Химич инертн ме(платина) помещ в раствор, сод окисл и восстан форму одного субстата.
Условная запись: pt| Ox||
Редок сист, в котор не участв катионы Н.
Ϥ(редокс
потенц)=ϥ0+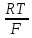 ln
ln
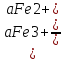
Ϥ=ϥ0+
Сравнить окисл свва Железа 3+ И ПЕРМАНГАТ аниона?
В каком направл протек окисл восстан рции при стандартн условиях?
Галmd элемент сост из 2 платиновых электродов.
Классиф электродов:
-
Первый род: ме, погруж в раствор соли этого ме..
Исп для оперд активн иона этого ме
-
Второй род: ме+труднорримая соль+соедин, содерж ионоим анион.
Например: хлорсеребряный электрод-серебр провлока, покр слоем хлорида серебра и помещ в раствор хлорида К.
Уравнение нерлста.
Или каломель: платиновая проволока в ртути
электродн потенц(ϥ)=
Оба этих электрода часто исп как электроды сравнения.
Он намного удобнее чем станд водор электрод, так как Н2 образ взрывообразн смеси.
Измерение электр потенц.
Потенциометрия:
-
Прямая-измерение рН растворов
-
Косвенная-титрование.
Ионоселективный электрод-потенц которого завис от концентрации какого лио иона по разн стороны мембр. Например, стекл электрод, который избирателmyj селективен.
Стекл электрод-стекл колба, в которой серебряная проволока.
ЭДС=ϥAgcl-ϥстекл электр= ϥAgcl-(К-0,0591рН)
Стекл электрод исп широко, лучше работает в кисл среде, единств минус-нужна пост калибровка.