
Тест 6 – 7
Средняя кинетическая энергия молекул газа при температуре Т зависит от их структуры, что связано с возможностью различных видов движения атомов в молекуле. Средняя кинетическая энергия молекул гелия (Не) равна ...
Варианты ответов: 1) 7 kT/2; 2) 5 kT/2; 3) kT/2; 4) 3kT/2.
Решение.
Средняя кинетическая энергия молекулы равна: <ε> = (i /2)·k T, где i – число степеней свободы, k – постоянная Больцмана, T- абсолютная (или термодинамическая) температура. Величина i представляет собой сумму числа степеней свободы поступательного, вращательного и удвоенного числа степеней свободы колебательного движения молекулы: i = iпост + iвращ + 2·iколеб . Молекула гелия состоит из одного атома, поэтому она имеет три степени свободы поступательного движения (i = 3), и средняя кинетическая энергия молекулы гелия равна: <ε> = 3·k T/ 2.
Ответ: вариант 4.
Тест 6 – 8 Средняя кинетическая энергия молекул газа при температуре Т зависит от их структуры, что связано с возможностью различных видов движения атомов в молекуле. При условии, что имеют место только поступательное и вращательное движение, средняя энергия молекул водяного пара (Н2О) равна ... Варианты ответов: 1) 3kT/2; 2) 3kT; 3) 7kT/2; 4) 5kT/2.
Решение.
Средняя кинетическая энергия молекулы равна: ‹ε›= (i /2)·k T, где i –полное число степеней свободы, k – постоянная Больцмана, T- абсолютная (или термодинамическая) температура. Величина i представляет собой сумму числа степеней свободы поступательного и вращательного движения молекулы: i = iпост + iвращ. Молекула водяного пара (Н2О) состоит из трёх атомов, поэтому она имеет три степени свободы поступательного движения (iпост = 3) и три степени свободы вращательного движения (iвращ =3). Полное число степеней свободы i = iпост + iвращ =3+3=6. Поэтому средняя кинетическая энергия молекулы воды равна: ‹ε>= (6 /2)·k T=3·k T. Ответ: вариант 2
Тест 6 – 9
Состояние идеального газа определяется значениями параметров: p·V= ν·RT, где Т - термодинамическая температура, р - давление, V -объем газа. Определенное количество газа перевели из состояния (p0,V0) в состояние (2p0,V0). При этом его внутренняя энергия...
Варианты ответов: 1) уменьшилась; 2) не изменилась; 3) увеличилась.
Решение.
Внутренняя энергия идеального газа равна: U=(i/2)ν·RT, где i – число степеней свободы, ν – количество вещества, R = 8.31 Дж/(моль·К) – газовая постоянная. Из уравнения Менделеева – Клапейрона следует: p·V= ν·RT. Тогда U= (i/2) p·V. Отсюда следует: U1= (i/2) p0·V0 и U2= (i/2)·2 p0·V0. Таким образом , U2 > U1, т.е. внутренняя энергия увеличилась.
Ответ: вариант 3.
Тест 6 – 10
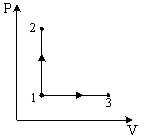 Молярные
теплоемкости гелия в процессах 1-2 и 1-3
равны C1
и С2
соответственно.
Тогда C1/C2
составляет...
Молярные
теплоемкости гелия в процессах 1-2 и 1-3
равны C1
и С2
соответственно.
Тогда C1/C2
составляет...
Варианты ответов:
1) 5/7; 2) 3/5; 3) 5/3; 4) 7/5.
Решение.
Процесс 1 – 2 происходит при постоянном объёме. Молярная теплоемкость при постоянном объёме равна С1 = (i/2)·R. Процесс 1 – 3 происходит при постоянном давлении. Молярная теплоёмкость при постоянном давлении равна С2 = (i + 2)·R/2. Отношение С1 /С2 = i /(i +2). Так как гелий – это одноатомный газ, то для него i =3. Тогда С1 /С2 = 3/(3+2) = 3/5.
Ответ: вариант 2.
Тест 6 – 11
В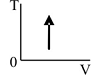 соответствии с первым началом термодинамики
для процесса в идеальном газе, график
которого представлен на рисунке,
справедливо соотношение …
соответствии с первым началом термодинамики
для процесса в идеальном газе, график
которого представлен на рисунке,
справедливо соотношение …
Варианты ответов:
1) Q>0; ∆U>0; A=0. 2) Q <0; ∆U <0; A=0.
3) Q< 0; ∆U>0; A=0. 4) Q>0; ∆U <0; A=0.
Решение.
Согласно первому началу термодинамики, количество теплоты, подводимое к системе, затрачивается на изменение внутренней энергии системы и работу, совершаемую системой против внешних сил: Q= ∆U + A.
Изменение внутренней энергии идеального газа равно:
∆U=(i/2)∙ ν·R∙∆T, где i – число степеней свободы, T – термодинамическая температура, ν – количество вещества, R = 8.31 Дж/(моль·К) – газовая постоянная.
Работа, совершаемая системой против внешних сил при изобарном (р = const) процессе равна произведению давления на изменение объёма: А =р∙∆V, а при изохорном (V = const) процессе работа равна нулю.
Из графика, приведенного в тесте 6-11, видно, что объём остаётся постоянным, т.е.процесс изохорный (V = const и ∆V=0), поэтому А = 0. Из графика также следует, что температура увеличивается, т.е. система нагревается и изменение температуры ∆T>0, поэтому ∆U>0. Если температура системы увеличивается, то это значит, что система получает тепло и Q>0. Следовательно, в соответствии с первым началом термодинамики для процесса в идеальном газе, график которого представлен на рисунке, справедливо соотношение: Q>0, ∆U>0, А = 0. Ответ: вариант 1.
