
- •«Поджелудочная железа. Инсулин, глюкагон, соматостатин. Диабет 1-го типа (инсулиндефицитный) и диабет 2-го типа (инсулинрезистентный). Причины возникновения, сравнительная характеристика»
- •Содержание
- •1.Введение
- •2. Экзокринная функция поджелудочной железы
- •3. Эндокринная функция поджелудочной железы
- •3.1. Инсулин: химическая природа, регуляция секреции, механизм действия, роль в обмене.
- •Реакции, связанные с активностью фосфатидилинозитол-3-киназы
- •Реакции, связанные с активацией map-киназного пути
- •Очень быстрые эффекты (секунды)
- •Быстрые эффекты (минуты)
- •Медленные эффекты (минуты-часы)
- •Очень медленные эффекты (часы-сутки)
- •3.2. Глюкагон: химическая природа, регуляция секреции, механизм действия, роль в обмене.
- •3.3. Соматостатин: химическая природа, регуляция секреции, механизм действия, роль в обмене.
- •4. Гипо- и гиперинсулинизм
- •5. Са́харный диабе́т 1-го типа
- •6.Сахарный диабет 2-го типа
- •Заключение
- •Лист для заметок литература
3.3. Соматостатин: химическая природа, регуляция секреции, механизм действия, роль в обмене.
Соматостатин – пептид из 12 аминокислот, он образуется также в островках поджелудочной железы и контролирует высвобождение глюкагона и инсулина, а также гормонов желудочно-кишечного тракта. Существует в двух биологически активных формах, происходящих от одного предшественника и различающихся длиной N-конца: SST-14 (14 аминокислот: AGCKNFFWKTFTSC, между остатками цистеина дисульфидная связь) и SST-28 (28 аминокислот). Помимо соматостатинов, близкородственные пептиды кортистатин (PCKNFFWKTFSSCK), триттен (13 N-конечных аминокислот SST-28) и уротензин II (ETPDCFWKYCV) также принимают участие в регуляции соматостатинэргической системы
Наибольшее количество соматостатина содержится в срединном возвышении, но значительные концентрации присутствуют и в других областях гипоталамуса, равно как и в таламусе, коре мозга, преоптической области, среднем и спинном мозге. Полная деафферентация медиобазального гипоталамуса приводит к ускорению роста и повышению уровня СТГ в плазме, но концентрация соматостатина в деафферентированной области не регистрировалась. Не ясно, осуществляется ли предполагаемая нейро-трансмиттерыая регуляция секреции СТГ путем изменения концентрации соматостатина или пока еще гипотетического рилизинг-фактора СТГ. Кроме того, введение СТГ тормозит его собственную секрецию. Этот эффект мог бы опосредоваться изменением концентрации соматостатина или рилизинг-фактора СТГ, влияющих на гипофиз, но мог бы определяться и теми изменениями концентрации соматостатина, которые действуют на нервные факторы, регулирующие секрецию СТГ. Относительно парагипофизарного влияния соматостатина на мозг существует мало данных. Подобно ТРГ и ГнРГ, соматостатин при непосредственной аппликации на определенную популяцию одиночных нейронов как в гипоталамусе, так и в других областях (такие, как кора мозга и мозжечка и спинной мозг) может приводить к значительному снижению частоты нейрональных разрядов.

Соматостатинсодержащие клетки обнаружены в спинальных ганглиях, а нервные волокна, содержащие соматостатин, выявляются в дорсальных рогах спинного мозга, периферических симпатических нейронах, превертебральных ганглиях, нижнем и верхнем мезентериальных узлах. В этой связи интерес представляют работы последних лет, в которых показано, что соматостатин вовлечен в такие важные функции мозга, как сознание, память, двигательная активность, вегетативная и эндокринная регуляция. M-F. Chesselet и соавт. (1995) показали, что соматостатин и его мРНК экспрессируются в полосатом теле мозга, которое вовлечено в двигательную активность и поведенческие реакции организма. Ишемия этих участков мозга увеличивает экспрессию гена соматостатина. И, наоборот, уровень соматостатиновой мРНК снижается после применения галоперидола, антипсихотических препаратов, которые способствуют развитию экстрапирамидных симптомов. Авторы справедливо считают, что выявляемая повышенная экспрессия гена соматостатина при патологических состояниях имеет прямое отношение к появлению при этом различных клиничесих симптомов. Кроме того, перерыв дофаминергической иннервации также приводит к повышению экспрессии гена соматостатина в этой области, что является дополнительным подтверждением участия соматостатина в нарушении двигательных реакций, столь характерных для болезни Паркинсона.
Из 52 н. п. синтетического гена 42 пары составляли структурный ген гормона, а остальные служили для присоединения синтетического гена к плазмиде pBR322, а также к сегменту лактозного оперона (lac) из генома Е. coliили к β-галактозидазному гену. Такую синтетическую чужеродную ДНК встраивали непосредственно за бактериальным геномом (или внутри его) после расщепления ДНК рестрикционными эндонуклеазами с образованием в результате трансляции гибридного белка.
Основные
этапы генно-инженерного синтеза
соматостатина показаны на Синтетический
ген соматостатина был встроен в плазмиду
pBR322 E.
Coli вблизи
конца гена, кодирующего фермент
β-галактозидазу. Между двумя генами был
помещен кодон метионина. После выделения
рекомбинантной плазмиды в бактериальную
клетку кишечная палочка стала синтезировать
гибридный белок. Часть его (соматостатин)
затем отщепляли от β-галактозидазы
BrCN. Такой сложный способ получения
гормона был необходим, так как соматостатин,
синтезированный в виде свободных
молекул, быстро деградирует под действием
бактериальных протеаз. Первый синтез
соматостатина генно-инженерным способом
был осуществлен в 1977 ᴦ. Бойером. Выход
гормона составил 10 000 молекул на одну
клетку. Из 100 г биомассы Е.
coli, выращенной
в ферментере объёмом 8 л, удалось вьщепить
5 мг соматостатина, ᴛ.ᴇ. столько,
сколько можно его вьщепить из 100 г
овечьих мозгов.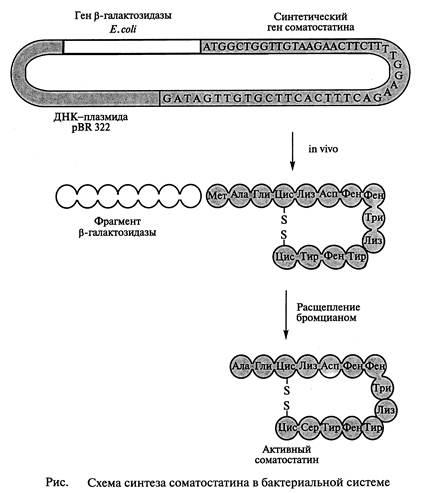
Выделение соматостатина происходит при участии автономной нервной системы в ответ на поступление жиров и аминокислот с пищей.
Соматостатин оказывает свое биологическое влияние через комплексирование с рецепторами, расположенными на мембранах клеток. В настоящее время различают 5 типов рецепторов к соматостатину, которые неодинаково экспрессируются как в тканях различных областей ЦНС, так и в периферических тканях. Все типы рецепторов экспрессируются в передней доле гипофиза и в гипоталамусе, что указывает на участие этих областей в модуляции секреции гормона роста. M. Berelovitz и соавт. (1995) показали, что сахарный диабет и депривация пищи приводят к уменьшению мРНК рецепторов к соматостатину 1, 2 и 3-го типа в гипофизе примерно на 80% по сравнению с контрольными животными, получающими нормальное питание. При этом количество мРНК рецепторов 4 и 5 типа остается без изменений. Также не изменяется количество мРНК всех видов рецепторов в гипоталамусе. В гипофизе диабетических крыс сниженное количество мРНК рецепторов 1, 2 и 3 типа на 50-80% по сравнению с контрольными животными восстанавливается при проведении инсулинотерапии, но только в отношении мРНК рецепторов 1 типа. Экспрессия мРНК рецепторов 4 типа в гипофизе и всех четырех типов в гипоталамусе при этом остается без изменений. Экспрессия же рецепторов 5 типа в гипофизе, сниженная при диабете на 70% и на 30%, в гмпоталамусе восстанавливается при введении инсулина. Эти исследования четко показывают взаимосвязь количества рецепторов к соматостатину с состоянием обмена веществ. Исходя из структуры и фармакологических свойств рецепторы к соматостатину разделяют на две группы (два семейства): к первой группе относятся рецепторы 2, 3 и 5-го типа, которые раньше по фармакологическим характеристикам относили к соматостатиновым рецепторам 1-го типа; ко второй группе относятся рецепторы 1-го и 4-го типа, ранее называемые соматостатиновыми рецепторами 2-го типа. Таким образом, исследования показали, что соматостатиновые рецепторы относятся к группе с 7 трансмембранными фрагментами и кодируются генами, расположенными на различных хромосомах. Ген рецептора 1-го типа локализуется на 14-й; 2-го типа-на 17-й; 3-го типа-на 22-й; 4-го типа-на 20-й и 5-го типа – на 16-й хромосоме. Рецепторы 1-4-го типа практически эквивалентно комплексируются с соматостатином -14 и 28, тогда как рецепторы 5-го типа почти селективно комплексируются с соматостатином, имеющим структуру, включающую 28 аминокислот. Установлена различная аффинность рецепторов к соматостатину и его аналогам. Так, аналог соматостатина октреотид (SMS 201-995) взаимодействует с рецепторами 2 и 3 типа, очень незначительно с рецепторами 5-го типа. Другой аналог соматостатина – соматулин (BIM 23014) комплексируется с рецепторами 2-го и 5-го типа и лишь незначительно с рецепторами 3-го типа.
Соматостатин оказывает влияние на моторную и секреторную функции пищеварительной системы, ее кровообращение и кишечную абсорбцию. Он задерживает эвакуацию желудочного содержимого, угнетая высвобождение мотилина – гормона, стимулирующего моторику желудочно-кишечного тракта, снижает сократитильную активность желчного пузыря путем торможения действия холецистокинина. У накормленных животных соматостатин тормозит высвобождение гастрина и холецистокинина, наблюдаемое после приема пищи.
Соматостатин угнетает секрецию поджелудочной железой инсулина и глюкагона. Это действие распространяется на обе фазы высвобождения инсулина, вызванного глюкозой, толбутамидом, глюкагоном или секретином. Из-за короткого периода полураспада соматостатина (около 4 мин) его тормозящее влияние заканчивается вскоре после прекращения инфузии. Угнетая секрецию глюкагона, соматостатин понижает концентрацию глюкозы в периферической крови путем уменьшения выхода ее из печени в воротную вену. Однако после внутривенной нагрузки глюкозой или длительного введения соматостатина вместо ожидаемого снижения уровня глюкозы в крови наблюдается гипергликемия, что объясняется одновременным значительным угнетением секреции инсулина.
В настоящее время доказаны следующие влияния соматостатина: 1) ингибирование секреции гастрина, секретина, ТТГ, СТГ, инсулина, глюкагона, мотилина, глицентина, ВИП, ренина; 2) угнетение секреции соляной кислоты и пепсина желудком, уменьшение моторики желудка, ингибирование секреции бикарбонатов и ферментов поджелудочной железой, снижение абсорбции в кишечнике, уменьшение кровотока на всем протяжении желудочно-кишечного тракта, снижение секреции и транспорта желчи.
В связи с тормозящим влиянием соматостатина на секрецию СТГ, глюкагона и инсулина высказывались предположения о возможности его использования в лечении сахарного диабета. Оказалось, однако, что соматостатин, угнетая секрецию инсулина, приводит к развитию еще более выраженной инсулиновой недостаточности. Большие надежды возлагались на получение аналогов соматостатина, обладающих исключительным влиянием на ингибирование секреции СТГ и глюкагона и интактным в отношении влияния на секреции инсулина. Полученный аналог соматостатина октреотид обладает рядом преимуществ по сравнению с соматостатином: имеет длительный период полураспада, что позволяет применять его 2-3 раза в сутки; ингибирует патологическую секрецию многих гормонов и может применяться при различных патологических состояниях, включая випому, карциноидный синдром, низидиобластоз, гастриному, соматотропиному (акромегалия). Кроме того, опубликованы данные о применении октреотида при тиротропиноме, желудочном кровотечении, перфорирующей язве желудка, глюкагономе, диарее как у детей, так и у взрослых.
