
- •Лабораторная работа №3ф «Определение по ударному объёму крови сердца энергозатрат, кпд, расхода кислорода, при совершении механической работы»
- •Задачи.
- •«Определение по ударному объёму крови сердца энергозатрат, кпд , расхода кислорода, при совершении механической работы.»
- •1.1. Основные понятия гидродинамики. Условие неразрывности струи.
- •1.2. Уравнение Бернулли.
- •1)Наклонная трубка тока постоянного сечения.
- •2)Горизонтальная трубка тока жидкости переменного сечения.
- •3) Измерение скорости потока жидкости. Трубка Пито.
- •4) Закупорка артерии.
- •5) Разрыв аневризмы.
- •Факторы, влияющие на вязкость крови в организме.
- •1.7 Ламинарное и турбулентное течения. Число Рейнольдса. Условия проявления турбулентности в системе кровообращения.
- •1.8. Роль эластичности кровеносных сосудов в системе кровообращения. Пульсовая волна.
- •1.9 Методы измерения давления крови.
- •Инвазивный (прямой) метод измерения артериального давления.
- •9.1. Модели кровообращения
- •9.3. Работа и мощность сердца. Аппарат искусственного кровообращения
- •Внутреннее трение (вязкость) жидкости. Формула Ньютона.
- •Ньютоновские и неньютоновские жидкости.
- •1.4. Течение вязкой жидкости. Формула Пуазейля.
- •Факторы, влияющие на вязкость крови в организме.
- •1.5. Методы определения вязкости жидкости.
- •1.6 Реологические свойства крови, плазмы и сыворотки. Факторы, влияющие на вязкость крови в организме. Особенности течения крови в крупных и мелких сосудах
- •Дополнительный материал первое начало термодинамики и живые организмы
- •Определения основных термодинамических величин
- •Первое начало термодинамики
- •Свободная и связанная энергия
- •Обратимые и необратимые процессы
- •Источники свободной энергии живого организма и виды совершаемых им работ
- •Тепловой баланс организма, способы теплообмена
- •Температурный гомеостазис, химическая и физическая терморегуляция
- •Энерготраты организма, основной обмен
- •Понятие о физиологической калориметрии
- •Второе начало термодинамики понятие энтропии
- •Статистический смысл энтропии
- •Формулировка второго начала термодинамики
- •Диссипативная функция
- •Научное и практическое значение второго начала термодинамики
- •Второе начало термодинамики и живой организм
- •Стационарное состояние
Дополнительный материал первое начало термодинамики и живые организмы
Жизненные процессы при всем своем многообразии имеют и общие черты. Любой из них требует затрат энергии. Поэтому важным направлением биофизических исследований является изучение преобразований энергии в биологических системах. Процессы энергообеспечения организма за счет внешних энергетических ресурсов составляют предмет исследования биоэнергетики. В разработке биоэнергетических проблем можно выделить два подхода. Во-первых, исследуются механизмы энергетических процессов, протекающих в организме на молекулярном и субмолекулярном уровнях. Их изучение — одна из важнейших задач молекулярной и квантовой биофизики. С другой стороны, некоторые особенности биологических процессов изучаются на основе общих законов превращения энергии без детального изучения их молекулярных механизмов (говорят — на макроскопическом уровне). Это составляет содержание исследований в области биологической термодинамики.
Определения основных термодинамических величин
В термодинамике объектом исследования служит система, под которой понимают совокупность материальных объектов(тел), ограниченную в той или иной степени от окружающей среды. Различают изолированные системы, не обменивающиеся энергией и веществом с этой средой, иоткрытые системы,в которых такой обмен происходит. Живые организмы относятся к открытым системам.
Состояние любой системы характеризуется некоторыми параметрами. Одни из них не зависят от массы или числа частицв системе (иначе говоря, от размеров системы), другие пропорциональны этим аргументам. Первые получили название
интенсивных термодинамических параметров. К ним относятся давление, температура и т. п. Параметры второй группы называютсяэкстенсивными. Это объем, энергия, энтропия и др.
Энергию системы (W) можно представить состоящей из двух частей: Wк+п, которая зависит от движения и положения системы как целого, и U, не зависящей от этих факторов:
W= Wк+п + U. (1)
Вторую составляющую (U ) называют внутренней энергией системы. Она включает энергию теплового движения частиц, химическую энергию, ядерную энергию. В системах, химический состав которых в ходе энергетических преобразований остается неизменным, при вычислении внутренней энергии можно учитывать только энергию теплового движения и взаимодействия частиц. Такой системой является идеальный газ.
Из полной энергии системы (W) выделяют так называемую энтальпию: H=U+pV. При постоянном давлении изменение энтальпии равно количеству тепла, полученного системой:dH=dQ. Поэтому энтальпию иногда называют теплосодержанием.
Первое начало термодинамики
Первое начало термодинамики представляет собой одну из форм записи закона сохранения энергии. Оно было сформулировано независимо друг от друга Ю. Р. Майером (1842), Д. П. Джоулем (1843) и Г. Л. Гельмгольцем (1847). Двое из них (Майер и Гельмгольц) были врачами и, закладывая основы термодинамики, рассматривали преобразования энергии как в неживой природе, так и в биологических системах. Термодинамика с первых своих шагов была тесно связана с биологией и медициной. Закон сохранения энергии причисляется к трем великим открытиям XIX века.
Смысл первого начала термодинамики сводится к тому, что изменение внутренней энергии системы может произойти только при обмене энергией с окружающей средой. Энергетический обмен между системой и средой осуществляется двумя способами — посредством передачи тепла и путем совершения работы:
ΔU = Q - А или Q = ΔU + А. (2)
Эта формула и выражает первое начало термодинамики.
Нужно обратить внимание на знаки в формуле (2). Принято считать положительным то тепло, которое система получаетиз окружающей среды. Работу же считают положительной, когда система производит ее над окружающими телами. Например, когда газ, расширяясь, толкает поршень, работу считаем положительной; если же газ сжимается поршнем, то работу считаем отрицательной.
Остановимся на способах совершения работы. Как известно, механическая работа вычисляется по формуле dA = f dl. Однако это лишь частный случай. Формы совершения работы могутбыть весьма разнообразными:
dA=pdV —работа расширения газа;
dA = Udq —работа переноса заряда при разности потенциаловU;
dA=pосмdm/ρ -работа переноса вещества за счет осмотического давления;
dA = μxdv —работа, совершаемая при химической реакции.
В этих формулах f —сила (механическая), l — путь, пройденный системой,р—• давление,V — объем,q — электрический заряд, Роcм — осмотическое давление, m — масса, ρ — плотность, μxх— химический потенциал , v — число молей вещества, вступающих в реакцию.
Можно привести и другие аналогичные формулы. Все они имеют сходную структуру, так как отображают одно и то же — перемещение (перенос) какого-либо объекта под действием определенной причины (силы). Поэтому в общем виде можно написать
dA=Xdx или A =∫ Xdx, (4)
где х — так называемая обобщенная координата — величина, характеризующая перемещение (l) или перенос (V, q, m, v), a X —обобщенная сила — величина, характеризующая причинупереноса (f, ρ, U, росм, μxх).
Из приведенных примеров видно, что обобщенными силами всегда являются интенсивные величины, а обобщенные координаты относятся к экстенсивным величинам.
Если одновременно на систему действует несколько обобщенных сил (то есть процессы переноса ее компонентов происходят под влиянием нескольких причин), то формула (4) примет вид
dA = ΣXidxil или A = Σ ∫Xi dxi. (5)
Используя принятые обозначения, формулу (2) можно записать в виде
Q= ΔU + Σ ∫Xidxi (6)
то есть количество тепла, полученное системой, определяется изменением внутренней энергии системы, а также суммой всех видов работы, совершенных системой. Эту формулу можно считать наиболее общим выражением первого начала термодинамики.
Если обобщенные силы постоянны, то формула (6) упрощается:
Q = ΔU + ΣXidxi или ΔU =Q- Σ Xidxi (7)
Применение обобщенных координат и сил характерно для термодинамического подхода к характеристике того или иного явления, что позволяет рассматривать самые различные процессы с единой точки зрения. Изменение любой обобщенной координаты можно сопоставить с переносом электрическогозаряда, то есть с током. А ток легко генерировать, измерять, направлять в цепи, состоящие из элементов с разнообразными свойствами. Поэтому электрическими цепями удается моделировать процессы диффузии, осмоса,химические реакции, теплоперенос и т. д, причем не только по отдельности, аивсложных взаимных связях. Такое моделирование уже применяется в медицине — моделируются перенос крови в аппаратах для искусственного кровообращения, диффузия газов в приборах для автоматической декомпрессии водолазов после пребывания на глубине и т. д. Использование электрического тока для моделирования особенно перспективно в связи с внедрением в медицину электронных вычислительных машин.
Для усвоения смысла и содержания первого начала термодинамики рассмотрим его приложение к анализу процессов в идеальном газе. В этом случае из всех форм работы учитывается только одна — работа расширения газа:
Q= ΔU + ∫pdv. (8)
При изохорическом процессе v=const, ΔU =0. Поэтому A=0 и ΔU=0. При изобарическом процессе p=const. Следовательно,
Q= ΔU+p ΔV (9)
При изотермическом процессе Т = const. Из (8) получаем:
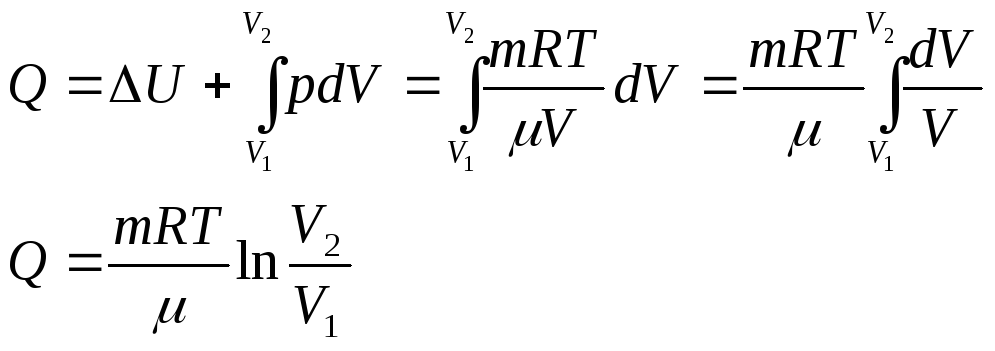
(учитывая, что ΔU = 0).(10)
Рассмотрим еще адиабатический процесс, при котором система не обменивается теплом с окружающей средой (Q=0), — процесс, протекающий в системе с идеальной теплоизоляцией. На первый взгляд, такие процессы редко встречаются в природе, но это не так. Передача тепла — относительно медленный процесс. Те процессы, которые протекают гораздо быстрее, чемтеплообмен, можно считать адиабатическими. К адиабатическим процессам относится любой взрыв Термодинамические процессы в организме спортсмена, бегущего стометровку, тоже можно считать адиабатическими, пренебрегая теплообменом, происходящим в течение десятка секунд.
Для адиабатического процесса
ΔU
=-A
или 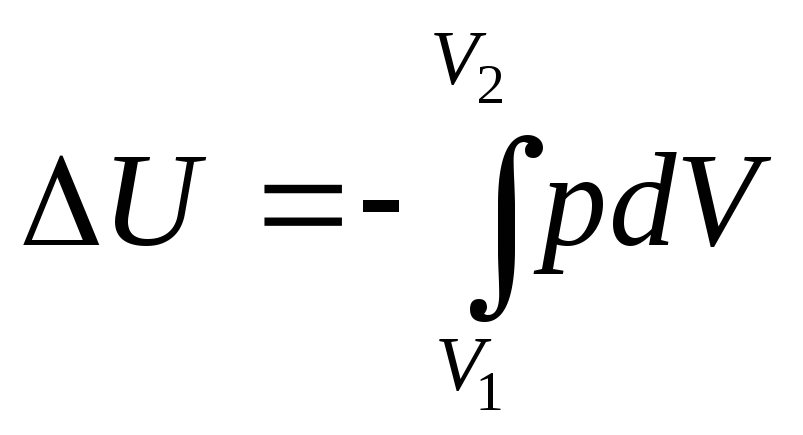
Из этой формулы следует, что при адиабатическом расширении газа (dV>0) его внутренняя энергия уменьшается, то есть газ охлаждается. Поэтому при сбросе давления в барокамере там становится холодно. Приадиабатическом сжатии газ нагревается.
