
- •Лабораторная работа №3ф «Определение по ударному объёму крови сердца энергозатрат, кпд, расхода кислорода, при совершении механической работы»
- •Задачи.
- •«Определение по ударному объёму крови сердца энергозатрат, кпд , расхода кислорода, при совершении механической работы.»
- •1.1. Основные понятия гидродинамики. Условие неразрывности струи.
- •1.2. Уравнение Бернулли.
- •1)Наклонная трубка тока постоянного сечения.
- •2)Горизонтальная трубка тока жидкости переменного сечения.
- •3) Измерение скорости потока жидкости. Трубка Пито.
- •4) Закупорка артерии.
- •5) Разрыв аневризмы.
- •Факторы, влияющие на вязкость крови в организме.
- •1.7 Ламинарное и турбулентное течения. Число Рейнольдса. Условия проявления турбулентности в системе кровообращения.
- •1.8. Роль эластичности кровеносных сосудов в системе кровообращения. Пульсовая волна.
- •1.9 Методы измерения давления крови.
- •Инвазивный (прямой) метод измерения артериального давления.
- •9.1. Модели кровообращения
- •9.3. Работа и мощность сердца. Аппарат искусственного кровообращения
- •Внутреннее трение (вязкость) жидкости. Формула Ньютона.
- •Ньютоновские и неньютоновские жидкости.
- •1.4. Течение вязкой жидкости. Формула Пуазейля.
- •Факторы, влияющие на вязкость крови в организме.
- •1.5. Методы определения вязкости жидкости.
- •1.6 Реологические свойства крови, плазмы и сыворотки. Факторы, влияющие на вязкость крови в организме. Особенности течения крови в крупных и мелких сосудах
- •Дополнительный материал первое начало термодинамики и живые организмы
- •Определения основных термодинамических величин
- •Первое начало термодинамики
- •Свободная и связанная энергия
- •Обратимые и необратимые процессы
- •Источники свободной энергии живого организма и виды совершаемых им работ
- •Тепловой баланс организма, способы теплообмена
- •Температурный гомеостазис, химическая и физическая терморегуляция
- •Энерготраты организма, основной обмен
- •Понятие о физиологической калориметрии
- •Второе начало термодинамики понятие энтропии
- •Статистический смысл энтропии
- •Формулировка второго начала термодинамики
- •Диссипативная функция
- •Научное и практическое значение второго начала термодинамики
- •Второе начало термодинамики и живой организм
- •Стационарное состояние
Понятие о физиологической калориметрии
Для определения энерготрат организма необходимо измерять количество тепла, выделяемое им в окружающую среду за определенный промежуток времени. Для этого применяют два метода: прямую и непрямую калориметрию.
В методе прямой калориметрии используются специальные физиологические калориметры, сконструированные так, что в них можно помещать на нужное время животных или человека. Первый калориметр для человека был создан в Военно-медицинской академии В. В. Пашутиным в конце прошлого века. Этот прибор, весьма совершенный даже по сегодняшним меркам, позволял с большой точностью измерять энерготраты человека;на нем были выполнены важные исследования биоэнергетики в норме и патологии. Аналогичные, но более совершенные установки существуют и сейчас. Однако далеко не всегда удается осуществлять прямую калориметрию, особенно при изучении энерготрат в ходе трудовой деятельности (у летчика во время полета или у танкиста на марше).
Чаще используют непрямую калориметрию. Метод основан на исследовании газообмена организма.
Установлено, что между объемом потребленного биологической системой кислорода и энерготратами существует линейная зависимость (при данных конкретных условиях). Коэффициентом в ней служит так называемый калорический эквивалент кислорода, равный количеству тепла, образующемуся в организме при использовании 1 л кислорода для окисления питательных веществ. Калорический эквивалент неодинаков при окислении жиров, углеводов и белков О том, какие вещества преимущественно окисляются в каждом конкретном случае, судят по так называемому дыхательному коэффициенту — ДК (он равен отношению объемов выделенного CO2 и поглощенного 02.
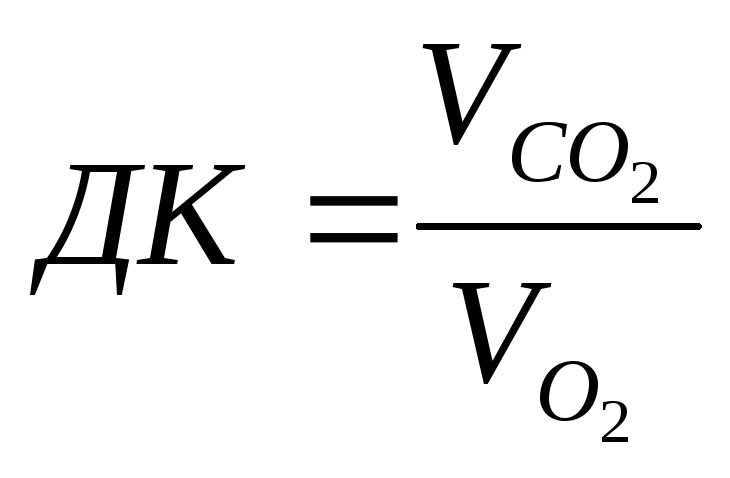
Так, при преимущественном окислении углеводов он стремится к 1, а при окислении жиров имеет самые низкие значения — около 0,7. Существуютспециальные таблицы и номограммы, при помощи которых можно определить величину калорического эквивалента по найденному значению ДК.
Посредством газоанализа измеряют объемы поглощенного O2 и выделенного СО2 (за одно и то же время). Взяв отношение второго к первому, рассчитывают ДК, а по нему находят калорический эквивалент. Умножив его на Vo , определяют энерготраты за время эксперимента.
Непрямая калориметрия проще в реализации, ее можно применять в больнице, в полевых условиях, на любом объекте военной техники Однако в некоторых случаях в организме изменяется характер окислительно-восстановительных процессов (например, резко усиливается анаэробный синтез АТФ). Тогда непрямая калориметрия дает неправильные результаты. Одновременное проведение прямой и непрямой калориметрии с анализом расхождений между ними позволяет зачастую понять смысл происходящих в организме нарушений метаболической активности.
Метод прямой калориметрии изучается в курсе биофизики, а с непрямой калориметрией студенты-медики знакомятся по традиции на кафедре нормальной физиологии.
Второе начало термодинамики понятие энтропии
Тепловая энергия, образующаяся в организме, представляет собой конкретную форму связанной энергии биологической системы, так как в условиях жизнедеятельности она не может быть преобразована ни в одну из форм работ, совершаемых организмом. Чем же определяется связанная энергия?
Вспомним, что Wсвяз зависит от степени неупорядоченности молекулярного движения, а ее количественной мерой служит температура. Поэтому Wсвяз пропорциональна Т. Однако величина связанной энергии в разных системах, имеющих одинаковую температуру, не всегда одинакова. Следовательно, степень неупорядоченности молекулярного движения зависит не только от температуры, но и от еще каких-то свойств системы. Этисвойства Клаузиус (1865) выразил в виде коэффициента, который однозначно связывает значения Wсвяз и Т. Коэффициент принято обозначать буквой s и называть энтропией. С вводом энтропии зависимость связанной энергии системы от ее температуры выглядит так:
Wсвяз= sT (1)
откуда
![]() (2)
(2)
Энтропия —это физическая величина, характеризующая значение связанной энергии данной системы, приходящееся на единицу температуры (1 К).
Так как Wсвяз =sT, то выражение для внутренней энергии системы приобретает такой вид:
U=G+sT '(3)
откуда
G = U-sT. (4)
Более строгое рассмотрение показывает, что эта формула справедлива только при постоянной температуре и постоянном объеме. В других условиях, например, при постоянной температуре, но изменяющемся объеме, выражение для свободной энергии имеет более сложный вид:
G = U — sT + pV. (5)
Для изобарических процессов при постоянной температуре можно пользоваться формулой (4). В этом случае свободную энергию обычно обозначают буквой F и называют свободной энергией по Гельмгольцу, тогда как величину G, определяемую по формуле (5), принято называть свободной энергией по Гиббсу.
В; организме человека температура постоянна, а изменения объема, как правило, невелики. Поэтому при рассмотрении большинства жизненных процессов можно пользоваться понятием свободной энергии по Гельмгольцу (F). В биохимии зачастую рассматривают процессы, связанные с выделением или поглощением газов (кислород, углекислый газ и др.); так какобъем газа при этом меняется, применяют понятие свободной энергии по Гиббсу (G).
Практический интерес представляет не сама по себе свободная энергия, а ее изменение. ПриV—constиT=const
ΔF=ΔU-TΔs(6)
Если объем изменяется, то изменение свободной энергии определяется по формуле
ΔG=ΔU-TΔs+pΔV(7)
Говоря о запасе энергии в какой-либо системе, интересуются прежде всего тем, какую работу она может совершить. Ясно, что при этом следует учитывать не полную, а только свободную энергию. Пищевые продукты важны для человека потому, что он получает при их усвоении свободную энергию для совершения работы. В ванне горячей воды содержится больший запас энергии, чем в килограмме хлеба, но за счет ее организм, погруженный в ванну, не способен совершить работу, так как почти вся эта энергия является связанной.
Таким образом, энергия в различных формах имеет разную практическую ценность, которая тем выше, чем большую часть этой энергии можно преобразовать в работу, то есть чем меньше доля связанной энергии, мерой которой служит энтропия. Следовательно, чем ниже энтропия системы, тем выше ценность свойственной ей внутренней энергии.
Выше говорилось, что превращение свободной энергии в связанную называют диссипацией (рассеянием) энергии. Нетрудно понять, что таким превращением сопровождается любое преобразование более ценной формы энергии в менее ценную. Например, преобразование химической энергии, заключенной в биологических макромолекулах, в тепловую есть диссипация энергии.
Энтропия является функцией состояния системы. Это означает, что величина энтропии целиком определяется параметрами системы в данный момент и совершенно не зависит от ее«истории», то есть от того, как система пришла в данное состояние. Функцией состояния являются и некоторые другие физические величины, например, потенциальная энергия: ее значение зависит только от высоты, на которую поднято тело, но не от того, каким путем оно достигло этой высоты. А вот количество тепла не является функцией состояния системы: зная,например, что литр воды находится при температуре 303 К, мы ничего не можем сказать о том, какое количество тепла получила или отдала вода. Чтобы ответить на этот вопрос, нужно знать, во-первых, исходное состояние и, во-вторых, как именно протекал процесс изменения температуры, в частности, совершалась при этом работа или нет.
Рассмотрим теперь как практически можно вычислить значение энтропии. Согласно положениям термодинамики, изменение энтропии при элементарном обратимом процессе определяется выражением
![]() (8)
(8)
или, при обратимом переходе из некоторого состояния (1) в состояние (2):
![]()
Может показаться, будто эти формулы не имеют практического значения, поскольку все реальные процессы необратимы.Однако ими успешно пользуются и практических расчетах. Дело в том, что Δs1-2 всегда одно и то же, независимо от процесса, посредством которого осуществлен переход системы (1)в состояние (2), так как энтропия — функция состояния. Поэтому расчеты, проведенные применительно к обратимому процессу, оказываются правильными и для необратимого процесса, но их гораздо проще выполнять.
Найдем, например, изменение энтропии при нагревании воды от 293 К до 373 К Это необратимый процесс, Так как в ходе его неизбежны потери энергии за счет утечки тепла в окружающую среду, создания конвекционных потоков и т. д. Однако при вычислении энтропии этим можно пренебречь и использовать формулы, отображающие изменения энтропии при обратимом процессе:
![]()
![]()
где С — удельная теплоемкость воды. Подставляя числа, получаем:
Δs=1 кг 4180 Дж кг-1 К-1 ln (373/293)≈1220 Дж К-1 (10)
Так как энтропия — функция состояния, то изменение энтропии будет таким же и в реальном необратимом процессе, хотя затраченное количество тепла будет фактически больше, чем при обратимом процессе.
Зная изменение энтропии, легко подсчитать изменение свободной энергии системы как по Гельмгольцу, так и по Гиббсу(формулы 4, 5).
При выяснении понятия энтропии учащиеся нередко задают вопрос: есть ли смысл вводить это понятие, если энтропия выражается через Q и Т, не проще ли прямо выражать свободную энергию через количество тепла? Такой вопрос возникает лишь в том случае, если не учитывать, что количество тепла, которое система получила или отдала, сильно зависит от способа перехода ее из одного состояния в другое, тогда как энтропия как функция состояния не зависит от этого. Поэтому на практике проще вычислить изменение энтропии. Такой расчетпозволяет отвлечься от протекания процесса и учитывать только начальное и конечное состояние системы.
Кроме того, понятие энтропии имеет огромное теоретическое значение. Энтропия является физической величиной, количественно характеризующей те особенности молекулярного строения системы, от которых зависят энергетические преобразованияв ней, в частности их направление (греческое слово εντρωπα переводится на русский язык как превращение, развитие, эволюция, поворот). Эту связь энтропии с молекулярной структурой системы понял Л. Больцман, установивший ее статистический смысл.
