
- •5.21. Через 224 г 20%-ного раствора гидроксида калия пропустили 13,44 л (н. У.) оксида серы (IV). Вычислите массы солей в полученном растворе.
- •5.27. 32,5 Г цинка растворили в 240 г 20%-ного раствора гидроксида натрия. К полученному раствору добавили 204,4 г 25%-ной соляной кислоты. Определите массу полученного осадка.
- •6.13. Какой объем хлора (н. У.) выделяется при взаимодействии 63,2 г перманганата калия с избытком концентрированной соляной кислоты, если выход продукта реакции составляет 87,5%?
- •4. Напишите уравнения реакций, соответствующие следующей схеме:
- •2.50. Вычислите массовую долю сульфида меди (II) в руде, если известно, что из 800 кг руды можно получить 250 кг меди.
- •4.5. Какой объем хлора (н. У.) прореагирует с 112 г смеси железа и меди, массовая доля железа в которой 65%?
- •4.8. Смесь оксида и сульфида цинка массой 114,9 г обработали избытком соляной кислоты. При этом выделилось 13,44 л (н. У.) газа. Определите массовую долю оксида цинка в смеси (в %).
- •4.13. 25 Г сплава магния с алюминием обработали избытком раствора гидроксида натрия. Вычислите объем выделившегося водорода (н. У.), если массовая доля алюминия в сплаве 43,2%
- •4.18. Газ, выделившийся при обработке 26,1 г оксида марганца (IV) избытком концентрированной соляной кислоты, пропустили через раствор иодида калия. Определите массу выделившегося при этом иода.
- •4.19. Газ, выделившийся при сгорании 10 г угля, был поглощен раствором гидроксида бария, при этом образовалось 147,75 г осадка. Какова массовая доля негорючих примесей в угле?
- •5.5. Каков состав и какова масса соли, которая образуется при пропускании 26,88 л (н. У.) углекислого газа через 210 г раствора с массовой долей гидроксида калия 24%?
- •5.13. Через 68 г 4%-ного раствора сероводородной кислоты h2s пропустили газ, образовавшийся при сжигании 0,96 г серы в избытке кислорода. Какова масса образовавшегося осадка?
- •5.17. Газ, полученный при обработке 26,4 г сульфида железа (II) 73 г 20%-ной соляной кислоты, пропустили через 198,6 г 25%-ного раствора нитрата свинца (II). Определите массу образовавшегося осадка.
4. Напишите уравнения реакций, соответствующие следующей схеме:
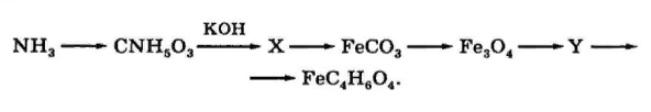
NH3 + H2CO3 = NH4HCO3
NH4HCO3 + 2KOH = K2CO3 + NH3↑ + 2H2O
K2CO3 + Fe(NO3)2 = FeCO3↓ + 2KNO3
3FeCO3 = Fe3O4 + 2CO2 + CO
Fe3O4 + CO = 3FeO + CO2
FeO + 2CH3COOH = (CH3COO)2Fe + H2O
6. На образец красного фосфора массой 11,16 г подействовали хлором, который занимал 15,4 л при температуре 20 °С и нормальном давлении. К полученной жидкости добавили 500 г 18%-ного раствора гидроксида натрия. Рассчитайте состав образовавшегося раствора (в массовых долях).
n(P) = 11,16/31 = 0,36 моль
n(Cl2) = 15,4*101,3/(8,314*293) = 0,64 моль
n(P)/n(Cl2) = 9/16
3/2 < n(P)/n(Cl2) < 5/2
Образовалась смесь пента- и трихлорида фосфора.
2P + 3Cl2 = 2PCl3
2P + 5Cl2 = 2PCl5
 Пусть
образовалось x
моль PCl3
и y
моль PCl5.
Пусть
образовалось x
моль PCl3
и y
моль PCl5.
x + y = 0,36
(3/2)x + (5/2)y = 0,64
x = 0,36 – y
0,54 – 1,5y + 2,5y = 0,64
y = 0,1
x = 0,26
n(NaOH) = 500*0,18/40 = 2,25 моль
PCl3 + 5NaOH = Na2(PHO3) + 3NaCl + 2H2O
PCl5 + 8NaOH = Na3PO4 + 5NaCl + 4H2O
n(Na2(PHO3)) = x = 0,26 моль
n(Na3PO4) = y = 0,1 моль
n(NaCl) = 3x + 5y = 1,28 моль
n(NaOH) = 2,25 – 5x – 8y = 0,15 моль
m(Na2(PHO3)) = 0,26*126 = 32,76 г
m(Na3PO4) = 0,1*164 = 16.4 г
m(NaCl) = 1,28*58,5 = 74,88 г
m(NaOH) = 0,15*40 = 6 г
m(р-ра) = 500 + 0,36*31 + 0,64*71 = 556,6 г
ω(Na2(PHO3)) = (32,76/556,6)*100% = 5,89%
ω(Na3PO4) = (16.4/556,6)*100% = 2,95%
ω(NaCl) = (74,88/556,6)*100% = 13,44%
ω(NaOH) = (6/556,6)*100% = 1,08%
Ответ: ω(Na2(PHO3)) = 5,89%; ω(Na3PO4) = 2,95%; ω(NaCl) = 13,44%; ω(NaOH) = 1,08%
6. К 25,7 г смеси сульфида меди (I) и сульфида цинка при нагревании добавили 191,6 мл 60%-ного раствора азотной кислоты (плотность 1,37 г/мл). Выделилось 42,5 л бурого газа (27 °С, 105,6 кПа). Раствор обработали избытком водного раствора гидроксида натрия. Рассчитайте массу образовавшегся осадка и массовые доли веществ в исходной смеси.
Cu2S + 14HNO3 = 2Cu(NO3)2 + H2SO4 + 10NO2↑ + 6H2O
ZnS + 10HNO3 = Zn(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
n(HNO3) = (191,6*1,37*0,6)/63 = 2,5 моль
n(NO2) = 42,5*105,6/(8,314*300) = 1,8 моль
Пусть в смеси было x моль Cu2S и y моль ZnS. Тогда:
 25,7
= 160x
+ 97y
25,7
= 160x
+ 97y
1,8 = 10x + 8y
x = 0,18 – 0,8y
25,7 = 28,8 – 128y + 97y
y = 0,1
x = 0,1
n(HNO3 необх.) = 14*0,1 + 10*0,1 = 2,4 моль
HNO3 действительно в избытке.
Cu(NO3)2 + 2NaOH = Cu(OH)2↓
Zn(NO3)2 + 4NaOH = Na2[Zn(OH)4] + 2NaNO3
HNO3 + NaOH = NaNO3 + H2O
H2SO4 + 2NaOH = Na2SO4 + 2H2O
m(Cu(OH2)) = 0,1*2*98 = 19,6 г
m(Cu2S) = 0,1*160 = 16 г
ω(Cu2S) = (16/25,7)*100% = 62,3%
ω(ZnS) = 100 – 62,3 = 37,7%
Ответ: 19,6 г Cu(OH)2; ω(Cu2S) = 62,3%, ω(ZnS) = 37,7%
7. К 8,8 г 20%-ного раствора пропанола-2 в этилацетате добавили 50 мл 8 М раствора гидроксида калия. Полученную смесь упарили, а сухой остаток прокалили. Определите массовые доли веществ в остатке после прокаливания.
CH3COOC2H5 + KOH = CH3COOK + C2H5OH
n(CH3COOC2H5) = 8,8*0,8/88 = 0,08 моль
n(KOH) = 8*0,05 = 0,4 моль.
Образуется 0,08 моль CH3COOK. Остается 0,4 – 0,08 = 0,32 моль KOH. Далее С2H5OH и С3H7OH улетучиваются.
CH3COOK + KOH = K2CO3 + CH4↑
Образуется 0,08 моль K2CO3. Остается 0,32 – 0,08 = 0,24 моль KOH.
m(K2CO3) = 0,08*138 = 11,04 г
m(KOH) = 0,24*56 = 13,44 г
ω(K2CO3) = (11,04/(11,04 + 13,44))*100% = 45,1%
ω(KOH) = 100 – 45,1 = 64,9%
Ответ: ω(K2CO3) = 45,1%, ω(KOH) = 64,9%
4. Через 504 г 10%-ного раствора гидроксида калия было пропущено 17,2 л оксида серы (IV) при давлении 101,5 кПа и температуре 27 °С. Вычислите массовые доли веществ в полученном растворе.
n(KOH) = 504*0,1/56 = 0,9 моль
n(SO2) = 17,2*101,5/(8,314*300) = 0,7 моль
SO2 + 2KOH = K2SO3 + H2O
SO2 + KOH = KHSO3
Пусть в первую реакцию вступило x моль SO2, а во вторую – y моль SO2. Тогда:
 0,7
= x
+ y
0,7
= x
+ y
0,9 = 2x + y
x = 0,2
y = 0,5
m(K2SO3) = x*158 = 31,6 г
m(KHSO3) = y*120 = 60 г
m(р-ра) = 504 + 0,7*64 = 548,8 г
ω(K2SO3) = (31,6/548,8)*100% = 5,8%
ω(KHSO3) = (60/548,8)*100% = 10,9%
Ответ: ω(K2SO3) = 5,8%, ω(KHSO3) = 10,9%
8. Составьте уравнения реакций в соответствии со схемой
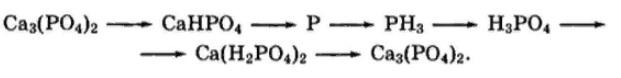
Ca3(PO4)2 + H3PO4 = 3CaHPO4
CaHPO4 + 5C + 2SiO2 = 2P↑ + 2CaSiO3 + 5CO↑ + H2O↑
4P + 3NaOH + 3H2O = PH3↑ + 3NaH2PO2
PH3 + 2O2 = H3PO4
2H3PO4 + Ca(OH)2 = Ca(H2PO4)2 + 2H2O
3Ca(H2PO4)2 + 12KOH = Ca3(PO4)2 + 4K3PO4 + 12H2O
6. Смесь сероводорода и неизвестного алкана, взятых в объемном соотношении 1 : 3, сожжена, и продукты сгорания полностью поглощены избытком водного раствора гидроксида бария. В результате выпало 19,9 г осадка, масса которого при обработке избытком раствора перманганата калия, подкисленного азотной кислотой, уменьшилась до 2,33 г. Установите формулу алкана и напишите уравнения упомянутых реакций.
H2S + 1,5O2 = SO2 + H2O
CnH2n+2 + (1,5n + 0,5)O2 = nCO2 + (n+1)H2O
Ba(OH)2 + SO2 = BaSO3↓ + H2O
Ba(OH)2 + CO2 = BaCO3↓ + H2O
5BaSO3 + 2KMnO4 + 6HNO3 = 5BaSO4↓ + 2Mn(NO3)2 + 2KNO3 + 3H2O
BaCO3 + 2HNO3 = Ba(NO3)2 + CO2↑ + H2O
Пусть было сожжено x моль H2S (и, соответственно, 3x моль алкана). Тогда:
 19,9
= x*217
+ 3nx*197
19,9
= x*217
+ 3nx*197
2,33 = x*233
x = 0,01
n = (19,9 – 2,17)/(0,03*197) = 3
Ответ: C3H8
5. Расшифруйте схему превращений. Напишите соответствующие уравнения реакций:

C2H5COONa + NaOH = C2H6 + Na2CO3
C2H6 + Cl2 = C2H5Cl + HCl (hν)
C2H5Cl + NaOH (H2O) = C2H5OH + NaCl
5C2H5OH + 4KMnO4 + 6H2SO4 = 5CH3COOH + 4MnSO4 + 2K2SO4 + 11H2O
CH3COOH + Cl2 = ClCH2COOH + HCl (hν)
ClCH2COOH + 2NH3 (H2O) = NH2CH2COOH + NH4Cl
6. 24,5 г соединения, содержащего 31,84% калия, 28,98% хлора и 39,18% кислорода по массе, нагрели до температуры выше 130 °С с 12,8 г серы. Выделившийся в результате газ пропустили через 256,5 г 10%-ного раствора гидроксида бария. Определите состав полученного раствора (в массовых долях).
31,84/39 : 28,98/35,5 : 39,18/16
0,8 : 0,8 : 2,44
Чтобы найти целое число делим на наименьшее
0,8/0,8 : 0,8/0,8 : 2,44/0,8
1:1:3
KClO3 (Хлорат калия)
2KClO3 + 3S = 3SO2↑ + 2KCl (T >130°С)
n(KClO3) = 24,5/122,5 = 0,2 моль
n(S) = 12,8/32 = 0,4 моль
KClO4 в недостатке.
n(SO2) = 0,2*(3/2) = 0,3 моль
V(SO2) = 0,3*22,4 = 6,72 л
Ba(OH)2 + SO2 = BaSO3↓ + H2O
SO2 + H2O = H2SO3
m(Ba(OH)2) = 256,5*0,1 = 25,65 г
n(Ba(OH)2) = 25,65/171 = 0,15 моль
Ba(OH)2 в недостатке. В полученном растворе содержится только H2SO3.
m(H2SO3) = (0,3 – 0,15)*82 = 12,3 г
m(р-ра) = 256,5 + 0,3*64 – 0,15*217 = 243,15 г
ω(H2SO3) = (12,3/243,15)*100% = 5,06%
Ответ: ω(H2SO3) = 5,06%
1-72. Медные руды считались богатыми, если содержали более 2% меди , и бедными, если содержали от 0,5 до 1% меди по массе. К богатым или бедным относятся руды, содержащие: а) 2,5% халькопирита CuFeS2; б) 3% борнита Cu5FeS4; в) 2,5% куприта Cu2O; г) 3% халькозина Cu2S?
a) ω(Cu) = (0,025*64/184)*100% = 0,9%
б) ω(Cu) = (0,03*5*64/504)*100% = 1,9%
в) ω(Cu) = (0,025*2*64/146)*100% = 2,2%
г) ω(Cu) = (0,03*2*64/160)*100% = 2,4%
Ответ: а) к бедным; б) ни к тем, ни к другим; в) к богатым; г) к богатым.
2-48. Какой объем воздуха требуется по расчету для полного сгорания 1 кг антроцита следующего состава (в % по массе): углерода – 96, водорода – 2, кислорода – 1 и азота – 1?
C + O2 = CO2
2H + 0,5O2 = H2O
2N + 2O2 = 2NO2
n(C) = 0,96*1000/12 = 80 моль
n(H) = 0,02*1000/1 = 20 моль
n(N) = 0,01*1000/14 = 0,71 моль
n(O2) = 80 + (0,5/2)*20 + 0,71 = 85,71 моль
V(O2) = 85,71*22,4 = 1919,904 л
Кислорода в воздухе 21%.
V(воздуха) = 1919,904*100/21 = 9142,4 л
Ответ: 9142,4 л
2-47. Уголь сожжен в четырехкратном объеме воздуха по сравнению с теоретически необходимым. Рассчитайте состав образовавшейся смеси (в объемных долях).
С + О2 = СО2
В воздухе по объему содержится 78% азота, 21% кислорода и 1% других газов, включая СО2.
Пусть х л - теоретический объем воздуха. Тогда 4х л - практический объем воздуха. При горении прореагировало 0,21х л О2. Образовалось 0,21х л СО2.
Объем смеси остался прежним. Значит, и процентное содержание N2 и других газов осталось прежним.
Осталось 0,21*(4-1)x л кислорода. Объемная доля кислорода составляет (0,21*3x/4x)*100% = 15,75%
Объемная доля CO2: (0,21x/4x)*100% = 5,25%
Ответ: 78% N2, 15,75% O2, 5,25% CO2
2-64. Бытовая газовая плита потребляет за 1 ч 250 л пропан-бутановой смеси, состоящей из 96% пропана, 3% бутана, 1% паров воды и негорючих примесей по объему. Сколько времени на кухне размером 3 x 3 x 3 м может постоянно работать газовая плита, пока концентрация углекислого газа не достигнет опасного для здоровья значения? (Предельно допустимая концентрация ПДКco2 = 30 г/м3. Считать, что помещение не вентилируется.)
C3H8 + 5O2 = 3CO2 + 4H2O
C4H10 + 6,5O2 = 4CO2 + 5H2O
V(кухни) = 27 м3
m(CO2 предел.) = 27*30 = 810 г
V(CO2 предел.) = (810/44)*22,4 = 412,4 л
x л – объем потребленной за это время пропан-бутановой смеси
412,4 = 3*0,96x + 4*0,03x = 3x
x = 137,5
t = 137,5/250 = 0,55 ч = 33 мин
Ответ: 33 мин
3-34. В стакан налили 100 г 35%-й соляной кислоты. Через некоторой время объем испарившегося хлороводорода составил 224 мл (н. у.). Вычислите, на сколько понизилась массовая доля хлороводорода в соляной кислоте (испарением воды в данной задаче можно пренебречь).
m(HCl исп.) = (0,224/22,4)*36,5 = 0,365 г
ω(HCl новая) = 100%*(35 – 0,365)/(100 – 0,365) = 34,76%
∆ω = 35 - 34,76 = 0,24%
Ответ: на 0,24%
3-86. Оксид азота (II) объемом 4,48 л пропустили через 10%-й раствор гидроксида калия массой 140 г. Вычислите массовые доли веществ в растворе после реакции.
2NO2 + 2KOH = KNO2 + KNO3 + H2O
n(NO2) = 4,48/22,4 = 0,2 моль
n(KOH) = 140*0,1/56 = 0,25 моль.
KOH в избытке. Остаток – 0,25 – 0,2 = 0,05 моль KOH.
n(KNO2) = n(KNO3) = 0,2/2 = 0,1 моль
m(р-ра) = 140 + 0,2*46 = 149,2 г
ω(KNO2) = (0,1*85/149,2)*100% = 5,7%
ω(KNO3) = (0,1*101/149,2)*100% = 6,8%
ω(KOH) = (0,05*56/149,2)*100% = 1,9%
Ответ: ω(KNO2) = 5,7%, ω(KNO3) = 6,8%, ω(KOH) = 1,9%
4-11. На основании термохимического уравнения разложения карбоната кальция:
CaCO3 (тв.) = CaO (тв.) + CO2 (г.) (∆Ho = 157 кДж)
рассчитайте, какая масса карбоната кальция подверглась разложению, если в ходе ракции было затрачено: а) 31,4 кДж; б) 78,5 кДж; в) 3120 кДж теплоты.
1 моль CaCO3 – 100 г
100 г – 157 кДж
x г - …кДж
x = …*100/157
Подставляем данные значения теплоты в полученную пропорцию
a) x = 31,4*100/157 = 20
б) x = 78,5*100/157 = 50
в) x = 3120*100/157 = 1987,3
Ответ: а) 20 г; б) 50 г; в) 2 кг
4-12. На основании термохимического уравнения горения фосфора:
4P (тв.) + 5O2 (г.) = 2P2O5 (тв.) (∆H = -3010 кДж)
рассчитайте массу сгоревшего фосфора, если в результате реакции выделилось: а)75,25 кДж; б) 307 кДж; в) 45150 кДж теплоты.
4 моль фосфора – 124 г
124 г – 3010 кДж
x г - … кДж
x = …*124/3010
Подставляем данные значения теплоты в полученную пропорцию
a) x = 75,25*124/3010 = 3,1
б) x = 307*124/3010 = 12,6
в) x = 45150*124/3010 = 1860
Ответ: а) 3,1 г; б) 12,6 г; в) 1,86 кг
4-13. На основании термохимического уравнения горения ацетилена:
2С2H2 (г.) + 5O2 (г.) = 4CO2 (г.) + 2H2O (ж.) (∆H = -2610 кДж)
вычислите количества теплоты, которое выделится при сгорании ацетилена: а) массой 2,6 г; б) объемом 56 л (н. у.).
2 моль ацетилена – 52 г, 22,4*2 = 44,8 л
а) 52 г – 2610 кДж
2,6 г - x кДж
x = 2,6*2610/52 = 130,5
б) 44,8 л – 2610 кДж
56 л – x кДж
x = 3262,5
Ответ: а)130,5 кДж; б)3262,5 кДж
7-62. Кусочек натрия массой 4,6 г добавили к 200 г воды. Вычислите массовую долю и молярную концентрацию гидроксида натрия в растворе после реакции. (Плотность раствора примите равной 1,0 г/см3.)
n(Na) = 4,6/23 = 0,2 моль
2Na + 2H2O = 2NaOH + H2↑
m(NaOH) = 0,2*40 = 8 г
m(р-ра) = 4,6 + 200 – (0,2/2)*2 = 204,4 г
ω(NaOH) = (8/204,4)*100% = 3,9%
V(р-ра) = 204,4/1 = 204,4 мл
204,4 мл - 0,2 моль
1000 мл - x моль
x = 0,2*1000/204,4 = 0,98 ≈ 1 моль
Ответ: 3,6%, 1 моль/л
7-63. Оксид кальция массой 0,56 г добавили к 500 г воды. Вычислите массовую долю гидроксида кальция в растворе. (Плотность раствора примите равной 1,0 г/см3.)
n(СaO) = 0,56/56 = 0,01 моль
СaO + H2O = Сa(OH)2
m(Ca(OH)2) = 0,01*74 = 0,74 г
m(р-ра) = 0,56 + 500 = 500,56 г
ω(Ca(OH)2) = (0,74/500,56)*100% = 0,15%
Ответ: 0,15%
7-181. В результате обжига образца сульфида цинка массой 485 г образовалось 256 г сернистого газа. Рассчитайте массовую долю примесей в образце сульфида цинка.
ZnS + 1,5O2 = ZnO + SO2↑
n(SO2) = 256/64 = 4 моль
m(ZnS) = 4*97 = 388 г
ω(примесей) = ((485 – 388)/485)*100% = 20%
Ответ: 20%
