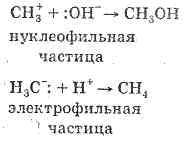- •Билет № 31
- •Билет № 32
- •1. Водородные связи в органических молекулах. Участие водородных связей в формировании вторичной структуры белков и нуклеиновых кислот.
- •2. Фенолокислоты. Способы введения гидрокси- и карбоксигруппы в ароматическое ядро. Эфиры и соли салициловой кислоты, их медицинское значение. Паск.
- •3. Окислительно-восстановительные реакции моносахаридов. Биологическая роль.
- •Вопрос 3
- •1. Пространственное строение органических молекул. Конфигурации и конформации. Примеры.
- •2. Органические соединения, содержащие только связи с-с и с-н: алканы, циклоалканы. Строение и реакционная способность.
- •Реакции радикального замещения Галогенирование
- •Билет № 35
- •4. Напишите формулу карбонильного соединения, которое обесцвечивает бромную воду (в присутствии железа), нитруется и восстанавливает серебро из аммиачного раствора серебра
- •4. Напишите структурную формулу аминокислоты состава c6h13o2n, если известно, что она взаимодействует с 1 молем формалина и на титрование продукта реакции идет эквивалентно 1 моль NaOh.
- •1. Кислотности органических соединений по Бренстеду-Лоури. О-н и s-h "кислоты".
- •2. Органические соединения, содержащие карбонильную группу: альдегиды, кетоны. Строение и реакционная способность. Реакции, приводящие к образованию карбонильной группы.
- •Билет № 38
- •1. Классификация органических реакций по механизму, примеры.
- •2. Многоатомные спирты и многоатомные фенолы. Строение и реакционная способность. Качественные реакции.
- •3. Фосфолипиды. Строение, гидролиз, биологическая роль.
- •4. Осуществите превращения: 2,2-диметилпропан → 1,1-дихлор-2,2-диметилпропан → 2,2‑диметилпропаналь → гидросульфитное производное 2,2-диметилпропаналя.
- •3. Лактоза и мальтоза. Их строение и свойства, α- и β-гликозидная связь.
- •4. Составьте и назовите пептиды из аланина, серина, пролина.
4. Напишите структурную формулу аминокислоты состава c6h13o2n, если известно, что она взаимодействует с 1 молем формалина и на титрование продукта реакции идет эквивалентно 1 моль NaOh.
Изолейцин
БИЛЕТ № 37
1. Кислотности органических соединений по Бренстеду-Лоури. О-н и s-h "кислоты".
Согласно Бренстеду-Лоури, для того чтобы быть кислотой, соединение должно иметь водород.
Кислотность: H - CH3 < H - NH2 < H - OH < H - F,
По природе кислотного центра большинство бренстедовских кислот может быть представлено четырьмя типами: ОН-кислоты (карбоновые кислоты, фенолы, спирты), SH-кислоты (тиолы), NH-кислоты (амины, амиды, имиды), CH-кислоты (углеводороды и их производные).
Известно, что в ряду ОН-кислот кислотные свойства убывают в следующем порядке: карбоновые кислоты > фенолы > спирты.
Легко понять, что введение в радикал у кислотного центра электроноакцепторных заместителей будет способствовать повышению кислотности всех типов кислот.
Влияние электронных факторов на основность органических соединений для кислот: электронодонорные заместители у основных центров будут усиливать основность, акцепторные - ее понижать.
2. Органические соединения, содержащие карбонильную группу: альдегиды, кетоны. Строение и реакционная способность. Реакции, приводящие к образованию карбонильной группы.
Реакции нуклеофильного присоединения. Альдегиды и кетоны, обладая электрофильным центром, способны вступать во взаимодействие с нуклеофильными реагентами. Для оксосоединений наиболее характерны реакции, протекающие по механизму нуклеофильного присоединения, обозначаемому AN (от англ. addition nucleophilic).
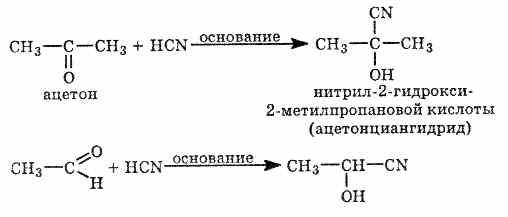
Реакция с циановодородной (синильной) кислотой.
СН3—СН=O + Н—CN -> СН3—CH(CN)—ОН
+HCN=+Br2=карбонильноая группа
Взаимодействие со спиртами
![]()
СН3—СН=O + 2СН3ОН <-> СН3—СН(ОСН3)—ОСН3 + Н2O
Присоединение реактива Гриньяра.
R—X + Mg -> R—Mg—X, где R — алкильный или арильный радикал, X — галоген
![]()
Восстановление оксосоединений.
Реакции окисления
СН3—СН=0 + 2[Ag(NH3)2]OH -> CH3COONH4 + 2Ag + 3NH3 + H20
Взаимодействие с водой. Вода присоединяется по связи С—О:
![]()
3. Химические свойства NH2-rpyппы аминокислот. Биологически важные реакции аминокислот.
Реакция образования пептидной связи между NH2 and COOH группами.
Аминокислоты образуют соли с неорганическими кислотами за счет аминогруппы, например:
![]()
Под действием азотистой кислоты аминокислоты превращаются в гидроксикислоты:
![]()
Аминогруппа легко ацилируется под действием ангидридов или галогенангидридов кислот:
![]()
и алкилируется галогеналкилами. В результате можно получитьвторичные, третичные аминокислоты и, наконец, четвертичные аммониевые основания:
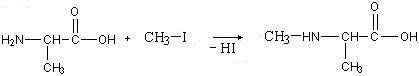

4. Осуществить превращения: циклопропан → I .3-дибромпропан → 1,3-пропандиол → малоновая кислота → уксусная кислота.
Циклопропан+бром2= I .3-дибромпропан
+натрийоаш=1,3-пропандиол
+окисление=малоновая кислота
-Co2= уксусная кислота
Билет № 38
1. Классификация органических реакций по механизму, примеры.
Радикальные
реакции идут с таким разрывом ковалентной
связи, при котором из двух электронов,
образовывавших связь, один остается у
одного фрагмента молекулы, а другой —
у другого:
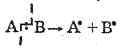 Соответственно,
оба фрагмента при этом электронейтральны
и имеют неспаренный электрон. Такие
частицы называются свободными
радикалами
Соответственно,
оба фрагмента при этом электронейтральны
и имеют неспаренный электрон. Такие
частицы называются свободными
радикалами
Нуклеофил (нуклеофильная частица) — это частица, имеющая неподеленную пару электронов. Эта пара электронов может быть использована для образования новой ковалентной связи. Необходимо подчеркнуть, что нуклеофил не обязательно является отрицательным ионом. Так, молекула аммиака (или какого-либо амина) имеет при атоме азота неподеленную электронную пару и является нуклеофилом, будучи электронейтральной. Электрофил (электрофильная частица) — это частица, имеющая вакантную электронную орбиталь на валентном уровне. При взаимодействии с какой-либо частицей, имеющей пару электронов, электрофил может принять эту пару на свою свободную орбиталь и за счет этого образовать новую связь. Так же как и в случае нуклеофила, электрофил может быть электронейтральной молекулой (например, ВН3).
Реакции:
присоединение: RCH=CH2+XYRCHX—CH2Y,
В них обычно участвуют соединения, содержащие двойную или тройную связь. Разновидности реакций присоединения: гидрирование, гидратация, гидрогалогенирование, полимеризация. Примеры данных реакций:
to
Н2С = СН2 + Н2 → CН3 – СН3
этилен этан
to
HC=CH + HCl → H2C=CHCl
ацетилен хлорвинил
to
n СН2=СН2 → (-СН2-СН2-)n
этилен полиэтилен
замещение: RCH2X+YRCH2Y+X,
К разновидности реакции замещения можно отнести нитрование и галогенирование предельных углеводородов, ароматических соединений и спиртов:
C6H6 + Br2 → C6H5Br + HBr
бензол бромбензол
C2H5OH + HCl → C2H5Cl + H2O
этанол хлорэтан
отщепление (элиминирование): RCHX—CH2Y RCH=CH2+XY,
полимеризация: n(CH2=CH2)C—CH2—CH2—)n.
Механизм
реакций органических соединений
1.
Если общая электронная пара делится
между атомами, то образуются радикалы
— частицы, имеющие неспаренные электроны.
Такой разрыв связи называется радикальным,
или гемолитическим:
 Образующиеся
радикалы взаимодействуют с имеющимися
в реакционной системе молекулами или
друг с другом:
СН3+Сl2СН3Сl+ .Сl
.СН3+.CН3С2Н6
По
радикальному механизму протекают
реакции, в которых разрыву подвергаются
связи малой полярности (С—С, С—Н, N—N)
при высокой температуре, под действием
света или радиоактивного излучения.
2.
Если при разрыве связи общая электронная
пара остается у одного атома, то образуются
ионы — катион и анион. Такой механизм
называется ионным, или гетеролитическим.
Он приводит к образованию органических
катионов или анионов:
Образующиеся
радикалы взаимодействуют с имеющимися
в реакционной системе молекулами или
друг с другом:
СН3+Сl2СН3Сl+ .Сl
.СН3+.CН3С2Н6
По
радикальному механизму протекают
реакции, в которых разрыву подвергаются
связи малой полярности (С—С, С—Н, N—N)
при высокой температуре, под действием
света или радиоактивного излучения.
2.
Если при разрыве связи общая электронная
пара остается у одного атома, то образуются
ионы — катион и анион. Такой механизм
называется ионным, или гетеролитическим.
Он приводит к образованию органических
катионов или анионов:

Органические
ионы вступают в дальнейшие превращения.
При этом катионы взаимодействуют с
нуклеофильными («любящими ядра»)
частицами (Н2О, NH3, Сl-, Br-, I- и другие анионы
кислот и т.п.), а органические анионы —
с электрофильными («любящими электроны»)
частицами (H+, катионы металлов, галогены
и др.), например: