
- •Глава 8 Блохин а.В.
- •Глава 8 термодинамика жидких растворов
- •8.1. Давление насыщенного пара растворителя над раствором. Закон Рауля.
- •8.2. Давление насыщенного пара растворенного вещества над раствором. Закон Генри.
- •8.3. Состав насыщенного пара идеального жидкого раствора.
- •8.4. Диаграммы равновесия «жидкость – пар» идеальных бинарных растворов. Правило рычага.
- •8.5. Температура кипения идеального раствора. Диаграмма состояния «температура кипения – состав».
- •8.6. Термодинамическое обоснование разделения жидкостей перегонкой.
- •8.7. Реальные растворы. Положительные и отрицательные отклонения от закона Рауля.
- •8.8. Законы Гиббса-Коновалова.
- •8.9. Химический потенциал компонента в идеальном и предельно разбавленном жидком растворе.
- •8.10. Химический потенциал компонента в реальном растворе. Активность.
- •8.11. Избыточные термодинамические функции. Термодинамическая классификация растворов.
- •8.12. Растворимость газов в жидкостях.
- •8.13. Равновесия «жидкость – жидкость» и «пар – жидкий раствор» в системах с ограниченной взаимной растворимостью жидкостей.
- •8.13.1. Равновесие «жидкость – жидкость» в системах с ограниченной взаимной растворимостью жидкостей.
- •8.13.2. Равновесие «пар – жидкий раствор» в системах с ограниченной взаимной растворимостью жидкостей.
- •8.14. Равновесие «пар – жидкость» в системах с взаимно нерастворимыми жидкостями.
8.8. Законы Гиббса-Коновалова.
Законы Гиббса-Коновалова (1881 г.) установливают соотношения между составами равновесных жидких растворов и составами их паров, а также общим давлением насыщенного пара над ними.
Первый закон Гиббса-Коновалова гласит: в насыщенном паре над раствором преобладает по сравнению с раствором тот компонент, добавление которого к раствору приводит к возрастанию общего давления насыщенного пара (пар обогащен легколетучим компонентом). Данный закон выполняется для любых растворов, а на рассматриваемом явлении основана фракционная перегонка (ректификация), позволяющая разделить смесь взаимно-растворимых жидкостей.
Докажем первый закон Гиббса-Коновалова, для чего воспользуемся уравнением Дюгема-Маргулеса (8.10), устанавливающим связь между изменениями парциальных давлений пара компонентов и составом раствора при постоянных температуре и давлении. В расчете на 1 моль жидкого бинарного раствора указанное уравнение принимает вид
![]() .
.
![]() . (8.35)
. (8.35)
Преобразуем уравнение (8.35):
![]() . (8.36)
. (8.36)
Учтем, что
![]() ,
,
![]() ,
,
тогда
![]() . (8.37)
. (8.37)
Поскольку
![]() ,
,
![]() ,
,
то
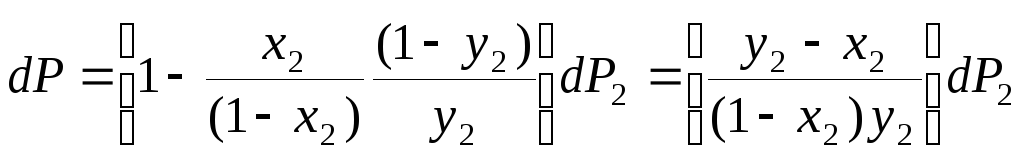 . (8.38)
. (8.38)
Разделим правую и левую части уравнения (8.38) на dx2, получим:
 . (8.39)
. (8.39)
Поскольку производная (dP2/dx2) > 0 (парциальное давление второго компонента в паре увеличивается с ростом его мольной доли в растворе), то знак производной (dP/dx2) определяется знаком разности (y2 – x2). Если y2 > x2, то (dP/dx2) > 0, что и требовалось доказать.
С учетом вышеизложенного первый закон Гиббса-Коновалова может быть сформулирован и так: общее давление пара над раствором растёт с ростом доли в растворе того компонента, который богаче представлен в паре (более летучего компонента).
Второй закон Гиббса-Коновалова касается более частных случаев и выполняется для реальных растворов с большими отклонениями от закона Рауля, на кривых «общее давление пара – состав» для которых имеются минимумы или максимумы. Второй закон Гиббса-Коновалова гласит: максимум на кривой общего давления соответствует минимуму на кривой температур кипения и отвечает такому равновесию раствора и насыщенного пара, при котором составы фаз одинаковы, и наоборот.
Экстремумы на кривой зависимости общего давления насыщенного пара от состава раствора удовлетворяют условию (dP/dx2) = 0, а в соответствии с уравнением (8.39) это возможно, только если в этих точках y2 = x2. Итак, в экстремумах общего давления пара (или температур кипения) раствор и насыщенный пар имеют одинаковый состав.
Возможные диаграммы состояния бинарных систем с максимумом на кривой давления пара и минимумом на кривой температур кипения представлены на рис. 8.7.
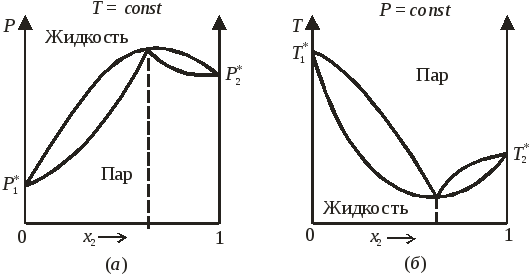
Рис. 8.7. Диаграммы состояния бинарных систем с максимумом на кривой давления пара (а) и минимумом на кривой температур кипения (б).
Смеси, у которых раствор и пар одинаковы по составу, называются азеотропными, или нераздельнокипящими. Путём перегонки азеотропные растворы не разделяются (составы фаз равны). Но их можно разделить следующими методами:
— путём химического связывания одного из компонентов;
— путем добавления в систему третьего компонента;
— путем ректификации на двух последовательных колонках при различных давлениях.
Примерами азеотропных смесей с минимумами на кривых температур кипения являются растворы, содержащие Н2О и С2Н5ОН (96,5%), метанол и ацетон. Примерами азеотропных смесей с максимумами на кривых кипения являются растворы, содержащие Н2О и НСl (20%), ацетон и хлороформ.
Третий закон Гиббса-Коновалова гласит: в изотермических или изобарических условиях состав насыщенного пара и состав жидкого раствора меняются синбатно (составы обеих фаз меняются в одном направлении). Данный закон логично следует из изученного материала и для его обоснования достаточно еще раз внимательно изучить диаграммы состояния, представленные, например, на рис. 8.3 – 8.5.
