
- •Введение
- •Глава 1. Основные положения координационной теории
- •1.1. Определение комплексных соединений
- •1.2. Основные понятия
- •1.3. Номенклатура комплексных соединений
- •1.4. Классификация комплексных соединений
- •1.5. Изомерия комплексных соединений
- •Глава 2. Природа химической связи в комплексных соединениях
- •2.1. Электростатическая теория
- •2.2. Метод валентных связей
- •2.3. Теория кристаллического поля
- •2.4. Теория поля лигандов
- •Глава 3. Свойства комплексных соединений
- •3.1. Окраска комплексных соединений
- •Периода в водном растворе
- •3.2. Магнитные свойства комплексных соединений
- •3.3. Равновесия в растворах комплексных соединений
- •3.4. Устойчивость комплексных соединений
- •3.4.1. Природа центрального атома и лигандов
- •3.4.2. Хелатный эффект
- •3.4.3. Стерические факторы
- •3.5. Кинетика и механизм реакций обмена лигандов
- •3.6. Кислотно - основные свойства комплексных соединений
- •3.7. Окислительно-восстановительные свойства комплексных соединений
- •Глава 4. Координационные соединения металлов
- •4.1. Подгруппа железа
- •4.1.1. Железо
- •4.1.2. Кобальт
- •4.1.3. Никель
- •В комплексных соединениях металлов подгруппы железа
- •4.2. Платиновые металлы
- •В комплексных соединениях платиновых металлов
- •4.3. Подгруппа марганца
- •В комплексных соединениях металлов подгруппы марганца
- •4.4. Подгруппа хрома
- •Комплексных соединениях металлов подгруппы хрома
- •4.5. Подгруппа ванадия
- •В комплексных соединениях металлов подгруппы ванадия
- •4.6. Подгруппа титана
- •В комплексных соединениях металлов подгруппы титана
- •4.7. Подгруппа цинка
- •В комплексных соединениях металлов подгруппы цинка
- •4.8. Подгруппа меди
- •В комплексных соединениях металлов подгруппы меди
- •4.9. Подгруппа алюминия
- •4.10. Комплексные соединения s-элементов
- •Катионов подгрупп iАи iiа при 25оС
- •Глава 5. Координационные соединения и медицина
- •5.1.Основные биолиганды
- •5.2. Некоторые основные биометаллы
- •5.3. Избыток и недостаток металлов-микроэлементов
- •5.4. Хелатотерапия
- •5.5. Лекарственные препараты в качестве лигандов
- •5.6. Координационные соединения металлов как противоопухолевые средства
- •Приложение
- •Им окраски
- •Литература
- •Оглавление
- •Глава1.
- •Глава2.
- •Глава3.
- •Глава 4
- •Глава5. Координационные соединения
- •Учебное пособие
- •117997, Москва, ул. Островитянова, д.1.
3.2. Магнитные свойства комплексных соединений
Известно, что магнитные эффекты делятся на два типа. один из которых возникает вследствие движения электронов, другой –
из-за наличия у электронов спинового и орбитального моментов. Первый из этих эффектов обуславливает явление диамагнетизма, второй - парамагнетизма. Спиновые и орбитальные моменты электронов обуславливают явление парамагнетизма и связанных с ним явлений ферромагнетизма и антиферромагнетизма. Молекулы с целиком заполненными электронными оболочками не обладают магнитными свойствами, так как не имеют вырожденных состояний, способных расщепляться под действием магнитного поля. Но, поскольку магнитное поле индуцирует в заполненных оболочках небольшой магнитный момент, противоположный внешнему полю, такие молекулы выталкиваются из магнитного поля. Такие молекулы называются диамагнитными. Молекулы, имеющие неспаренные электроны, втягиваются в магнитное поле и называются парамагнитными.
В большинстве комплексных соединений ионы металлов, являющиеся единственными источниками парамагнитных эффектов, изолированы друг от друга большим количеством магнитно инертных атомов лигандов. Это магнитное разбавление парамагнитных центров обычно сильно уменьшает взаимодействия, приводящие к ферромагнетизму и антиферромагнетизму.
Диамагнетизм и парамагнетизм – эффекты противоположные, поэтому при расчёте магнитного момента комплекса металла приходится учитывать диамагнетизм лиганда. В любом случае поле внутри образца, называемое магнитной индукцией В, отличается от поля в свободном пространстве Н:
В = Н + 4I ,
где I - интенсивность намагничивания, т.е. степень ориентации диполей или поляризации заряда, индуцированного полем. Наиболее существенной с химической точки зрения величиной является молярная магнитная восприимчивость м. Магнитную восприимчивость измеряют экспериментально (методами Гуи, Фарадея или с помощью ЯМР). Используя найденное значение, в соответствии с теорией магнитной и электрической поляризации можно вычислить величину магнитного момента:
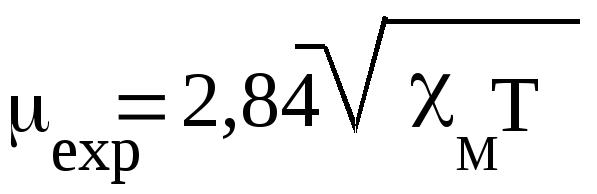
Исходя из предполагаемой электронной конфигурации иона-комплекообразователя можно рассчитать величину магнитного момента по уравнению квантовой механики (μth) :
![]()
Значение суммарного спина системы рассчитывают по формуле s=0,5n для заданного числа «n» неспаренных электронов. Значение th для числа «n» неспаренных электронов, равного 1,2,3,4,5 равно соответственно:1,73; 2,83; 3,87; 4,90; 5,92 магнетонов Бора(B). Например, высокоспиновый комплекс Mn(II) - [Mn(H2O)6]2+ должен иметь 5 неспаренных электронов
(d5 - конфигурация). Величины th (5,92 магнетонов Бора) и exp(5,86 магнетонов Бора) близки, следовательно, теоретическое предсказание верное. Из табл.4 видно, что «чисто спиновая формула» находится в хорошем соответствии с наблюдаемым магнитным моментом.
Для диамагнетиков характерна отрицательная магнитная восприимчивость, для парамагнетиков - положительная. Эффект парамагнетизма - положительная магнитная восприимчивость –резко возрастает, если в структуре вещества парамагнитные ионы или атомы взаимодействуют друг с другом, сближаясь на короткие расстояния. Такой эффект называется ферромагнетизмом.
Парамагнитные ионы могут взаимодействовать друг с другом непосредственно, сближаясь на короткое расстояние, либо через мостиковые лиганды. При этом парамагнитные центры ориентируют свои магнитные поля в противоположных направлениях – возникает эффект антиферромагнетизма. Эффект антиферромагнетизма приводит к уменьшению магнитного момента и иногда к диамагнетизму, когда находящиеся по соседству ионы металла объединяют свои неспаренные электроны, либо непосредственно образуя ковалентную связь, либо прямо перенося их через лиганд. Поскольку полиметаллические центры довольно часто встречаются в металлоферментах и других биологических системах вопросы антиферромагнетизма имеют большое значение. Эта проблема существенна для понимания магнитных свойств железосеропротеинов, содержащих два,четыре или восемь атомов железа на 1 моль белка, переносчиков молекулярного кислорода гемэритрина и гемоцианина, содержащих пары антиферромагнитно связанных ионов железа и меди соответственно, некоторых медьсодержащих оксидаз, а также оксигемоглобина, диамагнетизм которого связан с наличием низкоспинового железа(II) и синглетного кислорода или железа(III), антиферромагнитно связанного с супероксид-ионом.
Детальная теория магнитных свойств показывает, что парамагнетизм иона связан с общим угловым моментом неспаренных электронов, а не с их числом.
Таблица 4. Магнитные свойства d -элементов 4 периода
|
Кон- фи гура- ция |
Элемент |
Высокоспиновые октаэдрические комплексы |
Низкоспиновые октаэдрические комплексы |
||
|
расч μth |
эксп μexp |
расч μth |
эксп μexp |
||
|
do |
Sc(III) |
0 |
диамагнитны |
|
|
|
Ti(IV) |
|||||
|
V(V) |
|||||
|
Cr(VI) |
|||||
|
Mn(VII) |
|||||
|
d1 |
Ti(III) |
1,73 |
1,7-1,8 |
||
|
V(IV) |
|||||
|
Mn(VI) |
|||||
|
d2 |
Ti(II) |
2,83 |
2,75-2,85 |
||
|
V(III) |
|||||
|
Fe(VI) |
|||||
|
d3 |
V(II) |
3,87 |
3,7-3,9 |
||
|
Cr(III) |
|||||
|
Mn(IV) |
|||||
|
d4 |
Cr(II) |
4,90 |
4,8-4,9 |
2,83 |
3,20-3,30 |
|
Mn(III) |
|||||
|
Fe(IV) |
|||||
|
d5 |
Mn(II) |
5,92 |
5,85-5,95 |
1,73 |
1,8-2,4 |
|
Fe(III) |
|||||
|
d6 |
Fe(II) |
4,90 |
5,1-5,7 |
0 |
диамаг-нитны |
|
Co(III) |
|||||
|
Ni(IV) |
|||||
|
d7 |
Co(II) |
3,87 |
4,3-5,2 |
1,73 |
1,8-2,0 |
|
Ni(III) |
|||||
|
d8 |
Ni(II) |
2,83 |
2,8-3,5 |
0 |
диамаг- нитны |
|
Cu(III) |
|||||
|
d9 |
Cu(II) |
1,73 |
1,7-2,0 |
||
|
d10 |
Cu(I) |
0 |
|
||
|
Zn(II) |
|||||
